实验一 分析天平的称量和滴定分析操作练习
湖北工程学院 化学与材料科学学院 分析实验报告(2013)
实验一 分析天平的称量和滴定分析操作练习
(学号:012301314211 姓名:何艳 指导教师:夏彩芬 实验日期:20xx年9月11日)
摘要(Abstracts):为了熟悉电子天平的原理和使用原则,学习其基本操作和常用称量方法,本实验通过观摩老师操作及自己练习来较 为全面的掌握电子天平的使用;为了学习滴定分析常用仪器的洗涤和正确使用方法,确定以甲基橙为指示剂的滴定终点,本实验以盐酸滴定氢氧化钠溶液为基础来练习滴定操作。
In order to be familiar with electronic balance principle and the use of the principle, study its basic operation and common weighing method, this experiment by watching the teacher operation and their practice to a more comprehensive grasp the use of electronic balance. In order to study the titration analysis commonly used instruments of washing and used correctly.Method, methyl orange as the indicator of titration end point, the experiment on the basis of hydrochloric acid titration sodium hydroxide solution to practice titration.
关键词(Key Words): 电子天平;滴定;分析;偏差; 相对偏差 前言(Preface)
近些年来,基于杠杆原理的分析天平已逐渐被淘汰,取而代之的是电子分析天平,电子分析天平是常用分析天平之一,是基于电磁力平衡原理来称量的天平,其特点是称量准确可靠、显示快速清晰并且具有自动检测系统、简便的自动校准装置以及超载保护等装置。滴定操作是分析化学实验学习常量分析中最基本且无比重要的操作,滴定分析常用的玻璃仪器主要有滴定管、移液管、吸量管、容量瓶等主要仪器,学习并掌握滴定操作则对于学习分析化学显得尤为重要。
1. 实验部分
1.1主要仪器和试剂
主要仪器:电子天平 称量瓶 50mL烧杯 酸式滴定管(25mL) 碱式滴定管(25mL) 锥形瓶
主要试剂:HCl NaOH 甲基橙溶液 NaCl晶体试样
1.2实验内容
1.2.1实验原理
电子分析天平的原理:电子分析天平是基于电磁力平衡原理来称量的天平。在磁场中放置通电线圈,若磁场强度保持不变,线圈产生的磁力大小与线圈中的电流大小成正比。称物时,物体产生向下的重力,线圈产生向上的电磁力,为维持两者的平衡,反馈电路系统会很快调整好线圈中的电流大小,达到平衡时,线圈中的电流大小与物体的质量成正比,因而可显示物体的质量。
滴定原理:盐酸和氢氧化钠溶液相互滴定时,其化学计量点pH为7.0,滴定的pH 突跃范围为4-10,而指示剂甲基橙的变色pH范围为3.1-4.4,因而以甲基橙确定滴定终点,则滴定就相对较为准确。
1.2.2电子天平的称量练习步骤
①水平调节。称量前观察水平仪,调整水平调节脚使小气泡位于水平仪圆圈内。
②按下清零键,使其显示为0.0000g,打开天平侧门,将干燥洁净烧杯置于秤盘中心称量,观察并记录数据。
③按下清零键,使其显示为0.0000g,打开天平侧门,将盛有氯化钠晶体的称量瓶用纸条包住轻放至秤盘中心,观 察并记录数据。
④同样用纸条包住取出称量瓶将试样轻敲至烧杯中,再称量,看敲出试样是否在0.30-0.32g之间,若敲出量不够, 则继续敲出,直至差值在此范围内并记录数据。
⑤将盛有敲出试样的烧杯置于天平上称量并记录数据。
1.2.3滴定操作步骤
①先用自来水冲洗滴定仪器及玻璃仪器,粗略洗净后将滴定管内装入适量自来水,并检查是否漏水,如果漏水,作出相应处理。
②洗涤和查漏处理完后用蒸馏水洗涤容器,再用待装液润洗滴定管2-3次。
③装好溶液后检查尖嘴部分和橡胶管内是否有气泡并排除气泡,调节液面刻度在0.00mL。
④从碱式滴定管中放出20.00mL的NaOH溶液于已净的锥形瓶中,再滴加2d甲基橙指示剂,然后用酸式滴定管中的盐酸滴定锥形瓶中的氢氧化钠溶液,滴定时要边滴边摇,左手控制活塞,右手摇动锥形瓶,眼睛注视锥形瓶内
湖北工程学院 化学与材料科学学院 分析实验报告(2013) 的颜色变化,直至锥形瓶内溶液的颜色由黄色突然变为明显的橙色,且在半分钟之内颜色不褪去。
⑤将滴定管从滴定管夹上取下,用右手大拇指和食指捏住滴定管上部使滴定管自然下垂,视线与凹液面相切读数并记录数据,多次重复操作练习。
1.2.4实验数据处理及结果
递减法称量数据记录
编号 1 2 3 4 5
m空烧杯/g 50.5374 50.5377 50.5370 50.5373 50.5378
称量瓶倒出质量m1/g 0.3024 0.3024 0.3105 0.3150 0.3122
m
m烧杯+试样/g 50.8420 50.8418 50.8486 50.8527 50.8523 /g 0.3046 0.3041 0.3211 0.3154 0.3145 烧杯中试样
偏差(m2-m1)/mg 2.2 1.7 0.6 0.4 2.3
滴定数据记录
VNaOH/mL 20.00 20.00 20.00
VHCl/mL 19.70 19.71 19.75 相对偏差/% -0.10 -0.051 0.15
2.结论(Conclusions)
①电子天平的称量方法有两种:直接称量法和递减称量法;
②称量时应从侧门取放物质,读数时应关闭箱门以免空气流动引起天平示数的变化;
③盐酸滴定氢氧化钠时选用试剂甲基橙,氢氧化钠滴定盐酸时选用试剂酚酞;
3.参考文献(References)
[1]武汉大学,吉林大学等编.分析化学实验(第五版)[M].北京:高等教育出版社,2012:97-101.
[2]梁焕梅.电子天平测量结果的不确定度评定[J].大众科技,2010(10).
[3]唐艳宏.电子天平的使用和维护[J].西藏科技,2010(07).
4.致谢(Thanks)
本次实验是在夏彩芬老师的悉心指导下完成,夏老师一丝不苟,严谨作风对我深有影响,每一个细节夏老师都会再三强调,每一个不规范的操作夏老师都会指出来,为我们认真对待每次实验奠定了良好的基础。
第二篇:称量与滴定基本操作练习
分析化学实验要求
1. 进入实验室: a. 提前10min;b. 着白大褂;c. 不能穿拖鞋;d.带预习报告。
2. 实验过程中: a. 台面整洁,仪器摆放合理整齐;b. 站立操作,规范认真;
c. 原始数据及时记录在实验报告上,实事求是,规范正确。
3. 实验结束后:a. 仪器洗净,归架回柜;b. 台面整理,公用试剂归架摆放整齐。
4. 值日生职责: a. 水、电、门、窗、地面、垃圾; b. 实验台整理,清洁。
实验一、电子天平称量及滴定基本操作练习(4学时)
一、目的要求:
1. 熟悉和掌握分析天平的使用方法;
2. 学会正确使用称量瓶和用各种称量法称量试样;
3. 学习掌握定量分析常用仪器的洗涤和使用方法;
4. 初步练习滴定分析操作,学会正确判断滴定终点。
二.方法原理:
电子天平依据电磁力平衡原理,可进行直接称量。速度快、精度高。
酸碱互滴:HCl + NaOH = NaCl + H2O pHsp=7.0
三.实验内容:
(一).分析天平称量练习
1. 检查天平:a. 是否水平,b. 秤盘是否清洁,c. 干燥剂是否失效。
2. 开启天平,预热半小时后:a. 调节零点(TARE),b. 用标准砝码校准
(TARE → CAL → 放上砝码 → CC → 200.0000 ± 0.2 mg)。
3. 称量练习
a. 直接称量法:称两坩埚及称量瓶质量。
b. 递减称量法(差减法或减量法):
称0.3-0.4g粗K2Cr2O7两份于坩埚中,并验证(?≤±0.4mg)。
c. 固定质量称量法(指定质量称量法或增量法):
称0.5000g粗K2Cr2O7一份于坩埚中(?≤±0.2mg)。
4. 使用登记、天平复原(关机、加罩)、台面整理
(二).滴定分析基本操作练习
1. 仪器洗涤:(干净——内壁不挂水珠)
去污粉刷洗 → 自来水冲洗 → 蒸馏水润洗(少量多次原则)
2. 操作液的装入:
滴定管检漏→ 洗涤→ 润洗→ 装液→ 排除气泡→ 调节零点→ 悬滴挂除
3. 酸碱互滴基本操作练习:
a. HCl滴定NaOH 甲基橙(MO) 1D 黄色→橙色
b. NaOH滴定HCl 酚酞(PP) 2-3D 无色→微红色
四.数据记录与结果处理
1. 要求:规范、正确、清晰、实事求是
准确质量—— 0.0001g; 准确体积—— 0.01mL
2. 称量结果记录格式
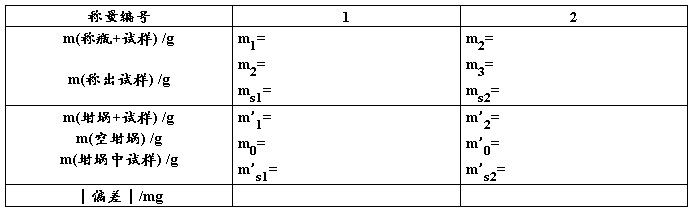
3. 实验报告的书写:
——思路清晰、认真规范
六.思考题
P156:1、4、5
-
实验四 分析天平称量练习 实验报告参考
实验教案实验四分析天平称量练习一、实验目的1.掌握直接称量法、固定质量称量法和递减称量法。2.练习并熟练掌握分析天平的基本操作和常…
-
分析天平的称量练习
分析天平的称量练习一实验目的1掌握电子天平的正确使用方法2熟悉直接称量法固定质量称量法和减量称量法的操作方法3了解分析天平的结构及…
-
实验二分析天平称量练习
实验二分析天平称量练习一、实验目的分析天平的称量练习,学会熟练地使用分析天平,训练准确称取一定量的试样。二、实验用品1、半自动电光…
-
分析天平的使用实验报告
分析化学实验课程实验报告实验名称绪论及分析天平称量练习指导老师姓名年级学号成绩0分一实验目的1学习分析天平的基本操作和样品的称量方…
-
实验一 分析天平称量练习及标准溶液配制
实验一分析天平称量练习及标准溶液的配制一实验目的与要求1了解电子天平的构造及使用规则学会正确使用分析天平2掌握直接称量法和减量称量…
-
滴定分析基本操作练习
第十一章定量分析和仪器分析实验实验七十一酸碱溶液的配制和浓度的比较一目的与要求1熟练滴定管的洗涤和使用及滴定操作学会准确地确定终点…
- 实验3 滴定分析基本操作练习
-
实验一 滴定分析基本操作练习
实验一分析天平称量练习实验目的1学习托盘天平和电子天平的基本构造和使用方法2掌握准确简明规范地记录实验原始数据的方法实验原理1托盘…
-
实验二 滴定分析操作练习
实验二滴定分析操作练习一实验目的与要求1掌握滴定管的洗涤和使用方法2熟练掌握滴定操作3掌握酸碱标准溶液的配制方法酸碱溶液相互滴定比…
-
实验一 滴定分析基本操作练习
实验一酸碱溶液的配制和浓度的比较一目的与要求1熟练滴定管的洗涤和使用及滴定操作学会准确地确定终点的方法2掌握酸碱标准溶液的配制和浓…
-
分析天平的使用实验报告
分析化学实验课程实验报告实验名称绪论及分析天平称量练习指导老师姓名年级学号成绩0分一实验目的1学习分析天平的基本操作和样品的称量方…