实验2_双液相实验报告
化工实验报告
实验名称 双元系液液相平衡实验
班级 化21 姓名 张腾 学号 2012011864 成绩
实验时间 2014.11.26 同组成员 何佳倩
1. 实验目的
(1)学习双元系液液相平衡测定的原理
(2)绘制异丁醇-水体系相图,学会分配系数的计算
(3)掌握基团贡献法计算液液相平衡的方法
2. 实验原理
异丁醇与水部分互溶,恒压下二元液夜相平衡体系自由度f=1,因此确定了T,组成随之确定。恒温下,通过测定两相折光指数,便可查图获得平衡组成,并获得液液平衡情况。
3. 仪器设备与化学试剂
(1)仪器设备
恒温水浴,电磁加热搅拌器,阿贝折光仪,液液平衡釜,取样器和吸管。
(2)化学试剂
分析纯级异丁醇和去离子水,其部分物性如下表:
表 1 异丁醇与水的物理性质

4. 实验步骤
(1)合上电闸,打开恒温槽,将温度恒定在30℃
(2)开电磁搅拌开关(不要打开加热开关)并调节至适当的搅拌速度
(3)观察平衡釜中的温度计,5min内温差不超过0.1℃,即停止搅拌
(4)静置5min,继续观察有无温度变化。
(5)仔细观察液液分界面,用清洁的吸管吸取上层清液,洗涤3次,再吸取上层样品,供折光分析用(注意,吸取样品时必须十分细心,防止上下液层有所混杂)
(6)将下层取样器沿着铁架降至液液平衡釜底部,抽出玻璃棒,使下层清液流入下层取样管中,再用清洁的吸管插入下层取样管中,按吸取上层样品的方法取样(注意:吸管需干燥,清洁)
(7)用阿贝折光仪分析样品,折光仪恒温25.5±0.1℃,取样两次取平均(注意:不要连续两次取同一相,以对原有平衡造成更大破坏,应按照上相、下相再上相、下相的顺序)
(8)将釜内温度提高至40及50℃,重复上述工作。
(9)实验完毕,关电源,将试液倒回回收瓶,做好清洁工作。
5. 实验数据记录及数据处理
5.1 原始实验数据
室温: 20.7 ℃; 大气压: 101325 Pa
表2实验数据
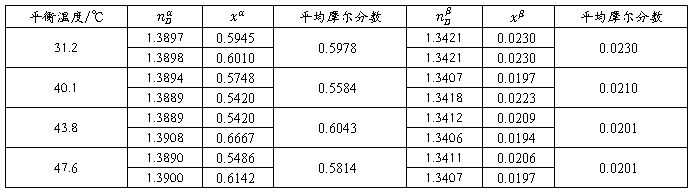
注:α相是上部的醇相,β相是下部的水相。
在25.5℃时,折光指数nD与异丁醇的摩尔分数χ1呈如下线性关系:
水相:nD=0.41903x+1.33246 x=(nD-1.33246)/0.41903
醇相:nD=0.01524x+1.38064 x=(nD-1.38064)/0.01524
将摩尔分数转化为质量分数,得到不同温度下水-异丁醇共轭体系中的组成如下表:
表 3 异丁醇-水体系质量分数
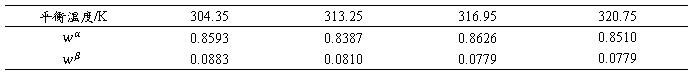
注:换算时取异丁醇的相对分子质量为74,水的相对分子质量为18。
另有已知数据如下表:
表 4 异丁醇-水体系质量分数

5.2 绘制二元相图
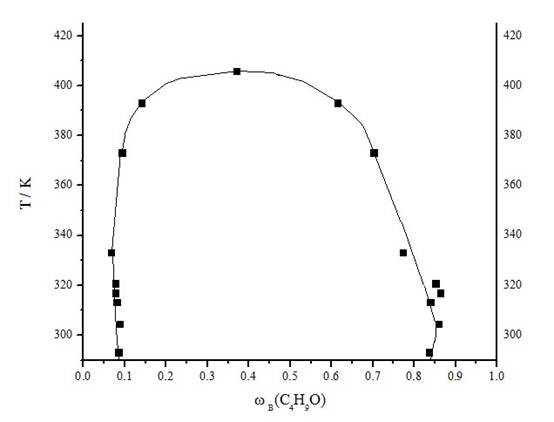
图1 异丁醇-水体系二元相图
5.3 计算异丁醇、水的分配系数
分配系数 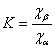 , 其中α为醇相,β为水相;
, 其中α为醇相,β为水相;
计算得不同温度下的分配系数如下,
表5 不同温度下异丁醇-水体系分配系数

5.4 UNIFAC法计算分配系数
对于某组分的相平衡有:
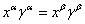 ………… (1)
………… (1)
分配系数:

利用UNIFAC理论,组分i的活度系数由两部分组成:
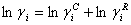 ………… (2)
………… (2)
式中: 为组合部分的活度系数;
为组合部分的活度系数;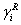 为剩余部分的活度系数。
为剩余部分的活度系数。
(1) 组合部分:
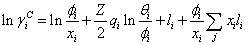 ………… (3)
………… (3)
其中: ,
,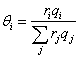
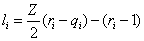 ,Z=10(配位数)
,Z=10(配位数)
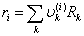 ,
,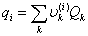
查文献[1]得各基团体积参数和表面积参数,计算如下:
记异丁醇为组分1,水为组分2,醇相为 ,水相为
,水相为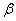 。则在
。则在 相中,
相中,
 ,
,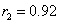
 ,
,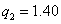
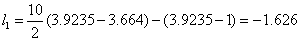
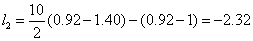

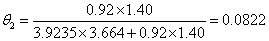
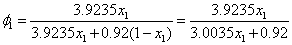
将以上参数代入(2)式,
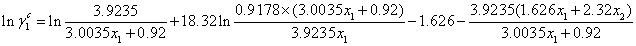 (2) 剩余部分:
(2) 剩余部分:
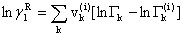 ………… (4)
………… (4)
其中,基团活度系数
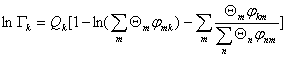 ………… (5)
………… (5)
其中: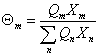 ,
,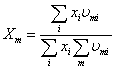 ,
, ,
,
查文献[2]得到各基团相互作用参数如下:
表6 基团配偶能量参数

利用表6数据,计算各基团相互作用参数如下:
表7 各基团相互作用参数计算

各基团摩尔分数如下:
表8 各基团摩尔分数
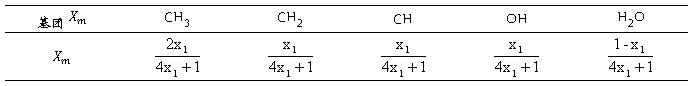
各基团面面积分数如下,
表9 各基团面积分数

将表7、8、9的数据代入(5)式,计算各基团活度系数 ;再将算得的
;再将算得的 代入(4)式,计算出
代入(4)式,计算出 。将
。将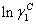 和
和 代入(2)式,可以将活度系数
代入(2)式,可以将活度系数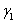 表示成只含
表示成只含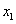 (注:此处代指醇相中异丁醇活度
(注:此处代指醇相中异丁醇活度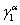 和浓度
和浓度 )的函数;同理可将水相中
)的函数;同理可将水相中 表示成只含
表示成只含 的函数。将(1)(2)联立即可计算分配系数K。
的函数。将(1)(2)联立即可计算分配系数K。
利用ASPEN软件进行物性分析计算活度系数求算分配系数,最后求得理论分配系数如下:
表10 分配系数的计算值和理论值
5.5 结果分析及实验小结
可以明显看出,实验结果和理论计算的结果有相当大的偏差,误差产生的原因是多种多样的,主要可能存在的因素应该有:
1、实验仪器的精确度过低,限制了最终的准确性。
2、阿贝折射仪需要进行温度校正,而本次实验没有进行温度校正,室温与阿贝折射仪的要求温度相差5℃,可能造成较大偏差。
3、人为因素的随机性可能产生随机误差,本次实验采集数据较少,出现大偏差的概率较大。
总结本次实验,总体进行的很顺利,唯一一点失误在于刚开始使用阿贝折射仪的时候误将二级干涉认为是一级干涉,事后经过计算才发现与实际不相符,但此时已经进行了一组实验,没有办法再进行补救,曾试图利用光学原理进行换算未果,所以31.5℃的数据是利用了其他组的数据进行处理的。虽然是一次比较严重的失误,但也让我在实验过程中了解了实验仪器的原理,发现了更多的现象。
在试验后的数据处理过程中,最为复杂的是利用UNIFAC模型计算分配系数,UNIFAC在数学上过于复杂,涉及参数非常多,这就给计算带来了很多不便,尝试过用MATLAB编写计算程序计算,但是由于其形式过于复杂而放弃,最后是查阅了相关资料,利用ASPEN进行了物性分析,很快就得到了结果。
6. 思考题
(1) 试解释液相分层的原因。
答:在一定温度压力下,水和异丁醇只能达到部分互溶,因此物质的量比在一定范围内的水的和异丁醇的混合物将会以异丁醇的水溶液和水的异丁醇溶液两种密度不同的形式存在,因此液相产生了分层。
(2)使用分配系数来评价溶液的萃取性能。
答:在低浓度范围内,分配系数为该溶质在两项中的浓度比,与温度、压力、以及溶质和两种溶剂的性质有关。分配系数与1相差越大,表明溶质在两液体中的浓度相差越大,说明溶质在溶解时对两种溶剂具有较高选择性。所用萃取剂的分配系数的值越大,萃取效果越好。本实验分配系数与1的差值较大,因此利用水萃取异丁醇是合理的。
(3)讨论温度和压力对二元系液液平衡的影响。
答: 温度对二元系液液平衡的影响:当温度改变时,共轭溶液中的两个溶解度均会发生变化。在异丁醇-水体系中,溶解度均随温度升高而增大,即两项浓度逐渐接近;当温度升高到406K时,两相浓度相等,界面消失,两相合并为一相。即为在最高临界溶解温度以上完全互溶,在此温度以下部分互溶;有些部分互溶的双液系具有最低临界溶解温度,当温度低于临界温度时完全互溶,高于临界温度时部分互溶。也有些双液系同时具有最高临界溶解温度和最低临界溶解温度。
压力对二元系液液平衡影响很小。
(4)分析所测试验数据的准确测程度,说明造成误差的原因。
实验结果误差较大,测量出的数据在相图的水相部分还能较好的符合相图,但在相图的油相部分偏差非常大。另外,后面计算出的分配系数K值也与实验值之间相差很大,存在较大的误差。推测实验误差原因:不同的温度采用了不用的仪器。测量误差,包括了测量过程中的人为操作误差及实验设备自身的读数误差。
[1] 化工过程综合实验 P13表1-5,王保国,清华大学出版社
[2]化工过程综合实验 P14表1-6,王保国,清华大学出版社
第二篇:实验2 dyl双液相图
物理化学实验备课材料
实验二完全互溶两组分液态混合物的气液平衡相图
一、基本介绍
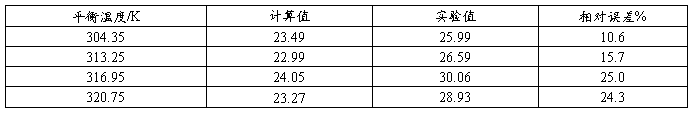
相平衡属于物理化学的重要教学内容,其中气液平衡是最常见,同时也是讨论最多的内容之一。理想的二组分体系在全部浓度范围内符合拉乌尔定律。结构相似、性质相近的组分之间可以形成近似的理想体系,此时体系的沸点组成图(T-x图)如下图1a所示。大多数情况下为非理想体系,这时在反映体系沸点与组成关系的T-x图上将出现或正或负的偏差,当这一偏差足够大时,T-x曲线上将出现极低点(对拉乌尔定律产生极大正偏差,如下图1b所示)或极高点(对拉乌尔定律产生极大负偏差,如下图1c所示)。
出现极大点的体系常见的有:
乙酸异戊酯—四氯乙烷;丙酮-氯仿;水—盐酸;水—硝酸等。
出现极小点的体系常见的有:
四氯化碳—乙酸乙酯;甲醇—苯;正丙醇—水;异丙醇—环己烷,乙醇—水等。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。注意,恒沸混合物不是一种物质,而是一种具有特定组成的混合物。在恒沸点是气液两相的组成一致。恒沸混合物的组成由温度或压力中的一个所确定,即指定温度,压力及组成由体系自定,不能改变。
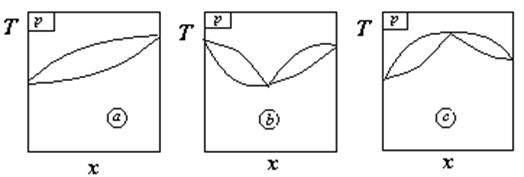
图1 两组分体系的等压T-x图
根据相平衡原理,对二组分体系,当压力恒定时.在气液平衡两相区,体系的自由度为1。若温度一定.则气液两相的组成也随之而定,反之亦然。当原溶液组成一定时,根据杠杆原理,两相的相对量也一定。反之,实验中利用回流的方法保持气液两相的相对量一定,则体系的平衡温度也随之而定。沸点测定仪就是根据这一原理设计的。
二、实验目的
1、用沸点测定仪测定常压下不同组成的正丙醇—水体系的沸点,绘制该体系的T-x图。
2、掌握沸点测定方法。
3、进一步掌握阿贝折射仪的测量原理及操作方法。
4、学会利用特鲁顿规则及克-克方程进行沸点的效正。
 三、实验原理
三、实验原理
测绘两组分体系的沸点-组成
相图要求同时测定不同总组成体系
的沸点以及气液两相的组成,本实
验采用简单的沸点测定仪进行沸点
测定,通过冷凝回流分离出气液
平衡时的气相冷凝液(馏出液)和
液相物(剩余液),并测量两液体的
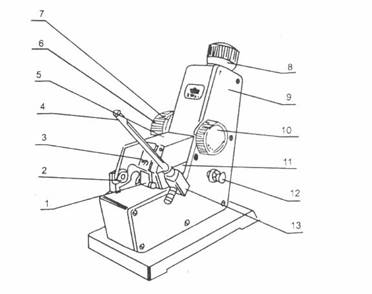
组成。沸点测定仪见右图1:
通过加热丝3或直接采用加热包
对置于瓶中的液体加热,到达混合物
的沸腾温度时(由温度计7显示),体
系中产生气相,气相在冷凝管8中冷凝
为液体,积存于冷凝管底部的小泡9中。
体系冷却后,通过分析小泡9(从冷凝
管上端用滴管取样)及园底瓶中(从取
样口4用滴管取样)的液体即得到气液
两相的组成。
气液两相的组成可以根据相对密度或其它方法确定,本实验中采用折光率的测定来表征样品的组成,具有快速、简单、样品量少等优点。组成测定使用的仪器是阿贝折射仪。

采用折光率来表征样品的组成(浓度)必须首先绘制工作曲线(或标准曲线),即样品折光率与组成的关系曲线。为此,可以通过配制系列不同体积含量的正丙醇—水溶液,测定其相应的折光率,然后绘制浓度-折光率标准曲线。由标准曲线即可得到一定折光率的样品浓度。
根据测定的沸点及该沸点所对应的气液两相的浓度,在T-x图上可绘制出两点,即气相点及液相点;通过测量多个不同总组成的体系即可得到多个气相点和液相点,将所有气相点及液相点分别连接并与纯物质(正丙醇和水)的沸点相连接,即得到封闭的正丙醇和水体系的T-x曲线。
四、实验仪器及试剂
沸点测定仪,阿贝折射仪,磁力搅拌加热包及磁子,水银温度计,玻璃漏斗,移液管,滴管;正丙醇、二次蒸馏水。
五、实验步骤
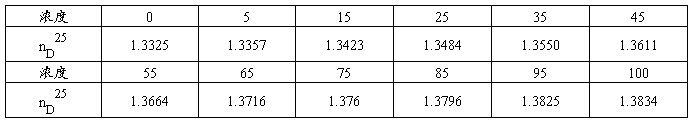
1、工作曲线的测绘
用移液管准确移取相应体积的蒸馏水和正丙醇,配成5%,10%,20%,30%,40%,50%,60%,70%,80%,90%,95%(v/v)的正丙醇水溶液,分别用阿贝折射仪测定其折光率,根据测量结果绘制工作曲线。
2、正丙醇和水体系的T-x曲线
2.1 溶液配制:用量筒分别量取相应体积的蒸馏水和正丙醇,配成10%,50%,70%,75%,90%,95%(v/v)的正丙醇水溶液。分别标记为样品1-6。
2.2 沸点测定:将上述样品通过取样口4加入至沸点测定仪中,开启冷凝管8的冷凝水,同时调节磁力搅拌加热包,搅拌下对样品升温,待回流冷凝管中开始出现冷凝液时,调小加热速率,保持体系均匀回流,温度计7显示温度稳定后记录温度即为该样品之沸点。
2.3 气液两相折光率测定:记录温度后停止加热,小心将沸点仪移出加热包冷却;待溶液冷至室温时,分别用滴管取出气相冷凝液及液相剩余液在阿贝折光仪上测定其折光率。
2.4 气液两相浓度的确定:根据测定的气液两相之折光率从工作曲线上读出对应的气液两相浓度,将该体系的沸点及气液两相浓度计入数据表。
2.5 将所有样品重复2.2-2.4步骤,记录相应数据。再将数据在T-x标出,将代表气相和液相组成的点依次连接,即得体系的T-x曲线。
六、数据记录
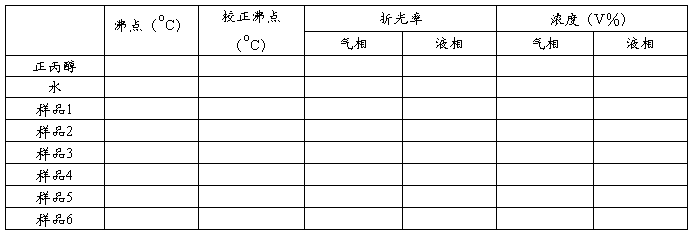
七、实验注意事项
1、沸点测定
组成不同的试样其沸腾温度是一直接测量值,因而测量的准确与否将直接影响相图的质量。实验不仅需要使用精度较高的温度计,而且测量前要对温度计进行校正;要将所得到的沸腾温度换算成标准状况下的温度值。同时实验过程中应注意大气压的变化,当外压偏离标准大气压时,可利用特鲁顿(Trouton’s Rule)规则及克-克方程进行沸点的效正。
特鲁顿规则: ΔvapH=88Tb
克-克方程: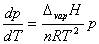
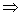
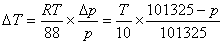
因此,T效正温度=T +ΔT
温度计在沸点仪上安装的位置对沸腾温度的测定影响也较大,文献资料表明,采用半浸式安装能准确反应出沸点温度。所谓半浸式即指温度计的水银球部分一半浸入溶液,另一半露在气相中,这样安装具有溶液用量少,操作简便,准确度高等优点。
沸点温度的读取应该是体系中气液两相到达平衡时的温度计指示的温度,在一定压力下为定值。但是在实际操作时可观察到温度计指示在体系沸腾时总是有一定的波动。回流的好坏将直接影响温度的稳定,因此实验操作时应保持体系均匀回流,温度计显示温度稳定即温度计指示上下波动范围相当时的温度即确定为为样品之沸点。
为了保证有一个很好的回流操作,要注意以下几点:(1)调压变压器控制的供热电压不易过高,以维持被测液体处于沸腾回流的状态为宜,要防止电压过高引起的暴沸。(2)回流时间不可过短。当沸腾温度趋于恒定后,还应维持2-3min的回流,使体系尽量达到平衡状态后,再记录沸点温度及取样测量折射率。
实验中有时可发现,虽长时间的回流,但温度总是上下波动而不能稳定。这多是由于沸点仪在吹制中贮存气相冷凝液的凹形贮槽的体积过大所至。出现此种情况时,可将沸点仪倾斜一下,使存留在凹形贮槽中的试样能减少一些。一般来说,这样处理即可使沸腾温度在较短时间内趋于恒定。
2、折光率的测定
折光率受温度的影响很大,因此必须在停止加热并使样品冷却到室温才能取样分析。同时对于试样折射率的测定要做到:动作迅速,铺满试样,锁紧旋钮,否则造成试样中低沸点成分的挥发,从而造成折光率数值测定的误差,能否快速准确地测定折光率是本实验的关键之一。
3、试剂及样品浓度问题
所使用的药品正丙醇应保证为分析纯,必要时应进行精制。样品浓度原则上由最终气液两相的折光率来表征,因此在配制样品时可以不作严格要求,样品用完后也可以回收利用。但是当样品浓度改变过多时,实验测定的数据离恒沸点较大,不利于通过作图确定恒沸组成。恒沸点是本实验体系的特征点,但它是通过相图绘制后从相图上得到的,而不是通过实验直接测定出来的。
实验过程中最好准备多支洁净的取样管,即每次取样时选用不同的取样管,这样可以保证测量的精度。如果只是有两支取样管,则需要一支用来取液相,另外一支用来取气相。并且需要在每次取样之前将取样管用待测液润洗一下,由于气相组分太少,所以需要在沸腾温度趋于恒定之后的1-2分钟内将取样管伸入储液凹槽内,用冷凝在凹形储槽中的气相冷凝液润洗一下,这样可以减少实验的误差,而且得到的试验点所联成的曲线比较平滑。
4、相图的绘制
根据实验数据正确绘制相图是实验技能训练的教学目的之一。在绘制相图时应注意以下几点:a.纵、横坐标的选取要注意比例;b.合理使用实验的实测点,连接数据点时不是要求简单的将每个实测点都连接起来,实测点可有取有舍,对于舍去的点要有充分的理内和根据,得到的曲线应为平滑的封闭曲线;c. 恒沸点的得到应是通过两气相线及两液相线的适当相交,即是说,在连接气液两相线时必需保证四条线相交于一点。
八、思考题解答
1、本实验中使用阿贝折射仪测定折光率要注意哪些问题?
答:a.测定样品及制定工作曲线时的温度应一致;b.测量应迅速;c.样品在棱镜上应铺成均匀的薄层;d.保护仪器,特别是棱镜镜面。
2、收集气相冷凝液的小泡(图2中部分9)容积过大,对测量结果有何影响?
答:若冷凝管下方的凹形贮槽体积过大,则会贮存过多的气相冷凝液,其贮量超过了按相平衡原理所对应的气相量,其组成不再对应平衡的气相组成,因此必然对相图的绘制产生影响。也就是说,小泡容积过大即要求平衡时气相的总量较大,这样势必难于使体系建立气液两相平衡,从而使温度波动较大,影响沸腾温度的判断。在非平衡状况下,可能使气相冷凝中含低沸点成分较多,造成气相线向低沸点成分所对应的坐标方向平移。
3、蒸馏时试样量过少,对测量结果有何影响?
答:试样量过少时,蒸馏瓶空间存有大量的蒸汽,当冷却后蒸馏瓶中液体(代表液相组成)包含有较多的气相冷凝液,即含低沸点成分较多,造成液相线向低沸点成分所对应的坐标方向平移。
4、平衡时,气液两相的温度应不应该一样?实际情况如何?怎样才能防止两相之间的温度差异?
答:应该是一致的;但实际情况可能不一致,其原因是仪器保温条件欠佳,气相物质与环境交换热量速率较快,气相温度将低于实际气液平衡温度。解决的办法是将测量温度计采用“半浸式”。
5、在加入不同数量的各组分时,如发生了微小的偏差,对相图的绘制有无影响?为什么?
答:在加入不同数量的各组分时,如发生了微小的偏差,对相图的绘制不会产生影响。因为加入组分量的不同,仅能引起相图中体系点位置的改变,而不会引起平衡两相组成的对应关系,因此只要将平衡两相的组成用折光仪测准,不会影响相图的绘制。
6、折射率的测定为什么要在恒温下进行?
答:因为折射率与温度有关,所以必须在恒温下进行。但是在通常情况下,折射率随温度的变化不大,因此在整个实验进行过程中,如果环境的温度基本不变,也可不必用恒温槽进行恒温测量。
7、影响实验精度的因素之一是回流的好坏。如何使回流效果好?它的标志是什么?
答:为了使回流效果好,首先保证装置的设计合理,使冷凝管与蒸馏瓶的间距尽可能短些,其次在回流时调整合适的加热状态,使蒸气冷凝的最高部位保持在冷凝管的中间位置上。最后一点是装置的密封性要好。
回流效果好的重要标志是在回流状态下温度保持不变,气相冷凝液的组成恒定。
8、由所得相图,讨论某一组成的混合物在简单蒸馏中的分离情况。
答:水和乙醇的二组分体系相图属于具有最低恒沸混合物的气液相图,其恒沸混合物的组成约为95%。因此,当混合物的组成小于95%时,蒸馏时,气相得到恒沸混合物。液相得到水;当混合物的组成大于95%时,蒸馏时,气相仍为恒沸混合物,而液相得到乙醇。
九、文献值
共沸点温度87.7 0C,组成含71.2%的正丙醇(质量百分比),体积百分比为88.56%。
十、预备实验结果
预备实验进行时条件:
室温T=25oC,大气压力为:10100Pa
1、工作曲线:
2、T-x图

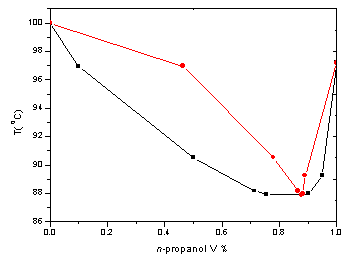
结果:共沸点温度87.9 0C,组成体积百分比为87.70%,与文献值相近。
十一、进一步讨论
1、间歇法测定完全互溶双液体系的T—X图
测定沸点与组成的关系时,也可以用间歇方法测定。先配好不同质量百分数的溶液,按顺序依次测定其沸点及气相、液相的折射率。
将配好的第一份溶液加入沸点仪中加热,待沸腾稳定后,读取沸点温度,立即停止加热。取气相冷凝液和液相液体分别测其折射率。用滴管取尽沸点仪中的测定液,放回原试剂瓶中。在沸点仪中再加入新的待测液,用上述方法同样依次测定。(注意:更换溶液时,务必用滴管取尽沸点仪中的测定液,以免带来误差。)
2、具有最低恒沸点的完全互溶双液体系很多,除了上面介绍的正丙醇-水体系外,再介绍一个异丙醇-环己烷体系。实验中两个体系的工作曲线及T—X图的绘制方法完全相同,只是样品的加入量有所区别,现介绍如下:
右半分支: 先加入20mL异丙醇,然后依次加入1mL 、1.5mL、2.0mL、2.5mL、3.0mL、6.0mL、25.0mL环己烷。
左半分支: 加入50mL环己烷,依次加入0.3mL、0.5mL、0.7mL、1.0mL、2.5mL、5.0mL、12.0mL的异丙醇。
3、丙醇
[英文]:propanol
[解释]:一种醇 。分子式C 3 H 7 OH。丙烷分子中的一个氢原子被羟基取代的化合物。因羟基可取代碳链两端或中间碳原子上的氢,故能生成两种异构体。正丙醇为无色液体77℃;熔点-126 .5℃,沸点97 .4℃,相对密度 0 .8035(20/4℃);溶于水、乙醇和乙醚 ; 可与水形成共沸点混合物 , 沸点 87℃,含水量28 .3%。异丙醇为无色可燃液体;熔点-89 .5℃,沸点82 .4℃,相对密度70 .7855 (20/4℃); 溶于水、乙醇、乙醚、丙酮等,与水形成共沸点混合物,沸点80 .37℃,含水量13%。丙醇的化学性质与 乙醇 相似。
正丙醇在工业上是由乙烯、一氧化碳和氢气在高压和钴催化下制备: 异丙醇是由丙烯在硫酸作用下水合或由丙酮通过催化氢化反应制得。一般用作溶剂。丙醇的两种异构体对眼睛、粘膜都有刺激性,吸入丙醇蒸气能发生头晕、头痛、呕吐等。
-
物化实验报告_双液系的气液平衡相图
实验5双液系的气液平衡相图丛乐20xx011007生51实验日期20xx年11月10日星期六提交报告日期20xx年11月24日星期…
-
实验五 双液系的气—液平衡相图
深圳大学实验报告课程名称实验项目名称实验五双液系的气液平衡相图学院化学与化工学院报告人班级实验时间实验报告提交时间教务部制目的要求…
-
双液系气—液平衡相图绘制实验报告
双液系气液平衡相图绘制实验目的用回流冷凝法测定沸点时气相与液相的组成绘制双液系相图找出恒沸点混合物的组成及恒沸点的温度掌握测定双组…
-
双液系气液平衡相图的绘制
实验四双液系气液平衡相图的绘制姓名谭成彬班级生物工程学院生物工程07级四班学号07041010428一实验目的1测定常压下环己烷乙…
-
双液系的气-液平衡相图的绘制实验报告
实验四双液系的气液平衡相图的绘制一目的要求1用沸点仪测定大气压下乙醇环己烷或异丙醇环己烷双液系气液平衡时气相与液相组成及平衡温度绘…
-
生产线平衡实验报告
安徽工业大学生产线平衡实验报专业物流专业班级物流101姓名詹庆雯学号109094162日期20xx1223一概述1实验目的及要求告…
-
物化实验报告_双液系的气液平衡相图
实验5双液系的气液平衡相图丛乐20xx011007生51实验日期20xx年11月10日星期六提交报告日期20xx年11月24日星期…
-
物化实验报告-双液系气液平衡相图的绘制
华南师范大学双液系气液平衡相图的绘制实验报告学生姓名戚颖筠同组人黄萍妹李轩娣学号20xx2401162专业化学教育年级班级10化教…
-
研究生液相色谱实验报告
高效液相实验报告实验目的1.了解高效液相色谱仪的类型和各自的优缺点;2.了解液相色谱仪及各检测器的工作原理3.掌握高效液相色谱仪的…
-
气液平衡 实验报告
化工专业实验报告实验名称二元气液平衡数据的测定实验人员同组人实验地点天大化工技术实验中心实验时间20xx年4月20日下午1400年…
-
液相色谱实验报告
华南师范大学实验报告液相色谱分析混合样品中的苯和甲苯一实验目的1掌握高效液相色谱定性和定量分析的原理及方法2了解高效液相色谱的构造…