医疗器械产品技术报告
医疗产品技术报告
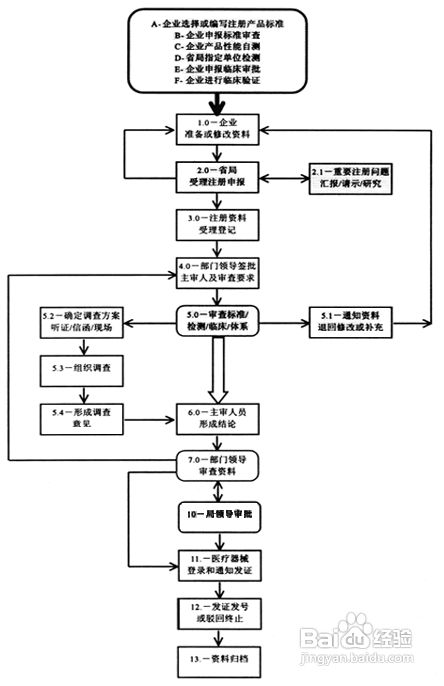
医疗器械产品技术报告审批流程,如图所示:
医疗器械产品技术报告的要求
产品技术报告应能支持产品标准、安全风险分析报告、临床试验资料、医疗器械说明书 的相关内容,与其他相关文件具有一致性。申请注册产品的设计开发、研制过程必须得到有效的控制。
医疗器械产品技术报告的内容 1. 产品特点、工作原理、结构组成、预期用途;
(1)产品特点:包括项目来源、产品作用机理和原理、产品技术特点、性能特点、使用特点;
(2)工作原理:应包括产品整体及各部分的工作原理(附原理图)及说明(包括电 气、机械、软件等);
(3)结构组成:应能反映产品整体及部分的结构组成及外形图样;
(4)预期用途:包括预期的适用范围、预期的不良反应及禁忌症;
(5)同一注册单元内包含几个规格或型号,应在上述四项内容中加以详细说明。
2. 产品技术指标或主要性能要求确定的依据;
(1)产品技术指标或主要性能指标:包括产品使用性能、安全性能有关的主要技术指标或性能指标;
(2)确定的依据:产品使用性能有关的主要技术指标或性能指标;
3. 产品设计控制、开发、研制过程;
(1)产品设计方案
(2)产品设计说明、计算公式及有关计算方法的说明
(3)关键技术问题的解决过程;
——采用的技术路线和方法
——解决的过程及结果
(4)产品安全风险控制
——根据产品的预期使用目的和使用错误可以预见的风险;
——在产品设计和制造中采取的防范措施;
——保护操作者、使用者和产品的安全措施;
——风险控制的结果。
(5)产品设计验证情况
——在产品设计的过程中实施的验证和采用的方法;
——产品验证的结果和设计改进措施;
(6)注册产品标准制订的的情况
——相关技术标准检索及技术指标确定的依据;
——对注册产品标准的验证情况及标准对产品质量的控制情况;
——注册产品评审及复核情况;
4. 产品的主要工艺流程及说明
(1)企业产品生产现有资源条件及质量管理能力情况综述(包括生产场地、 生产设备、检验设备、人员情况等);
(2)产品的工艺流程或流程图(注明委外加工工序);
(3)工艺流程中重要工序的说明。
(4)主要原材料、零配件、元器件供应情况。
5. 检测及临床试验情况
(1)产品检测情况;
(2)产品临床试验或验证情况
6. 与国内外同类产品对比分析
1、该项技术的概述及国内外发展概况
2、市场情况分析
医疗器械产品技术报告的关键点
报告内容应包括(1)产品特点、工作原理、结构组成、预期用途;
(2)产品技术指标或主要性能要求确定的依据;
(3)产品设计控制、开发、研制过程;
(4)产品的主要工艺流程及说明;
(5)产品检测及临床试验情况;
(6)与国内外同类产品对比分析。
第二篇:怎么才能写好医疗器械产品技术报告
怎么才能写好医疗器械产品技术报告?
浏览:3088 | 更新:2012-01-06 11:56 | 标签:器械
医疗器械产品技术报告审批流程,如图所示:
医疗器械产品技术报告的要求
产品技术报告应能支持产品标准、安全风险分析报告、临床试验资料、医疗器械说明书
的相关内容,与其他相关文件具有一致性。申请注册产品的设计开发、研制过程必须得到有效的控制。
医疗器械产品技术报告的内容
1
产品特点、工作原理、结构组成、预期用途;
(1)产品特点:包括项目来源、产品作用机理和原理、产品技术特点、性能特点、使用特点;
(2)工作原理:应包括产品整体及各部分的工作原理(附原理图)及说明(包括电
气、机械、软件等);
(3)结构组成:应能反映产品整体及部分的结构组成及外形图样;
(4)预期用途:包括预期的适用范围、预期的不良反应及禁忌症;
(5)同一注册单元内包含几个规格或型号,应在上述四项内容中加以详细说明。
2
产品技术指标或主要性能要求确定的依据;
(1)产品技术指标或主要性能指标:包括产品使用性能、安全性能有关的主要技术指标或性能指标;
(2)确定的依据:产品使用性能有关的主要技术指标或性能指标;
3 产品设计控制、开发、研制过程;
(1)产品设计方案
(2)产品设计说明、计算公式及有关计算方法的说明
(3)关键技术问题的解决过程;
——采用的技术路线和方法
——解决的过程及结果
(4)产品安全风险控制
——根据产品的预期使用目的和使用错误可以预见的风险;
——在产品设计和制造中采取的防范措施;
——保护操作者、使用者和产品的安全措施;
——风险控制的结果。
(5)产品设计验证情况
——在产品设计的过程中实施的验证和采用的方法;
——产品验证的结果和设计改进措施;
(6)注册产品标准制订的的情况
——相关技术标准检索及技术指标确定的依据;
——对注册产品标准的验证情况及标准对产品质量的控制情况;
——注册产品评审及复核情况;
4
产品的主要工艺流程及说明
(1)企业产品生产现有资源条件及质量管理能力情况综述(包括生产场地、 生产设备、检验设备、人员情况等);
(2)产品的工艺流程或流程图(注明委外加工工序);
(3)工艺流程中重要工序的说明。
(4)主要原材料、零配件、元器件供应情况。
5
检测及临床试验情况 (1)产品检测情况;
(2)产品临床试验或验证情况
6
与国内外同类产品对比分析
1、该项技术的概述及国内外发展概况
2、市场情况分析
END
医疗器械产品技术报告的关键点 报告内容应包括(1)产品特点、工作原理、结构组成、预期用途;
(2)产品技术指标或主要性能要求确定的依据;
(3)产品设计控制、开发、研制过程;
(4)产品的主要工艺流程及说明;
(5)产品检测及临床试验情况;
(6)与国内外同类产品对比分析。
产品技术报告
2011-12-23 14:26:09| 分类: 默认分类|字号 订阅
谈谈如何撰写好〈产品技术报告〉,供申报单位准备申报资料时参考。
作为一个比较完整的〈产品技术报告〉,至少应包括以下几方面的内容:
1、基本概况:应对申报产品的基本情况做一全面概括介绍和分析:包括产品名称及其确定依据、产品分类及分类依据、国内外同类产品的上市和应用情况及与申报产品在工作原理、原材料、预期用途等方面的对比分析等;
2、作用原理及作用方式:说明产品的基本作用原理及预期与人体接触的部位(组织)、接触方式、作用时间(包括多量次产品的积累时间);应提供可接受的最长接触时间的确定依据及相关研究结果;注明是否为可降解材料,若是,则提供降解周期和降解产物的相关研究资料;
3、组成材料:明确说明产品的所有组成材料(包括涂层、染料、粘合剂等),注意使用公认的材料化学名称、化学结构式/分子式、分子量(仅适用于高分子材料)来表示,还应说明材料的商品名/材料代号等。 若产品供货状态是在保存液中,应提供保存液的详细成分及含量信息,以及相关安全性评价资料;
4、性能、结构与组成:详细说明产品的性能、基本结构及组成,最好附有相应的图示;明确产品预期与人体接触的组成部分和材料;明确产品规格型号间的异同点;
5、生产过程:阐述产品生产加工过程,包括各种加工工艺(注明关键工艺)、各种加工助剂的使用情况,对残留单体或小分子残留物的控制情况等;
6、性能要求:详述保证产品安全有效的性能要求、性能指标及检验方法的确定依据,提供涉及到的研究性资料、文献资料和/或标准文本;
7、有效期确定依据:应详细说明产品有效期确定的依据,提供产品有效期的验证报告(包括:涉及产品性能稳定与无菌持续状态的保证期限)及内包装材料信息;若产品未设定有效期要求,应详细论证无有效期要求的理由及依据。 对于使用前灭菌(消毒)的产品及可重复灭菌(消毒)的产品,需提供产品对推荐的灭菌(消毒)方法耐受性的支持性资料,及所推荐的灭菌(消毒)方法确定的依据;
8、其他需要说明的问题:生产者认为应在〈产品技术报告〉中提交的证明产品安全有效所必需的其它材料。
在整理〈产品技术报告〉时,还应注意以下几点:
1、在按照《境内第三类、境外医疗器械注册申报资料受理标准》(国食药监
械[2005]111号)对注册申报资料形式要求撰写注册申报资料基础上,建议在产品技术报告、风险分析报告等技术文件中附加目录并在正文中编写页码;
2、建议两份注册产品标准独立装订;
3、涉及到的证明文件、试验报告、参考文献文本等可作为附件提交。 上述内容仅为一般性要求,实际撰写时应根据具体产品的特点增加或调整相应的内容,总之应以能够使审评者通过此报告充分、全面了解产品的基本情况和技术性能为目的。
-
医疗器械产品技术报告
医疗产品技术报告医疗器械产品技术报告审批流程如图所示医疗器械产品技术报告的要求产品技术报告应能支持产品标准安全风险分析报告临床试验…
-
医疗器械产品技术报告编写要求
产品技术报告一产品技术报告的要求产品技术报告应能支持产品标准安全风险分析报告临床试验资料医疗器械说明书的相关内容与其他相关文件具有…
-
医疗器械产品风险分析报告范例
产品风险分析报告广州市XX医疗器械有限公司20XX年6月一、产品预期用途/预期目的和与安全性有关的特征的判定按照《YY/T0316…
-
医疗器械产品(口罩)产品技术报告-(模板)
一次性使用产品技术报告供参考有限公司20年月日一次性使用产品技术报告一产品基本概况一次性使用以下简称主要用于临床机构手术高粉尘有毒…
-
医疗器械产品风险分析报告范例
无线心电和体温监测仪产品风险分析报告中科康馨电子技术北京有限公司20xx年11月理疗仪产品风险分析报告1一产品预期用途预期目的和与…
-
医疗器械产品风险分析报告范例
产品风险分析报告广州市XX医疗器械有限公司20XX年6月一、产品预期用途/预期目的和与安全性有关的特征的判定按照《YY/T0316…
-
医疗器械产品风险分析报告范例
无线心电和体温监测仪产品风险分析报告中科康馨电子技术北京有限公司20xx年11月理疗仪产品风险分析报告1一产品预期用途预期目的和与…
-
国内外医疗器械产业调研报告
目录医疗医器产业调研报告21国内外医疗器械产业发展现状311国外医疗器械产业发展情况312国内医疗器械产业发展简况42医疗器械产业…
-
医疗器械产品--安全风险分析报告
血清碱性磷酸酶测定试剂盒ALP安全风险分析报告1总则血清碱性磷酸酶测定试剂盒以下简称ALP测试盒是一种临床检验体外诊断化学试剂中酶…
-
医疗器械注册产品分析报告
XXXXXX产品质量跟踪报告一试产期间产品的生产销售情况1试产期间XXXXX产品生产的批次为X数量为XXX2试产期间XXXXX产品…
-
关于公司医疗器械经营质量状况的年度报告
一、公司概况有限公司是由自然人出资组建的药品及医疗器械批发企业,注册资金万元。公司于年月日取得《药品经营许可证》,年月日取得《医疗…