第六周化学实验报告电位法测定电池电动势及浓度对电极电位的影响
华南农业大学实验报告
专业班次 11农学班一 组别 201130010110
题目 电位法测定电池电动势及浓度对电极电位的影响 姓名 梁志雄 日期
一、目的要求
1、 加深对原电池、电极电位的理解
2、 了解使用酸度计测定电池电动势和电极电位的方法,加深了解浓度的改变对电极电位的影响。
二、实验原理
原电池由两个电极组成,在用盐桥消除液体的结界电位的情况下,电池电动势等于正负两电极电位之差,即E=φ+-φ-电池电动势可以用实验测量。本实验采用酸度计测量电池的电动势,然后改变正极或负极的溶液浓度,是正极或负极的溶液浓度减少,以达到改变电池电动势的目的。
电池电动势的确定能斯特方程Cu2+ +Zn=Cu+Zn2+ E=Eθ-(0.059/2)㏒10 [C (Zn2+)/C(Cu2+)]
三、实验步骤
1、 制备电极
2、 组成原电池并测定电动势 将锌电极溶液和铜电极溶液用盐桥连同起来。然后用导线将铜电极连接到酸度计正极,将锌电极连接到酸度计负极上,组成原电池。
3、 浓度对电极电位影响的测定 在以上原电池的负极硫酸锌溶液中,加入浓氨水,先有白色沉淀生成,继续加入浓的氨水知道溶液无色,此时可观察到电池电动势增大,并记下读数。在正极的硫酸铜溶液中,加入饱和的硫化钠溶液知道有大量黑色沉淀生成,此时可观察到电池电动势减少,并记下读数。
4、 酸度计的使用
l 电源
l 温度“△▽”
l 定位:CAL
l 开始测量
l 电极插入待测液中记下PH读数
l 电极 插入PH=4.0的缓冲溶液中,调节PH=4.0“△▽”
l 按下ENTER
l 电极插入 PH =6.88的缓冲 溶液中,调节PH=6.88
l 按下ENTER
三、数据记录
表一
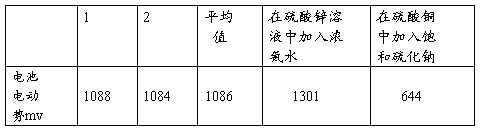
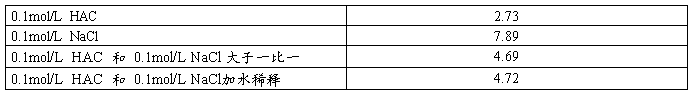
表二测量PH
五、实验数据的分析
1、由表一可以知道,铜锌电池的电动势值为1084mV,当在原电池的 负极加入浓氨水,直到产生的 白色沉淀完全消失,此时可以观察到电池的电动势是增大了的,因为发生了反应ZnSO4 + 4NH3 = [Zn(NH3)4]SO4实质上分两步进行,更准确写,因为可以反映溶液的碱性增强:
1) Zn(2+) + 2NH3.H2O = Zn(OH)2 + 2NH4(+)
2) Zn(OH)2 + NH3 = [Zn(NH3)4](2+) + 2OH(-),
反应增加了溶液中离子浓度,使得溶液电动势增大; 而在正极的硫酸铜溶液中家如硫化钠直至有大量黑色沉淀生成,可知电池电动势减少 ,因为Na2S + CuSO4 == Na2SO4 + CuS↓,反应使得溶液离子浓度降低,故电动势减少
2、由表二的数据可以知道0.1mol/L HAC是弱酸 ,该浓度下的PH大于 1 而0.1mol/L NaCl的PH就应该是7;
而醋酸与氯化钠混合,发生同离子 效应,PH小于7;而醋酸与氯化钠等体积等浓度混合,配成了缓冲溶液,故第四组数据与第三组数据很接近
六、讨论
酸度表可以测出电源内部酸浓度,其实化学电池就是电源内化学反应决定的,反应的速率决定了电动势的大小
第二篇:化学实验报告《排水集气法》
化学实验报告《排水集气法》
实验名称:排水集气法
实验原理:氧气的不易容于水
仪器药品:高锰酸钾,二氧化锰,导气管,试管,集气瓶,酒精灯,水槽 实验步骤:①检----检查装置气密性。
②装----装入药品,用带导管的橡皮塞塞紧
③夹----用铁夹把试管固定在铁架台上,并使管口略向下倾斜,药品平铺在试管底部。
④点----点酒精灯,给试管加热,排出管内空气。
⑤收----用排水法收集氧气。
⑥取----将导管从水槽内取出。
⑦灭----熄灭酒精灯。
物理实验报告 ·化学实验报告 ·生物实验报告 ·实验报告格式 ·实验报告模板
实验名称:排空气法
实验原理:氧气密度比空气大
仪器药品:高锰酸钾,二氧化锰,导气管,集气瓶,试管
实验步骤:把集气瓶口向上放置,然后把通气体的导管放入瓶中,此时还要在瓶口盖上毛玻璃片,当收集满的时候把导管拿去,然后盖好毛玻璃片即可
-
物理化学实验-电池电动势的测定实验报告
原电池电动势的测定与应用华南师范大学化学与环境学院合作指导老师林晓明一实验目的掌握电位差计的测量原理和原电池电动势的测定方法加深对…
-
大学物理化学实验报告-原电池电动势的测定
物理化学实验报告院系化学化工学院班级学号姓名实验名称原电池电动势的测定日期同组者姓名史黄亮室温1684气压1017kPa成绩一目的…
-
原电池电动势的测定实验报告 浙江大学
实验报告课程名称:大学化学实验p实验类型:中级化学实验实验项目名称:原电池电动势的测定同组学生姓名:无指导老师##一、实验目的和要…
-
实验十 原电池电动势的测定
深圳大学实验报告课程名称报告人班级实验时间实验报告提交时间教务部制目的要求1测定CuZn电池的电动势和CuZn电极的电极电位2了解…
-
原电池电动势的测定实验报告
实验九原电池电动势的测定及应用一实验目的1测定CuZn电池的电动势和CuZn电极的电极电势2学会几种电极的制备和处理方法3掌握数字…
-
实验五 氧化还原反应与电极电势
实验五氧化还原反应与电极电势一实验目的1掌握电极电势对氧化还原反应的影响2定性观察浓度酸度对电极电势的影响3定性观察浓度酸度温度催…
-
大学实验化学 氧化还原反应与电极电位
难题解析TOP例81写出并配平下列各电池的电极反应电池反应注明电极的种类1AgsAgClsHClslnCl2100kpPts2Pb…
-
氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要1基本要求TOP11掌握离子电子法配平氧化还原反应式计算元素氧化值…
-
第八章 氧化还原反应与电极电位(大纲)
第八章111基本要求TOP氧化还原反应与电极电位掌握离子电子法配平氧化还原反应式电池组成式的书写根据标准电极电位判断氧化还原反应方…
-
教学指导--氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要111基本要求TOP掌握离子电子法配平氧化还原反应式电池组成式的书…
-
化学选修4原电池实验报告
实验一探究铁的腐蚀实验目的探究铁在中性环境中的腐蚀实验原理铁生锈时消耗了氧气使具支试管中压强减小因此导管中的水柱高度有变化实验仪器…