化学实验报告——乙酸乙酯的合成
乙酸乙酯的合成
一、 实验目的和要求
1、 通过乙酸乙酯的制备,加深对酯化反应的理解;
2、 了解提高可逆反应转化率的实验方法;
3、 熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。
二、 实验内容和原理
本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯:

副反应:

由于酯化反应为可逆反应,达到平衡时只有2/3的物料转变为酯。为了提高酯的产率,通常都让某一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。因为乙醇便宜、易得,本实验中乙醇过量。但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。
由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。这些共沸物的沸点都很低,不超过72 ℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。
表一、乙酸乙酯共沸物的组成与沸点

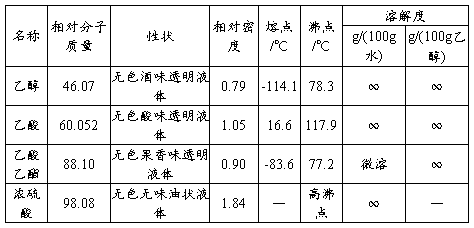
三、 主要物料及产物的物理常数
表二、主要物料及产物的物理常数
四、 主要仪器设备
仪器 100mL三口烧瓶;滴液漏斗;蒸馏弯头;温度计;直形冷凝管;250mL分液漏斗;50mL锥形瓶3个;25mL梨形烧瓶;蒸馏头;阿贝(Abbe)折光仪;气相色谱仪。
试剂 冰醋酸;无水乙醇;浓硫酸;Na2CO3饱和溶液;CaCl2饱和溶液;NaCl饱和溶液。
五、 实验步骤及现象
表三、实验步骤及现象
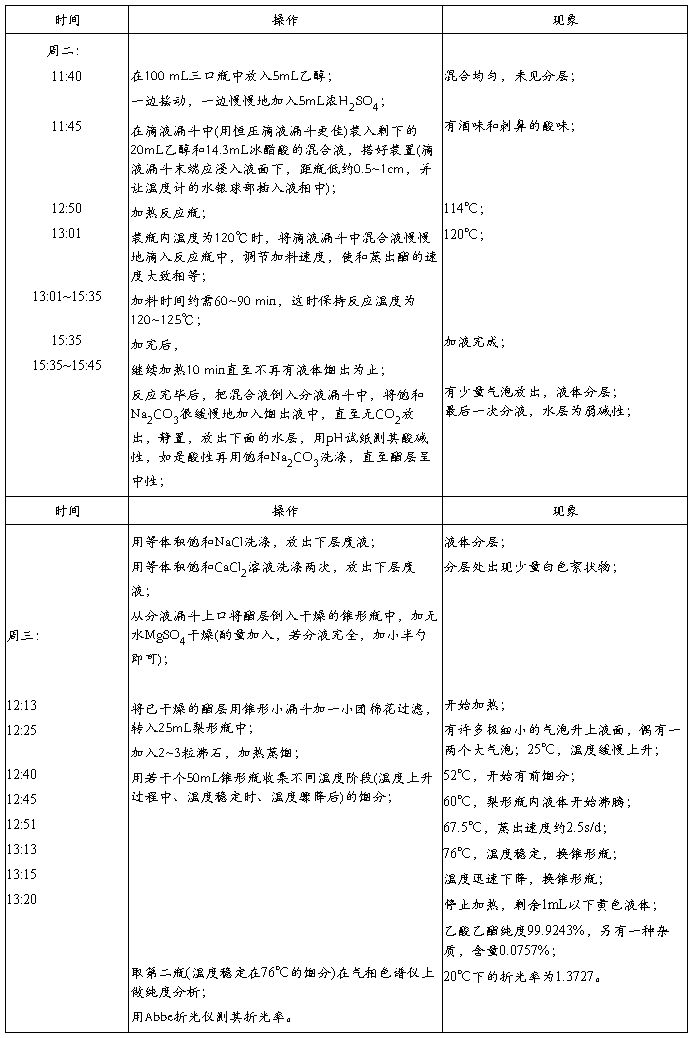
实验装置图:
六、 实验结果与分析
由粗产品洗涤、蒸馏后得三瓶分馏产物,均为无色果香味液体,其质量如下:
1. 前馏分(温度稳定以前):43.38g-35.15g(1号锥形瓶质量)=8.13g;
2. 中馏分(温度稳定在76℃时):39.72g-32.67g(2号锥形瓶质量)=7.05g;
3. 后馏分(温度迅速下降后):34.28g-31.25g(3号锥形瓶质量)=3.08g。
取中馏分在气相色谱仪上测定纯度,测得乙酸乙酯含量为99.9243%。另有一种杂质,含量为0.0757%,预计为未洗净的乙醇,因为过量Na2CO3未洗净,部分CaCl2与之反应生成了CaCO3,剩余的CaCl2不能把乙醇全部除尽。因此纯度虽然较高,但仍有可以改进之处。
在阿贝折光仪上测得室温(20℃)下折光率为1.3727。
七、 思考题
1、 利用可逆反应进行合成时,选择何种原料过量时,需要考虑哪几种因素?
答:通常过量的原料必须具有以下优点:相对成本较低、易得、对环境和人体的影响更小、引入的副反应更少、反应完成后更容易从体系中去除或回收。
2、 粗乙酸乙酯中含有哪些杂质?
答:未反应完全的乙醇、乙酸,酯化反应同时生成的水,溶入的极少的硫酸等。若酯化反应温度控制不当,高于140℃,乙醇分子间脱水,会有乙醚生成;高于170℃,乙醇分子内脱水,会生成乙烯。
3、 能否用浓NaOH溶液代替饱和Na2CO3溶液洗涤?
答:不能。酯化反应是可逆反应,生成的乙酸乙酯在强碱作用下很容易水解成乙醇和乙酸,影响产率。且加入饱和Na2CO3溶液有CO2放出,可以指示中和是否完成,不易加碱过量。另外Na2CO3能跟挥发出的乙酸反应,生成没有气味的乙酸钠,便于闻到乙酸乙酯的香味。
4、 用饱和CaCl2溶液洗涤能除去什么?为什么要用饱和NaCl溶液洗涤?是否能用水代替?
答:用饱和CaCl2溶液洗涤是为了除去乙酸乙酯中溶入的少量乙醇。
用饱和NaCl溶液洗涤是为了除去过量的Na2CO3,否则在下一步用饱和CaCl2溶液洗涤时会产生絮状的CaCO3沉淀。
不能用水代替。因为乙酸乙酯在水中有一定的溶解度,加入NaCl可以减小乙酸乙酯的溶解度,也就减少了这一步洗涤带来的产物损失。另外也增加了水层的密度,分液时更容易分层,避免出现乳化现象。
八、 讨论、心得
1、 实验操作注意点
(1) 反应温度必须控制好,太高或太低都将影响到最后的结果。太高,会增加副产物乙醚的生成量,甚至生成亚硫酸;太低,反应速率和产率都会降低。
(2) 反应过程中,滴加速度也要严格控制。速度太快,反应温度会迅速下降,同时会使乙醇和乙酸来不及发生反应就被蒸出,影响产率。
(3) 乙酸乙酯可与水或醇形成二元或三元共沸物,共沸物的形成将影响到馏分的沸程。共沸物的组成及沸点见表一。
(4) 滴液漏斗、分液漏斗等带活塞的仪器在使用前都要先检漏。
(5) 浓硫酸在本反应中起到催化、吸水的作用,故用量比较多。
(6) 因为本实验中水的存在对反应平衡有影响,所以所有仪器都必须干燥,且选取基本不含水的冰醋酸和无水乙醇反应。
2、 关于乙酸乙酯
乙酸乙酯在工业上的用途很广,主要用作溶剂及染料和一些医药中间体的合成。
虽然乙酸乙酯属于低级酯,有果香味,少量吸入对人体无害。但它易挥发,其蒸气对眼、鼻、咽喉有刺激作用,高浓度吸入有麻醉作用,会引起急性肺水肿,并损害肝、肾。持续大量吸入,可致呼吸麻痹。误服者可产生恶心、呕吐、腹痛、腹泻等。有致敏作用,会引发血管神经障碍而致牙龈出血;还可致湿疹样皮炎。若长期接触,有时可致角膜混浊、继发性贫血、白细胞增多等。为了减少对实验者健康的危害,相关操作都应在通风橱中进行。
乙酸乙酯是易燃物,其蒸气与空气可形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,爆炸上限为11.5%,爆炸下限为2%(体积分数)。与氧化剂接触猛烈反应。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。因此实验合成的乙酸乙酯不能直接倒入水池,必须回收处理。
3、 阿贝折光仪及折光率测定
阿贝折光仪的结构示意图:
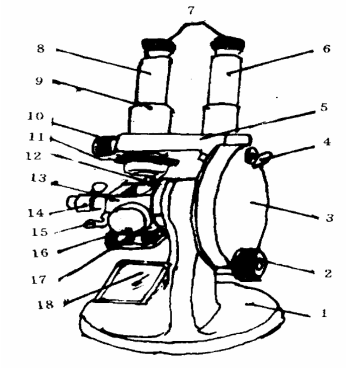 1.底座;
1.底座;
2.棱镜调节旋钮;
3.圆盘组(内有刻度板);
4.小反光镜;
5.支架;
6.读数镜筒;
7.目镜;
8.观察镜筒;
9.分界线调节螺丝;
10.消色凋节旋钮;
11.色散刻度尺;
12.棱镜锁紧扳手;
13.棱镜组;
14.温度计插座;
15.恒温器接头;
16 保护罩;
17 主轴;
18 反光镜
测定时,试样置于测量棱镜P的镜面F上,棱镜的折光率大于试样的折光率。如果入射光I正好沿着棱镜与试样的界面F射入,会发生全反射:其折射光为零,入射角90°,折射角为角1’0N’,即临界角。大于临界角的区域构成暗区,小于临界角的构成亮区。
化合物的折光率除与本身的结构和光线的波长有关外,还受温度等因素的影响。所以在报告折光率时必须注明所用光线(放在n的右下角)与测定时的温度(放在折光率n的右上角)。例如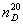 =1.4699表示20℃时,某介质对钠光(D线)的折光率为1.4699。
=1.4699表示20℃时,某介质对钠光(D线)的折光率为1.4699。
物质结构是折光率产生差异的根本原因。不同的物质有不同的立体构象。这使得物质对光线得吸收程度以及反射程度产生差异,使得折光率产生根本性的差异。
物质的折光率因光的波长而异,波长较长折射率较小,波长较短折射率较大。?测定时光源通常为白光。当白光经过棱镜和样液发生折射时,因各色光的波长不同,折射程度也不同,折射后分解成为多种色光,这种现象称为色散。光的色散会使视野明暗分界线不清,产生测定误差。阿贝折光仪中所安装的色散
补偿器是为了消除色散。
温度升高折射率减小;温度降低折射率增大.一般测量温度每增加(减少)1 ℃,液体有机化合物的折光率就减少(增加)3.5×10-4~ 5.5×10-4(为方便起见,一般以4×10-4计算)。不同温度下折光率的转换公式:

通常,大气压的变化对折光率的影响并不显著,一般只在要求较精密时才加以考虑。
4、 实验方法改进及其他合成方法
合成乙酸乙酯有多种方法,最传统的就是以浓硫酸为催化剂,用乙醇和乙酸通过酯化反应合成。此法中所用的浓硫酸对设备腐蚀严重,易炭化,副反应多,产生的二氧化硫对环境有污染。虽然在实验室还是最常用的方法,但在工业上应用的缺点已经越来越明显。
其他研究比较多的是离子液体催化下的酯化反应和固体酸(包括离子交换树脂)催化下的酯化反应。
离子液体作为一种环境友好的溶剂和催化剂体系,具有零蒸汽压、宽液程、良好的溶解性、可设计性和可循环使用等优越的特性。尤其将离子液体应用在酯化反应体系已经取得了相当可观的研究成果。但是一般的离子液体对水和空气不稳定,酯化反应后难以分离,限制了其在化学反应中的广泛应用。
一般固体酸催化剂多存在着催化剂催化活性下降快,催化效率较低,产物分离困难,后处理较复杂等问题。有一种新型固体酸,是用价廉、易得的3种无机酸:浓硫酸、磷酸和硼酸,以一种简单的方法在室温下混和、搅拌与老化,在250~400℃煅烧制得。这种新型固体酸对乙酸与乙醇的酯化反应具有很好的催化性能,但制备温度很高。离子交换树脂(大孔聚苯乙烯型)相对于均相催化剂,具有体积受溶剂作用影响小,适于填充柱操作,副反应少,催化剂重复使用率高,易于实现连续化生产等优点,而且与常规的硫酸比较.离子交换树脂除了不需中和、洗涤等后续处理程序外,还易于保存和运输。但离子交换树脂成本比较高。
第二篇:乙酸乙酯合成及应用
设计性试验――乙酸乙酯合成及检测
1、目的要求:
(1) 掌握合成乙酸乙酯的基本原理和方法
(2) 复习脂化反应的反应机理和影响因素
(3) 运用有机合成方法和所学过的提纯手段,合成并提纯乙酸乙酯
(4) 掌握几种检测乙酸乙酯的方法
(5) 通过本试验,了解一些科学前沿的知识领域,拓宽知识面,进一步培养学
生的独立工作能力
2、设计提示
乙酸乙酯是应用最广的脂肪酸酯之一,是一种快干性溶剂,具有优异的溶解能力,是极好的工业溶剂。乙酸乙酯可用于硝酸纤维、乙基纤维、氯化橡胶和乙烯树脂、乙酸纤维素酯、纤维素乙酸丁酯和合成橡胶,也可用于复印机用液体硝基纤维墨水。乙酸乙酯可作黏结剂的溶剂、喷漆的稀释剂;在纺织工业中可用作清洗剂,乙酸乙酯在食品工业中可作为特殊改性酒精的香味添加剂,可作调香剂的组分。乙酸乙酯也是制造染料、药物和香料的原料。
在已具备无机与有机、物化与分析、合成与表征、分离与鉴定等基础知识的基础上查阅有机化学、有机化学试验、仪器分析、精细化工等书籍及手册等有关文献,拟定乙酸乙酯的合成、提纯及测定方案。
建议本试验由冰醋酸、95%乙醇、浓硫酸或冰醋酸、无水乙醇、三氯化铁等较常用的化学试剂进行合成,经几步提纯后,可选用气相色谱法、紫外吸收光谱法、红外光谱法或测试其折光率等进行检测。
3、设计要求
(1)设计的合成、提纯方法应简便易行。
(2)根据实验室现有的条件设计合成和检验方案。
(3)设计的试验方案应包括:目的要求、试验原理、实验方案的筛选、实验用品、操作步骤、数据处理、注意事项等。
(4)试验方案设计好后应经老师审阅点评后方可试验。
4、实验室现有条件
试剂:冰醋酸、95%乙醇、浓硫酸、无水乙醇、三氯化铁、碳酸钠、氯化钙、氯化钠、无水硫酸镁
仪器:三口烧瓶、圆底烧瓶、直形冷凝管、球形冷凝管、温度计、分液漏斗、电热套、水浴锅等。
5、实验成绩考核办法
实验按百分制评分。实验过程40分,安全卫生20分,实验方案设计、记录、结果、报告40分。指导教师根据学生的实验情况给出每个实验中学生的实验成绩,再经教学组集体讨论给出最终成绩
6、参考资料(也可查阅其他相关资料)
﹝1﹞蒋登高.精细有机合成反应及工艺﹝M﹞.北京:化学工业出版社,2002 ﹝2﹞伍焜贤.有机化学实验﹝M﹞.北京:中国医药科技出版社,2002.79-80
﹝3﹞王利民.精细有机合成新方法﹝M﹞.北京:化学工业出版社,2004.252-266 ﹝4﹞蔡干,曾汉维,忠振声等编 有机精细化学品实验 北京:化学工业出版社,2002
﹝5﹞张桂秋编 实用化工产品配方大全 南京:江苏科学技术出版社,1994 ﹝6﹞北京大学化学系有机化学教研室编 有机化学实验 北京:北京大学出版社,1994
﹝7﹞毛立新.无机盐催化合成丙酸丁酯绿色化学新工艺﹝J﹞.湖南理工学院学报(自然科学版),2004,17(2):54-56
7、思考题
(1)酯化反应有什么特点?
(2)乙酸乙酯的合成实验中,如何使酯化反应向生成酯的方向进行?
(3)乙酸乙酯的合成实验中,从滴液漏斗中滴入其余混合液时为什么要控制在与蒸出的速率相同?
(4)如果所测乙酸乙酯产品的折光率比文献值偏低,你预计产品中可能含有哪些少量杂质?
(5)乙酸乙酯的合成实验中,工业生产中使原料冰醋酸过量有什么好处?
(6)干燥好的乙酸乙酯在转入蒸馏瓶时,不要倾入干燥剂,为什么?
(7)如何确定干燥剂的用量?
(8)乙酸乙酯的合成实验中,如何确定合成已进行完毕?
(9)如何判断在乙酸乙酯粗品中酸已除去?
(10)乙酸乙酯的合成实验中,用饱和氯化钠洗去残留的碳酸钠溶液,用水可以吗?
(11)乙酸乙酯的合成实验中,往蒸馏瓶中添加液体时,应如何操作?
(12)能否用浓氢氧化钠代替饱和碳酸钠来洗涤乙酸乙酯粗品中的酸?
(13)乙酸乙酯的合成实验中,加热时为什么易发生炭化现象?
注:一周后交实验方案点评后进行试验
联系方式:1、电话133xxxxxxxx 2、化学楼513
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践提交形式在线提交实验报告学生姓名…
-
乙酸乙酯的制备实验报告
青岛大学实验报告年月日姓名系年级组别同组者科目有机化学题目乙酸乙酯的制备仪器编号一.实验目的1.掌握酯化反应原理以及由乙酸和乙醇制…
-
化学实验报告——乙酸乙酯的合成
乙酸乙酯的合成一实验目的和要求1通过乙酸乙酯的制备加深对酯化反应的理解2了解提高可逆反应转化率的实验方法3熟练蒸馏回流干燥气相色谱…
- 乙酸乙酯的合成实验报告
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践学生姓名号年级专业层次学习中心提…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践学生姓名刘弓号148xxxxxx…
- 乙酸乙酯的合成实验报告
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践年级专业层次学习中心上海学习中心…
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践提交形式在线提交实验报告学生姓名…
-
实验1 乙酰水杨酸的合成实验报告
实验1乙酰水杨酸的合成实验目的掌握由酸酐作为酰基化试剂和醇反应制备酯的方法巩固普通蒸馏抽滤重结晶等基本操作学习应用显微镜熔点仪测定…