液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定
一、实验目的
1.明确液体饱和蒸汽压的意义,熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯-克拉贝农方程。
2.了解静态法测定液体饱和蒸汽压的原理。
3.学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二、实验原理
1.热力学原理
通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变。当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:
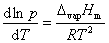 (1)
(1)
式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,积分上式,得:
 (2)
(2)
其中C为积分常数。由此式可以看出,以lnp对1/T作图,应为一直线,直线的斜率为 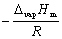 ,由斜率可求算液体的ΔvapHm。
,由斜率可求算液体的ΔvapHm。
2.实验方法
静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此法一般适用于蒸气压比较大的液体。静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置。

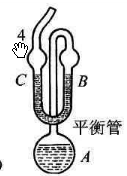



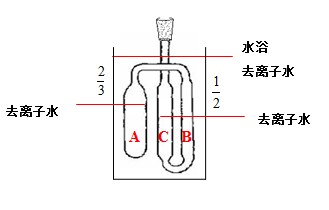
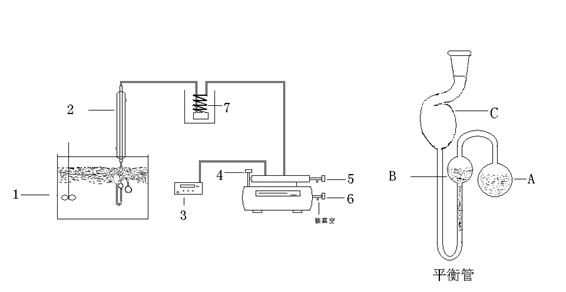 平衡管由
A球和U型管
B、
C组成。平衡管上接一冷凝管,以橡皮管与压力计相连。
A内装待测液体,当
A球的液面上纯粹是待测液体的蒸气,而
B管与
C管的液面处于同一水平时,则表示
B管液面上的(即
A球液面上的蒸气压)与加在
C管液面上的外压相等。此时,体系气液两相平衡的温度称为液体在此外压下的沸点。可见,利用平衡管可以获得并保持系统中为纯试样时的饱和蒸汽,U形管中的液体起液封和平衡指示作用。
平衡管由
A球和U型管
B、
C组成。平衡管上接一冷凝管,以橡皮管与压力计相连。
A内装待测液体,当
A球的液面上纯粹是待测液体的蒸气,而
B管与
C管的液面处于同一水平时,则表示
B管液面上的(即
A球液面上的蒸气压)与加在
C管液面上的外压相等。此时,体系气液两相平衡的温度称为液体在此外压下的沸点。可见,利用平衡管可以获得并保持系统中为纯试样时的饱和蒸汽,U形管中的液体起液封和平衡指示作用。
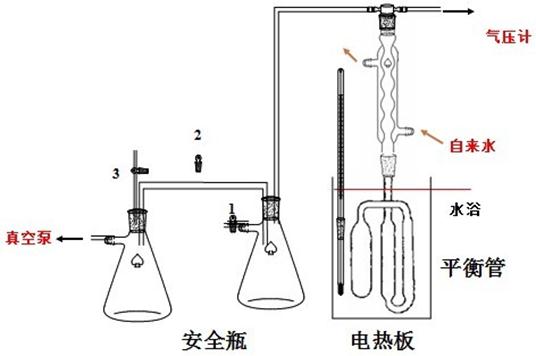
图1 液体饱和蒸气压测定装置图
1.恒温槽;2.冷凝管;3.压力计;4.缓冲瓶平衡阀;5. 平衡阀2(通大气用);6. 平衡阀1(抽真空用);8平衡管
三、仪器与试剂
恒温水浴;平衡管,温度计,冷凝管,数字式低真空测压仪,真空泵及附件,无水乙醇。
四、实验步骤:
1、安装仪器 等待测液体(本实验是无水乙醇)装入平衡管,A球内约占4/5体积,此时U型管内不能有液体。再按照图一装妥个部分。
2、抽真空、系统检漏 将进气阀、阀2打开,阀1关闭。抽气减压至压力计显示压差为-80KPa时关闭进气阀和阀2,如压力计示数能在3-5min内维持不变,则系统不漏气。
3、排除AB弯管空间内的空气和形成液封 打开阀1,恒温槽温度调至比次大气压下待测液沸点高3-5℃,如此沸腾3-5min,停止加热,关闭阀1
4、乙醇饱和蒸汽压的测定 当b、c两管的液面到达同一水平面时,立即记录此时的温度和压力,并打开阀2,使测量系统的压力减小5-7kPa,液体将重新沸腾,又有气泡从平衡管冒出,关闭阀2,继续降低水温。当温度降到一定程度时,B,C液面又处于同一水平面,记录此时的温度计压力计读数。
重复上述操作,每次使系统减压5-7kpa,测至少8组数据。
实验结束后,先将系统排空,然后关闭真空泵。
五、数据处理:
被测液体: 乙醇 室温: 28.60℃ 大气压:97.67kPa
(1) 数据记录
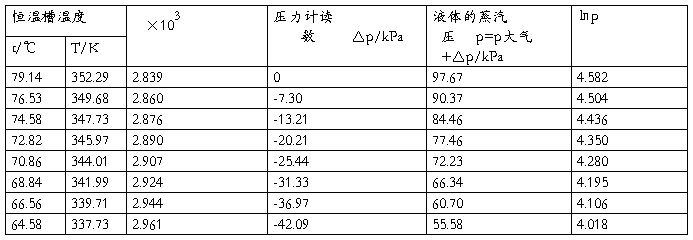
(2)以lnp对1/T作图,求出直线的斜率,并由斜率算出此温度范围内液体的平均摩尔汽化热△vapHm 。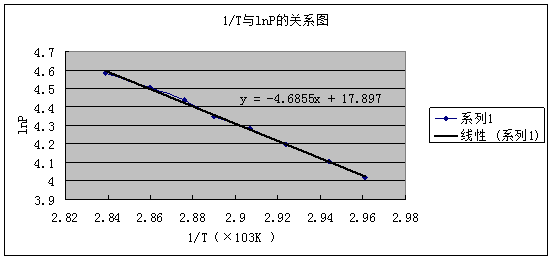
由k = 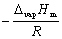 得:ΔvapHm = ﹣k R = 4.6855 × 8.314 = 38.96 KJ
得:ΔvapHm = ﹣k R = 4.6855 × 8.314 = 38.96 KJ
六、注意事项:
(1)预习时应该读懂各个阀门的作用及气路连接。
(2)实验前应检查并保证体系不漏气。
(3)减压速度要适合,必须防止平衡管内液体沸腾过于剧烈,致使管内液体快速蒸发。
(4)实验过程中,必须充分排尽AB弯管空间中的全部空气,使B管液面上方只含液体的蒸汽分子。平衡管内必须放置于恒温水欲中的水面以下,否则其温度与水温不同。
七、思考题:
(1)为什么AB弯管中的空气要干净?怎样操作?怎样防止空气倒灌?
答: AB弯管空间内的压力包括两部分:一是待测液的蒸气压;另一部分是空气的压力。测定时,必须将其中的空气排除后,才能保证B管液面上的压力为液体的蒸气压;将水浴温度升高到85°C沸腾3分钟即可;检漏之后要关闭阀1,防止外界空气进入缓冲气体罐内。
(2)本实验方法能否用于测定溶液的饱和蒸气压?为什么?
答:溶液不是纯净物,其沸点不稳定,实验操作过程中很难判断是否已达到其沸点。
(3)为什么实验完毕以后必须使系统和真空泵与大气相通才能关闭真空泵?
答:如果不与大气相通,球管内的液体可能会被吸入到缓冲储气罐。
(4)如果用升温法测定乙醇的饱和蒸汽压,用该实验装置是否可行?若行,如何操作?
答:升温法可行。先打开阀2,关闭阀1,使储气管内压强达-50kPa
左右,关闭阀2,温度每升高3-5°C,打开阀1,增大压强使球形管内液面相平。
(5)将所测摩尔汽化热与文献值相比较,结果如何?
答:由于当地大气压及实验误差,结果将偏小。
(6)产生误差的原因有哪些?
答:当地大气压、判断液面是否相平的标准、液面相平时数据的采集都会对实验结果造成影响。
第二篇:液体饱和蒸汽压的测定 毛锦平 物化实验报告
学号:201014370128

基础物理化学实验报告
实验名称:液体饱和蒸汽压的测定
应化师范班级 2组号
实验人姓名:毛锦平
同组人姓名:刘奇玲刘慧玲刘兴旺刘洋
指导老师: 李老师
实验日期:20##-9-21
一、实验目的
1、学会用平衡管测定法测定不同温度下液体的饱和蒸气压。
2、了解纯液体的饱和蒸气压与温度的关系并学会由图解法计算水的平均摩尔气化热和正常沸点。
3、掌握用动态法测定液体饱和蒸气压的操作方法。
二、实验原理
在通常温度下,纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的饱和蒸气压与温度的关系可用克劳修斯-克拉贝龙方程式表示:
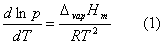 式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
ΔvapHm可以近似作为常数,积分上式,得:
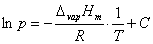 (2)
(2)
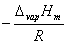 其中C为积分常数。由此式可以看出,以lnp对1/T 作图,应为一直线,直线的斜率为 ,由斜率可求算液体的ΔvapHm
其中C为积分常数。由此式可以看出,以lnp对1/T 作图,应为一直线,直线的斜率为 ,由斜率可求算液体的ΔvapHm
三 、实验装置
ZP-B纯液体饱和蒸汽压测定装置一套,包括数字压力计等 真空泵 蒸馏水
四、实验步骤
1、平衡管中加入纯水
2、抽气检漏
开启压力计电源并预热5—10分钟,开启真空泵电源开关,将橡皮管与系统连接起来,慢慢打开两通活塞,将装置抽空至系统压力比外界气低80kPa左右后,关闭两通活塞,记录压力值,10分钟后再记录压力值,两次数值基本不变,则可进行实验,反之则需检查各接口处密封情况,直到不漏气为止。然后慢慢打开排空活塞放入空气,直至真空度为零。
3、打开冷凝水,同时电加热水浴之沸腾,维持5—10分钟,将空气赶紧后停止加热。
4、关闭排空活塞,开启真空泵,缓缓打开抽泣活塞放入空气,至真空度达到10kPa左右停滞抽泣待平衡管中部液体两端液面平齐时,准确记下温度和压力值。
5、然后又继续打开抽气活塞,重复步骤3,分别测量20、30、40、50、60kPa时相对应的沸点及压力。终止实验。
五、实验数据及数据处理
1、数据记录
大气压:98.94kpa 温度:25.8℃
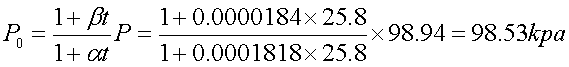
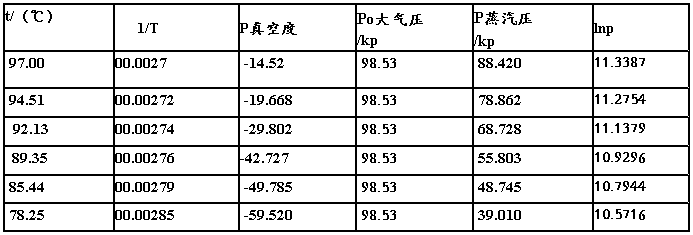
2. 以lnp对1/T 作图,得一直线,并由直线的斜率求出平均摩尔气化热ΔvapHm,并由克劳修斯-克拉贝龙方程求出水的正常沸点。
Linear Regression for Data1_B:
Y = A + B * X
Parameter Value Error
------------------------------------------------------------
A 25.90815 1.37243
B -5398.63014 497.17844
------------------------------------------------------------
直线的方程式;Y =25.90815-5398.63014X
ΔvapHm=-k*R=44.884kJ/mol
当取外压为101.325kpa时,lnp=11.526
则水的沸点为101.95℃
六、注意事项
1、减压系统不能漏气,否则抽气时达不到本实验要求的真空度。
2、必须充分排净平衡管中的全部空气,平衡管必须放置于恒温水浴中的水面以下,否则其温度与水浴温度不同。
3、当平衡管中U型部分的液面平齐时,读数要迅速,读毕应立即打开缓冲瓶与真空泵连接活塞抽气减压,防止空气倒灌。若发生倒灌现象,必须重新排净平衡管内的空气。
七、思考与讨论
1、何谓饱和蒸气压?何谓沸点?它们与温度和压力有何关系?
答:饱和蒸气压:在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。沸点:液体的饱和蒸气压与外界压强相等时的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时;沸点降低。
2、克劳修斯-克拉贝龙方程式的应用条件是什么?
答:纯物质的气-液或气-固两相平衡,摩尔蒸发焓ΔHm不随温度T改变,这种假定只有在温度间隔不太大时才与实际相近。
3、本实验的方法能否用于测定溶液的蒸气压?为什么?
答:分情况,测定过程中若溶液的浓度发生变化,则不能测;但是对于难溶物的饱和溶液或者恒沸物等可以使用本方法测定。
4、为什么实验完毕以后必须使系统和真空泵与大气相通才能关闭真空泵?
答:如果不与大气相通,球管内的液体可能会被吸入到缓冲储气罐。
5、产生误差的原因有哪些?
答:当地大气压、判断液面是否相平的标准、液面相平时数据的采集都会对实验结果造成影响。
6、U型管中封闭液体所起到的作用是什么?
答:有以下三点作用:
(1)起到一个液体活塞(或液封)的作用,用于分隔体系与环境;同时通过该液体活塞,可将体系中的空气排除到环境中去
(2)起到检测压力的作用。(当BC管中的液面等高时,说明体系的压力等于环境的压力,可以通过测量环境的压力来代表体系的压力)
(3)当BC管中的液面等高时既可测定温度和压力的数据,也可保持多次测量数据时体系的体积几乎相等。
-
液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
4纯液体饱和蒸汽压的测定实验报告
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目纯液体饱和蒸气压的测定静态法实验类型验证设计综合实…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
液体饱和蒸汽压的测定 实验报告
宁波工程学院物理化学实验报告专业班级化工姓名序号同组姓名指导老师胡爱珠杨建平实验日期20xx年3月19日实验名称实验一液体饱和蒸汽…
-
饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定实验报告实验题目液体饱和蒸汽压的测定学院化学与化工学院专业生物工程年级112班学号1108110358学生姓名…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
乙醇的蒸馏及沸点测定 实验报告
报告题目:乙醇的蒸馏及沸点测定实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:***学生姓名:**学号:**20…
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
-
实验二实验报告
液体饱和蒸汽压的测定摘要本实验中通过对液体饱和蒸气压与温度的关系的研究根据克拉贝隆克劳修斯方程的简化建立起来的经验方程式求出液体的…
-
液体饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
物化实验报告_液体饱和蒸气压的测定
实验4液体饱和蒸气压的测定丛乐20xx011007生51实验日期20xx年11月24日星期六提交报告日期20xx年12月8日星期六…