物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告
乙酸乙酯皂化反应动力学
1.目的:
(1)了解二级反应的特点。
(2)用电导法测定乙酸乙酯皂化反应的速率常数。
(3)用不同温度下的反应速率常数求反应的活化能。
2.原理:
乙酸乙酯在碱性水溶液中的水解反应即皂化反应,其反应式为:

反应是二级反应,反应速率与乙酸乙酯及氢氧化钠的浓度成正比。用a,b分别表示乙酸乙酯和氢氧化钠的初始浓度,x表示在时间间隔t内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为:

K为反应速率常数,当a=b时,上式为:

开始反应时t=0,反应物浓度为a,积分上式时得:
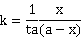
在一定温度下,由实验测得不同t时的x值,再由上式可计算出k值。
改变实验温度,求不同温度下的k值,根据Arrhenius方程的不定积分式有:
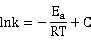
以lnk对1/T作图,得一直线,从直线斜率可求的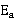 。
。
若对热力学温度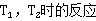 速率常数
速率常数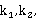 也可由Arrhenius方程的定积分式变化得
也可由Arrhenius方程的定积分式变化得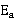 值:
值:
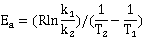
本实验通过测量溶液的电导率k代替测量生成物的浓度x。乙酸乙酯,乙醇是非电解质。在稀溶液中,强电解质电导率与浓度成正比,溶液的电导率是各离子电导率之和。反应前后Na离子浓度不变,整个反应过程电导率的变化取决于O 根离子与
根离子与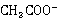 浓度的变化,溶液中的O
浓度的变化,溶液中的O 导电能力约为
导电能力约为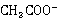 的五倍,随着反应的进行,O
的五倍,随着反应的进行,O 浓度降低,
浓度降低,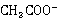
浓度升高,溶液导电能力下降。
一定温度下,在稀溶液中反应, 时的电导率,
时的电导率, 分别是与
分别是与 ,
,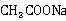 电导率有关的比例常数(与温度,溶剂有关)。于是:
电导率有关的比例常数(与温度,溶剂有关)。于是:
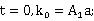

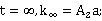
由此可得: (
(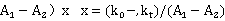
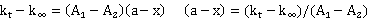
则可以得到: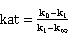
以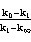 对t作图,由斜率ka可求得k。初始浓度a为实验中配制溶液时确定,通过实验可测得
对t作图,由斜率ka可求得k。初始浓度a为实验中配制溶液时确定,通过实验可测得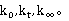
通过公式变形避免测定 ,则式为:
,则式为:

以 由此可求k.
由此可求k.
3.实验仪器
恒温槽 电导率仪
电导电极 叉形电导池
秒表 滴定管
移液管 容量瓶(50ml,100ml)
乙酸乙酯 NaOH溶液
4.实验步骤
(1)调节超级恒温槽至25摄氏度。
(2)配制100ml浓度约为0.02mol/L的乙酸乙酯溶液。
所需乙酸乙酯的量约为0.1762g。首先在洁净的100ml容量瓶中加入少量去离子水,用分析天平称量加入的乙酸乙酯的量。加入的乙酸乙酯的量应该尽量小于0.1762g。事先加入少量水是为了防止乙酸乙酯挥发。在称量之后计算出乙酸乙酯的准确浓度。
(3)配制100ml等浓度的NaOH溶液,浓度以乙酸乙酯实际浓度为准,计算需要加入NaOH溶液的体积。
(4)测定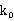 :用移液管取与乙酸乙酯浓度相同的NaOH溶液25ml,加入到洁净的50ml容量瓶中,用去离子水稀释至刻度,用于测量
:用移液管取与乙酸乙酯浓度相同的NaOH溶液25ml,加入到洁净的50ml容量瓶中,用去离子水稀释至刻度,用于测量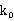 。取一定量的溶液于叉形电导池直支管中,用部分溶液淋洗电极,将电极放入叉形电导池的直支管中,溶液应能将电极没过。将叉形电导池放入恒温槽中10min以后,读取记录电导率值。保留此叉形电导池中的溶液,用于后面35摄氏度时的
。取一定量的溶液于叉形电导池直支管中,用部分溶液淋洗电极,将电极放入叉形电导池的直支管中,溶液应能将电极没过。将叉形电导池放入恒温槽中10min以后,读取记录电导率值。保留此叉形电导池中的溶液,用于后面35摄氏度时的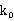 。
。
(5)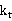 的测量:用移液管取所配制的乙酸乙酯溶液10ml,将加入到洁净干燥的叉形电导池的直支管中,取浓度相同的NaOH溶液10ml,加入到同一叉形电导池的支管中,注意此两种溶液不能互相污染。将此电导电极放入直支管中,再将此电导池放入恒温槽恒温。10min后,将这两种溶液混合均匀,溶液应能将电极完全淹没,同时启动计时器,每三分钟读一次数,持续30min.
的测量:用移液管取所配制的乙酸乙酯溶液10ml,将加入到洁净干燥的叉形电导池的直支管中,取浓度相同的NaOH溶液10ml,加入到同一叉形电导池的支管中,注意此两种溶液不能互相污染。将此电导电极放入直支管中,再将此电导池放入恒温槽恒温。10min后,将这两种溶液混合均匀,溶液应能将电极完全淹没,同时启动计时器,每三分钟读一次数,持续30min.
(6)调节恒温槽至35摄氏度。
(7)同样按照上述步骤测量在35摄氏度时的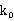 ,
,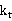 。
。
(8)在实验后将电导电极浸入去离子水中。
5实验数据处理
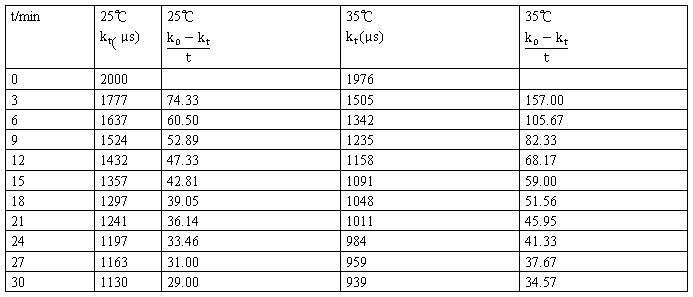
初始浓度a=0.02045mol/L
25℃ 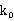 =2000
=2000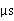
35℃ 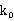 =1976
=1976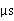
数据图像
25℃ 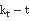 图像
图像

35℃ 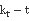 图像
图像

25℃  图像
图像
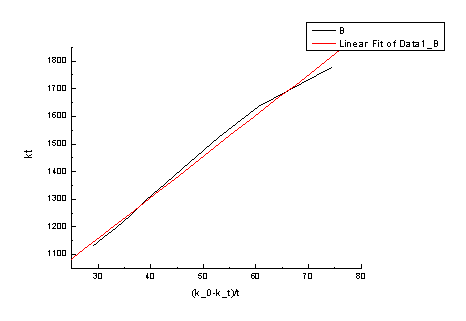
直线斜率为14.85678 k=3.291
35℃  图像
图像

直线斜率:4.77267 k=10.25
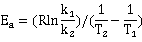
=8.314J/mol*k *ln0.3211/(-0.00010884)
=86.776KJ/mol
6.思考题
(1)在本实验中,使用的电导率仪测定溶液的电导率,可以不进行电极常数的校正,为什么?
由于我们所使用的数据是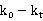 ,即使在测量时存在一定的误差,但是想减之后误差就没有了,所以可以不用校正。
,即使在测量时存在一定的误差,但是想减之后误差就没有了,所以可以不用校正。
(2)为什么溶液浓度要足够小
因为只有在稀溶液中,溶液的电导率才与浓度呈正比,进而可以通过测量电导率求出平衡常数。
(3)利用反应物,产物的某种物理性质间接测量浓度进行动力学研究,应满足那些条件?
浓度与间接测量的物理量之间有简单的对应关系,而且物理量一定得容易测量。
第二篇:物化实验-乙酸乙酯皂化反应速率常数
实验十、乙酸乙酯皂化反应速率常数
【Authorandinstitutionofthereport】
PB11207027zhangheng
SchoolofLifeSciences.UniversityofScienceandTechnologyofChina.HefeiCity.AnhuiProvince.
Postcode:230026
Email:zh322523@mail.
【Abstract】
Accordingtothisexperiment,wemakeuseofthemethodofElectricconductivitymeasuringprogressofthereactantreagentoftheethylacetateesterification.Thenwehaveabetter
issecondorderunderstandingofthedynamicskineticruleofththis
reactionaswellascalculatingtheactivationenergy.energy.
【Keywords】
saponificationreaction
secondorderreaction
Activationenergy
【前言】
。化学反应动力学主要研究化学反应的反应过程与速率化学反应动力学主要研究化学反应的反应过程与速率。通过
,测定反应级数可以得到一系列与反应相关的信息测定反应级数可以得到一系列与反应相关的信息,比如反应速率
常数和活化能。
。乙酸乙酯皂化反应是一个二级反应乙酸乙酯皂化反应是一个二级反应。本实验运用电导法测定electricconductivitymethodreactionratecontant
,不同时刻反应物的浓度不同时刻反应物的浓度,由此得到一定温度下此反应的反应速率,利用不同温度反应速率常数的数据,可计算出乙酸乙酯皂常数常数,利用不同温度反应速率常数的数据,化反应的活化能。【实验部分】实验仪器和试剂一、一、实验仪器和试剂
实验仪器
85-2型恒温磁力搅拌器HK-2A型超级恒温水浴锅0.20ml移液管1000ml广口瓶镊子吸管
实验试剂
邻苯二甲酸氢钾(分析纯)
(分析纯)NaOH乙酸乙酯(分析纯)氢氧化钠氢氧化钠(分析纯)乙酸乙酯(分析纯)CH3COOC2H5实验原理二、二、实验原理
乙酸乙酯皂化反应是典型的二级反应,其反应方程式为:乙酸乙酯皂化反应是典型的二级反应,其反应方程式为:CH3COO-+Na++C2H5OHCH3COOC2H5+Na++OH-——→——→CH设乙酸乙酯的初始浓度为a,氢氧化钠的初始浓度为b,当反应时间为t时,各生成物的浓度均为x,则t时刻的反应速率为:
g/ml相对分子量88.13密度0.9000.900g/ml1支1个1支1个
DDSJ-308型电导仪100ml移液管吸耳球100ml烧杯磁子
3支2支1支大小各一个
dx=k(a-x)(b-x)dt
式中k为反应的速率常数,将上式积分可得:
kt=1b(a-x)lna-ba(b-x)
:若初始浓度a=b,速率方程变为,速率方程变为:
dx=k(a-x)(a-x)dt
积分得: kt=x
a(a-x)
在本实验中,由于反应是在较稀的水溶液中进行的,可以认为CH3COONa全部电离。反应前后溶液中离子数目和离子
,所带电荷不变,但由于CH3COO-的迁移率比OH-的迁移率小的迁移率小,
OH-不断减少,CH3COO-的浓度不断增加,随着反应的进行,随着反应的进行,OH不断减少,CH
故体系的电导率值会不断下降,在一定范围内可认为体系
和CH3COO-的浓度x增加量成正比,即在t的电导率的减少量的电导率的减少量和的浓度增加量成正比,
时刻:
x=K(L0-Lt)
-当t=t∞时,即反应完全时CH3COO的浓度为a,即:
a=K(L0-L∞)
将上述两式代入反应速率的积分方程式,得:
kt=K(L0?Lt)(L0?Lt)=aK[(L0?L∞)?(L0?Lt)]a(Lt?L∞)
可转化为:
L0?Lt=k(Lt?L∞)at
所以只要测定了L0,L∞以及一组Lt值,利用L0?Lt对Lt作图,作图,at
所得直线的斜率就是反应速率和初始浓度a的乘积。
在不同温度下测得的反应速率k后可根据阿累尼乌斯公式:
lnkEak'R?T-T'????T×T'?
求得反应的活化能。
实验步骤三、三、实验步骤
,使其恒温于25±0.2℃,用蒸馏水清洗(1)调节恒温槽调节恒温槽,使其恒温于25±0.2℃
电导仪的电极;
(2)用小烧杯配制少量浓NaOH溶液,用约1000ml的广口
,电磁搅拌并插入电导仪的瓶装入约900ml蒸馏水蒸馏水,打开打开电磁搅拌电磁搅拌并
m测量电极。逐滴加入浓NaOH溶液,至L在1500us/c1500us/cm
左右;
(3)滴定NaOH溶液,室温下将配好的NaOH溶液用碱式滴
,重复三次,取平均值。计算出的NaOH溶液的定管滴定定管滴定,重复三次,取平均值。
浓度。
取100mlNaOH溶液置于恒温夹套反(4)测定L0:用移液管移液管取
,,,。应器中应器中,打开电磁搅拌器打开电磁搅拌器,插入测量电极插入测量电极,恒温10分钟分钟。
等电导仪上的读数稳定之后,每隔1分钟读一次数据,读取三个平行的数据。
:(5)Lt的测定的测定:根据NaOH溶液的浓度计算出与NaOH溶液等
量的纯乙酸乙酯的体积数,打开电磁搅拌器,使用小容
,,积的移液管移取所需用量的乙酸乙酯积的移液管移取所需用量的乙酸乙酯,穿过大口玻璃管穿过大口玻璃管,
将乙酸乙酯全部放入溶液中,注意不要遗留在玻璃套的内壁上。放到一半时打开秒表计时,读数平稳变化后,
,以后每隔1分钟读一次数,15分尽快测量第一组数据尽快测量第一组数据,分钟读一次数,
钟后每隔2分钟读一次数,进行到35分钟后结束。
±0.2℃,重复(4)和(6)调节恒温槽,使其恒温于3030±0.2℃,重复(
(5)。
【结果与讨论】
、实验结果(一)(一)、实验结果
、25℃时反应速率常数k1=5.855(mol?L-1)-1?S-11)1)、25℃
℃时反应速率常数k2=12.73(mol?L-1)-1?S-12)、3030℃
3)、乙酸乙酯皂化反应活化能Ea=116.73kJ/mol
4)、活化能相对误差δ=|116.73-47.3|×100%=146.8%47.3
、误差分析(二)(二)、误差分析
、随机误差1)1)、
由于本实验测量乙酸乙酯皂化反应各时间点的电导率都
,只做了一次,因此偶然因素产生的误差会较大,所以只做了一次,因此偶然因素产生的误差会较大,所以,在
,对比其他数据点后,删除了一个偏差处理数据的过程中处理数据的过程中,对比其他数据点后,
较大的点。
2)、仪器误差
本实验使用到的分析天平,碱式滴定管,以及电导率仪
等都存在一定的仪器误差,并且,对于碱式滴定管还存在估读误差;对于电导率仪,存在初始加入反应物时,混合不均的现象。
3)、其他因素
在加入乙酸乙酯时,如果开始计时的时间点有较大偏
。而且向反应容器中加差,会对实验结果产生一定影响会对实验结果产生一定影响。
,这会造成相当入乙酸乙酯时可能有少量粘在玻璃壁上入乙酸乙酯时可能有少量粘在玻璃壁上,
大的误差。
由于实验配置的NaOH溶液浓度很高,因此,以吸收空气中CO2,从而对实验产生影响。
,本实验中,由于乙酸乙酯的反应速率与温度变化有关乙酸乙酯的反应速率与温度变化有关,本实验中,
,温度并非绝对恒定,有一恒温槽本身控温机制的限制恒温槽本身控温机制的限制,温度并非绝对恒定,
定波动,因而,会对实验测得的数据产生一定影响。查得的活化能数据是常温下的值,虽然活化能在温度范查得的活化能数据是常温下的值,
,可看成恒定值,但实际上对于一般的化学反围较小时围较小时,可看成恒定值,
,因此,实验条件应活化能使随着温度的升高而降低的应活化能使随着温度的升高而降低的,因此,
。下,活化能的理论值会小于47.3kJ/mol47.3kJ/mol。
【参考书目】
《物理化学》
《物理化学实验》傅献彩等编崔献英等编著高等教育出版社中国科学技术大学出版社附:数据处理
NaOH浓度的标定及乙酸乙酯所用体积的计算一、一、NaOH
204.22g/mol邻苯二甲酸氢钾相对分子质量:邻苯二甲酸氢钾相对分子质量:204.22g/mol
88.01g/mol密度:0.90g/mol乙酸乙酯相对分子质量:乙酸乙酯相对分子质量:88.01g/mol密度:0.90g/mol邻苯二甲酸氢钾0.00268/g质量质量/g/mLNaOH体积体积/mL/mol/LNaOH浓度浓度/mol/L/mol/L平均浓度平均浓度/mol/L
反应所用乙酸乙酯理论值:
V=
n?Mr0.005107×0.1×88.01
==0.04994mL≈0.50mLρ0.90
0.001850.00191
25.900.005072
17.650.0051380.005107
18.320.005111
反应速率常数k的计算二、二、反应速率常数1、25℃时:
1306+1306+1305+1305L0:L==1305.5?S/cm
4
由于一开始反应时的线性不好,所以从5min后开始取点
时间/min
Lt(μs/cm)
1192117611xxxxxxxxxxxx5
(L0-Lt)/t时间/min22.7021.5820.3619.8119.6119.05
181920212223
Lt(μs/cm)
1009999987979973965
(L0-Lt)/t16.4716.1315.9315.5515.1114.80
5678910
11121314151617
以
10981083106910xxxxxxxxxxxx0
18.8618.5418.1917.8917.5717.2216.79
24252627282930
957950942934926918910
14.5214.2213.9813.7613.5513.3613.18
L0-Lt
,:对Lt
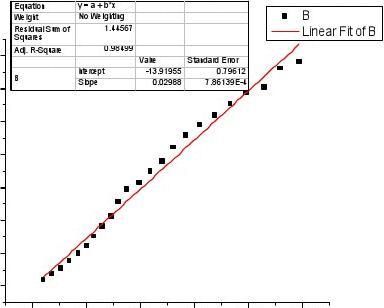
作图:根据图像前两个点误差过大根据图像前两个点误差过大,舍弃后再作图如下舍弃后再作图如下:
t
L0-Ltt
Lt
直线斜率为:K=0.0299S-1∴ak=K,即0.005107k=0.0299k=5.855(mol?L-1)-1?S-12、30℃时
L0:L
=
1328+1329+1331+1332
=1330?S?cm-1
4
由于一开始反应时的线性不好,所以从5min后开始取点
时间/min
Lt(μs/cm)
112xxxxxxxxxxxx10xxxxxxxxxxxx980968954942931
(L0-Lt)/t时间/min40.4037.8335.7133.2531.6730.4029.0928.0026.9225.8625.0724.2523.47
18192021222324252627282930
Lt(μs/cm)
919908900890880871863855847839832825818
(L0-Lt)/t22.8322.2121.5020.9520.4519.9619.4619.0018.5818.1917.7917.4117.07
56xxxxxxxxxxxx151617
以
L0-Lt
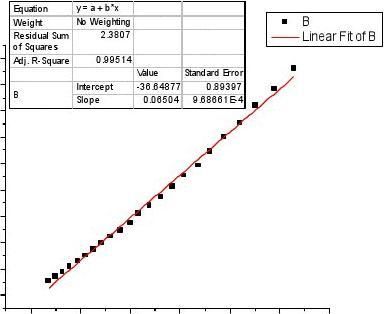
,:根据图像前三个点误差过大根据图像前三个点误差过大,舍弃后再作图如下舍弃后再作图如下:对Lt作图:
t
L0-Lt
tLt
直线的斜率为:K=0.0650S-1
∴ak=K,即0.005107k=0.0650
k=12.73(mol?L-1)-1?S-1
三、反应活化能Ea的计算三、反应活化能
根据阿仑尼乌斯公式lnk1=Ea(T1?T2)k2RT1?T2
ln5.855Ea?11?=??-?12.738.314?30.00+273.1525.00+273.15?
解得Ea=116.73kJ/mol
查得乙酸乙酯水溶液中皂化反应的标准活化能为Ea=47.3kJ?mol-1
相对误差δ=|116.73-47.3|×100%=146.8%47.3
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
,乙酸乙酯皂化反应速率常数的测定
学号20xx14370135基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学师范班班级03组号实验人姓名xxx同…
-
电导法测定乙酸乙酯皂化反应的速率常数
电导法测定乙酸乙酯皂化反应的速率常数指导老师李国良实验目的学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法了…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…