物理化学实验报告 乙酸乙酯皂化反应动力学
乙酸乙酯皂化反应动力学
一、实验目的
1)了解二级反应的特点。
2)用电导法测定乙酸乙酯皂化反应的速率常数。
3)由不同温度下的速率常数求反应的活化能。
二、实验原理
乙酸乙酯在碱性水溶液中的消解反应即皂化反应,其反应式为:
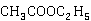 +
+ →
→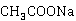 +
+
反应式是二级反应,反应速率与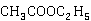 及
及 的浓度成正比。用
的浓度成正比。用 分别表示乙酸乙酯和氢氧化钠的初始浓度,
分别表示乙酸乙酯和氢氧化钠的初始浓度, 表示在时间间隔
表示在时间间隔 内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为:
内反应了的乙酸乙酯或氢氧化钠的浓度。反应速率为: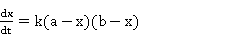
 为反应速率常数,当
为反应速率常数,当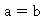 时,上式为:
时,上式为: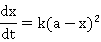
反应开始时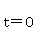 ,反应物的浓度为
,反应物的浓度为 ,积分上式得:
,积分上式得:
在一定温度下,由实验测得不同 时的
时的 值,由上式可计算出
值,由上式可计算出 值。
值。
改变实验温度,求得不同温度下的 值,根据Arrhenius方程的不定积分式有:
值,根据Arrhenius方程的不定积分式有:
以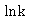 对
对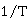 作图,得一条直线,从直线斜率可求得
作图,得一条直线,从直线斜率可求得 。
。
若求得热力学温度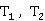 时的反应速率常数
时的反应速率常数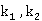 ,也可由Arrhenius方程的定积分式变化为下式求得
,也可由Arrhenius方程的定积分式变化为下式求得 值:
值: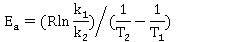
本实验通过测量溶液的电导率 代替测量生成物浓度
代替测量生成物浓度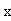 (或反应物浓度)。乙酸乙酯、乙醇是非电解质。在稀溶液中,非电解质电导率与浓度成正比,溶液的电导率是各离子电导之和。反应前后
(或反应物浓度)。乙酸乙酯、乙醇是非电解质。在稀溶液中,非电解质电导率与浓度成正比,溶液的电导率是各离子电导之和。反应前后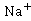 离子浓度不变,整个反应过程电导率的变化取决于
离子浓度不变,整个反应过程电导率的变化取决于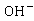 与
与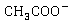 浓度的变化,溶液中
浓度的变化,溶液中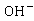 的导电能力约为
的导电能力约为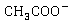 的五倍,随着反应的进行,
的五倍,随着反应的进行,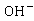 浓度降低,
浓度降低,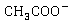 的尝试升高,溶液导电能力明显下降。
的尝试升高,溶液导电能力明显下降。
一定温度下,在稀溶液中反应,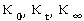 为溶液在
为溶液在 时的电导率,
时的电导率,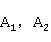 分别是与
分别是与 、
、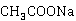 电导率有关的比例常数,于是:
电导率有关的比例常数,于是:
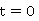 ,
,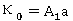 ;
;
 ,
,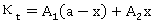 ;
;
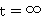 ,
,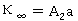 ;
;
由此得
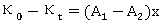 即
即 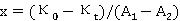
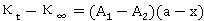 即
即 
而 即
即

上式变形为: 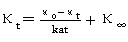
以 对
对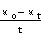 作图为一直线,斜率为
作图为一直线,斜率为 ,由此可求出
,由此可求出 。
。
三、 仪器和试剂
恒温槽、电导率仪、电导电极、叉形电导池、秒表、碱式滴定管、10ml、25m移液管、100mL,50ml容量瓶、乙酸乙酯(A.R.)、氢氧化钠溶液(0.04mol·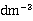 )
)
四、 实验步骤
1.准备溶液:
1) 打开恒温槽,设置温度为25℃。将叉形电导池洗净、烘干。同时清洗两个100ml、一个50ml的容量瓶;
2) 在100ml容量瓶中加入小许水,然后使用分析天平称量加入乙酸乙酯0,1771g,定容待用。
3) 经过计算,定容后的乙酸乙酯的浓度为0.02010mol·L-1,配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为50.25ml,用碱式滴定管量取48.69ml溶液于100ml容量瓶中,定容待用。
4) 用25ml移液管移取25ml NaOH溶液于50ml容量瓶中,定容待用。
2.k0测量:
1)取一部分稀释的NaOH于洁净干燥的叉形管直管中,将用稀释的NaOH润洗后的电导电极放入叉形管直管中,在恒温槽中恒温10min,读取此时电导率。保留叉形管中溶液,用于35℃测量k0。
3.kt的测量:
1)用移液管取乙酸乙酯和同浓度的NaOH各10ml分别加入到叉形管的直管和侧管中,将电导电极插入直管中,恒温10min。
2) 将两种溶液混合,同时开启秒表计时,3min后读取溶液的电导率,以后每3min中读取一次,测量持续30min。
4.测量35℃的电导率:
1)将恒温槽温度设置为35℃。
2)将保存的稀释的NaOH放在恒温槽中恒温10min测量k0。
3)重复上述测量kt的方法测量35℃下的kt。
4)清洗玻璃仪器,电导电极用去离子水清洗,浸入去离子水中保存。
五、实验数据记录与处理
实验中记录实验数据如下:
称取乙酸乙酯的质量是m=0.1771g,
乙酸乙酯的浓度为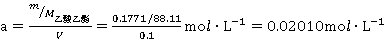
配制同配置同浓度的NaOH所需0.04000 mol·L-1的NaOH体积为:

实验记录电导率数值如下:

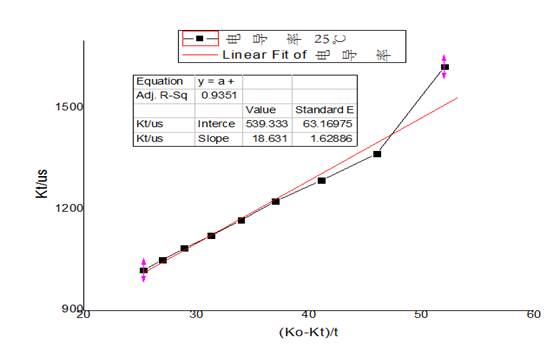
分别做25℃、35℃下以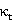 对t作图得到如下图像:
对t作图得到如下图像:

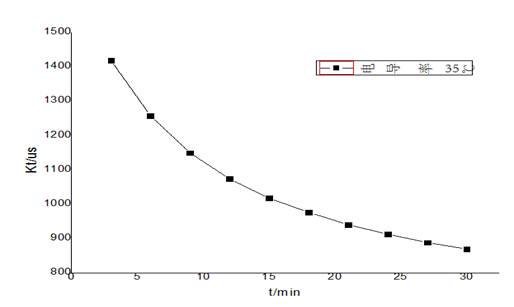
从图像上可以看出来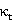 与t呈现反相关,符合
与t呈现反相关,符合 的基本趋势,故接下来做25℃、35℃下以
的基本趋势,故接下来做25℃、35℃下以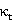 对
对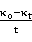 的图像,并进行直线拟合,图像如下:
的图像,并进行直线拟合,图像如下:
25℃ 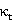 -
- 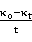 图像
图像
35℃下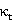 -
- 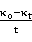 图像
图像
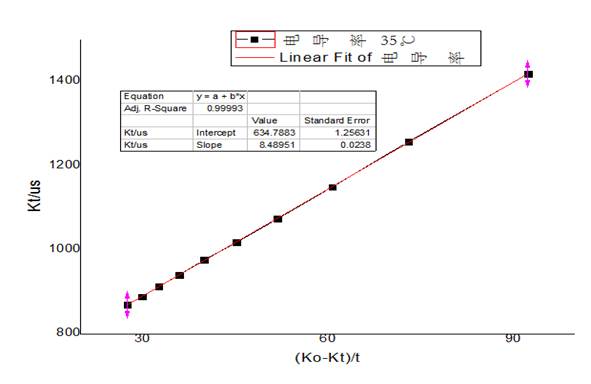
可见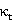 、
、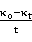 呈现线性关系。并且:
呈现线性关系。并且: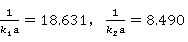 。故可以求得
。故可以求得
由Arrhenius方程的定积分式得:
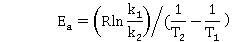
 /mol
/mol
六、数据误差分析
常温下乙酸乙酯皂化反应的活化能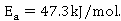 与实际测算得
与实际测算得 相差较大。经分析可能由以下几个因素造成:
相差较大。经分析可能由以下几个因素造成:
1)反应液在恒温时没有用橡胶塞子盖好,虽然溶液很稀,但是还是有部分乙酸乙酯挥发。
2)在恒温的过程中,由于恒温箱在搅拌,可能有水溅入到叉形电导池中。
3)混合过程慢,混合不均匀影响反应速率导致误差;
4)NaOH溶液浓度并不是精确等于0.04000 mol·L-1,配制溶液的浓度并不是完全相等而导致反应速率常数计算公式变化,但仍按原公式计算而产生误差。
5)由于前几分钟溶液刚刚混合,溶液并未混合均匀,所测电导率存在偏差。
七、思考题
1)在本实验中,使用DDSJ-308型电导率议测量溶液的电导率,可以不进行电极常数的校正,为什么?
答:因为本实验中,计算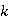 值和
值和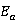 值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
值时所需的数据都是等时间间距下测量的电导率值的拟合直线斜率,它只与等时间间距下电导率的差值有关。不进行常数校正,在等时间间距下测量到的电导率数据都有着相同的系统误差,而不会改变不同时间下电导率数据的差值。所以本实验无需进行电极常数的校正。
3)为什么溶液浓度要足够小?
答:(1)溶液浓度越高,反应越快,则数据的测量不易把握,会影响测量数据的精确度;
(2)乙酸乙酯是易挥发物质,浓度高会加快挥发,使实验测量的数据不准确。(3)浓度大时反应可能变得复杂,不能这样简单讨论。
3)利用反应物、产物的某物理性质间接测量浓度进行动力学研究,应满足什么条件?
答:该物理性质需要满足以下条件:
(1)易于测量,并能用数值表示;
(2)该性质在一定环境条件下是稳定的;
(3)该物理性质和反应物、产物的浓度之间有一个明确的推导公式。
第二篇:乙酸乙酯皂化反应动力学研究
乙酸乙酯皂化反应动力学研究
吴堃 PB08206281
中国科学技术大材料与工程系
230026,金寨路96号,合肥
摘要 化学动力学的研究是物理化学的重要组成部分。直接通过化学分析法测定反应的动力学常数往往是难以进行的,本实验采用测量电导率的方法,求出化学反应的速率常数和活化能,有着精确度较高,实验可行性比较好的特点。
关键词 皂化反应 电导法 阿仑尼乌斯公式
Study of Kinetics of Ethyl Acetates’ Saponification
Wu Kun
Department of material science and technology,University of Science And Technology China
230026,#96,JinzhaiRoad,Hefei
ABSTRACT An important part in Physical Chemistry is Kinetics in reactions. Usually, that’s an impossible job to determination Kinetics Constant by chemical analysis ways. We Measured
The Conductivity to know the K an the E, which is an Simpler and Accurate way.
KEY WORDS Saponification Conductivity Arrhenius
1前言
皂化反应(Saponification)是碱(通常为强碱)催化下的酯被水解,而生产出醇和羧酸盐,尤指油脂的水解。狭义的讲,皂化反应仅限于油脂与氢氧化钠或氢氧化钾混合,得到高级脂肪酸的钠/钾盐和甘油的反应。这个反应是制造肥皂流程中的一步,因此而得名。它的化学反应机制于1823年被法国科学家Eugène Chevreul发现。皂化反应除常见的油脂与氢氧化钠反应外,还有油脂与浓氨水的反应。
其实,进行化学反应动力学实验的关键是准确测得浓度随时间变化的关系。一般有两种方法:
1化学分析法。优点:原理直接,仪器便宜。缺点:分析法有延迟效应,数据准确性降低,对实验样品的破坏与消耗比较显著。
2电导法。优点:速度快,数据准确。缺点:需要专用仪器,且实验准确度受仪器实际情况的限制比较大,且只能测定导电的液体。
关于这两种方法的区别,下表做了阐述
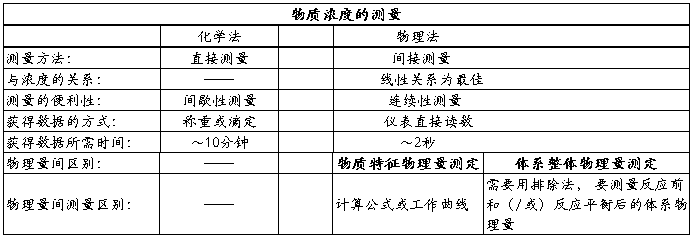
本实验使用了电导法。
乙酸乙酯的皂化反应因为1:1的比例关系和比较容易得到的反应原料与反应条件,所以经常被用来研究。在本实验中,由于反应是在较稀的水溶液中进行的,我们可以假定CH3COONa全部电离,反应前后溶液中离子数目和离子所带电荷不变,但由于CH3COO-的迁移率比OH-的迁移率小,随着反应的进行,OH-不断减少,CH3COO-的浓度不断增加,故体系电导率值会不断下降,在一定范围内,可以认为体系的电导率的减少量和CH3COO-的浓度x增加量成正比。因此,在本实验使用电导法是可行的。
乙酸乙酯皂化反应方程式为:
CH3COOC2H5+Na++OH- ══ CH3COO-+Na++C2H5OH
根据乙酸乙酯皂化反应的原理,可以由公式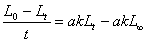 算出k。
算出k。
而根据阿伦尼乌斯公式,可以计算反应的活化能
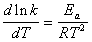
2实验部分
(1)实验仪器

(2)实验方法
1、打开恒温槽使其恒温在30℃。
2、NaOH溶液的配制:
用一个小烧杯配制少量的浓NaOH溶液,在特大的广口瓶装入很多的的蒸溜水(离子交换水),将所选用实验仪器的测量电极插入水中,电磁搅拌条件下,逐滴加入浓浓NaOH溶液到L=1300~1400μS/cm。
3、NaOH溶液的滴定:
将配制好的NaOH溶液用人工手动滴定管和酚酞指示剂在室温下进行浓度测定,重复三次以上,取平均值。
4、L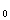 的测定:( 30.00℃)
的测定:( 30.00℃)
取100ml配制且滴定好的NaOH溶液置于恒温夹套反应器中,插入洗净且吸干水的测量电极,恒温10分钟,用计算机软件连接仪器进行数据取样。
5、L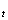 的测定:(30.00℃)
的测定:(30.00℃)
完成L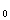 的测定后,使用小容量的移液管移取所需用量的乙酸乙酯,穿过大口玻璃套,将乙酸乙酯全部放入溶液中,不要遗留在玻璃套的内壁上,以免浓度不准。放到一半时打开秒表计时,读数平稳变化后,按下READ按键进行取样,在电导率仪一个测试周期后,(40min)仪器将会自动停止计数。
的测定后,使用小容量的移液管移取所需用量的乙酸乙酯,穿过大口玻璃套,将乙酸乙酯全部放入溶液中,不要遗留在玻璃套的内壁上,以免浓度不准。放到一半时打开秒表计时,读数平稳变化后,按下READ按键进行取样,在电导率仪一个测试周期后,(40min)仪器将会自动停止计数。
6、按步骤3、4和5在35.00℃下进行测量。
(3)实验数据记录
1、计算机取样所得数据已经上传至FTP文件夹。
2、滴定与称重数据
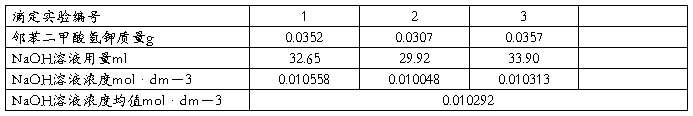
3、算得的加入乙酸乙酯的量为0.05ml。
(4)实验数据处理
有公式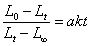 知,要得出k,就要利用
知,要得出k,就要利用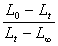 对t作图。
对t作图。
在30℃,L0稳定在1303μS/cm,即可断定L0为 1303μS/cm。
在35℃,L0稳定在1292μS/cm,即可断定L0为 1292μS/cm。
每分钟读数12个,进行了40分钟,因此有480个数据,由于数据比较多,所以单一列出表格进行处理,此表格一并上传。
30摄氏度数据处理.xlsx
35摄氏度数据处理.xlsx
然后,用origin做出比值与时间的曲线。
最后做出的曲线为
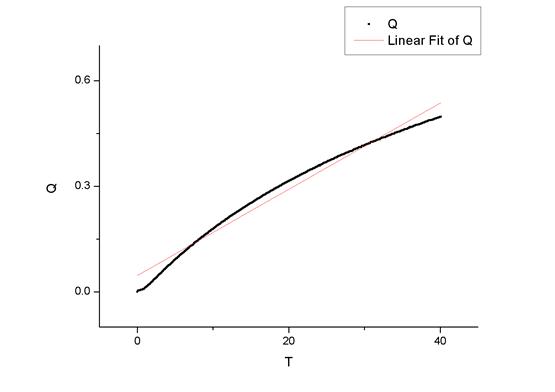
图一:30摄氏度拟合曲线
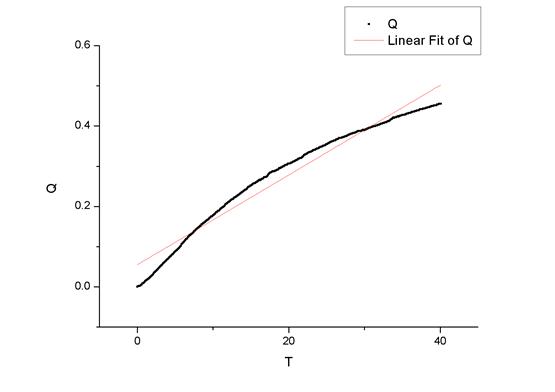
图二:35摄氏度拟合曲线
而origin算出的两条曲线的斜率为

所以反应速率常数K1=0.9496 dm3·mol-1·min-1,K2=1.0845 dm3·mol-1·min-1。
活化能由
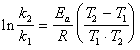
Ln0.911*155180=E
E=-14464J/mol
(5)实验结果讨论
1、根据文献得出本反应的活化能数据为28286J/mol,与实验值差距比较大,造成这个结果的主要原因有:
首先,发现在高温35度时的速率常数反而低于30度时,这是引入误差的主要原因,也是不合理的因素。乙酸乙酯的皂化反应在比较高的温度下应该反应的比较快。然而观察数据,发现高温下的慢节奏是从反应一开始就体现出来的,一直到结束仍保持这个趋势,可见应不是个别实验数据的偶然误差造成的。
其次,虽说K1<K2,但是其实这两个值十分接近,结合公式中Ln的算法,可知此公式对准确度的要求比较高,也就是说一旦比较小的偏差就会造成如此大的误差。
再次,由于10分钟左右以后,反应体系的温度并不能提升到35度,而是在34度左右,也就是说两个体系的温差比计算中的小。
最后,电导率仪需要清洗,但是铂黑又不能擦拭,必然留下许多蒸馏水和其他污染物,进一步影响了实验结果的准确性。
2、从图中可以看出,比值与时间的曲线向下弯的趋势,说明随着时间的推移,反应进行程度提高,反应正向进行的动力逐渐减弱,正向前进的速率逐渐降低。
3、反应的不准确因素十分多。而由于加乙酸乙酯的量太少,而乙酸乙酯又属于易挥发物质,因此实际加入的量比较不准确。
4、另外,发现在没有加入乙酸乙酯的时候,溶液的电导率虽然比较稳定,但仍呈现出下降的趋势,由于氢氧化钠浓度很低,不可能出现电离不彻底,所以这主要是因为氢氧化钠溶液自身在搅拌下产生了一定的损失。
4实验结论
通过本实验,可以看出化学反应动力学特点在本反应中体现的十分明显,即很小的影响因素都会对反应的实际情况产生较大的影响。在测量温差较小的范围内,比较难以准确测出此皂化反应的反应活化能。若将温度提升20度左右相信会有更为满意的结果。
5参考文献
1、【物理化学】下册,第四版 傅献彩,沈文霞,姚天扬编,高等教育出版社,1990
2、【物理化学】(美)V.弗里德等著 高等教育出版社, 1983年7月
3、【展望21世纪的化学】王佛松等主编,化学工业出版社,20##年5月
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
乙酸乙酯皂化反应速率常数的测定的实验报告
实验七乙酸乙酯皂化反应速率常数的测定日期20xx0618来源作者字体大中小乙酸乙酯皂化反应速率常数的测定一目的及要求1测定皂化反应…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
乙酸乙酯皂化反应实验报告
聊城大学化学化工学院聂虎洋洋乙酸乙酯皂化反应速度常相数的测定一实验目的1通过电导法测定乙酸乙酯皂化反应速度常数2求反应的活化能3进…
-
物理化学实验报告 乙酸乙酯皂化反应
物理化学实验报告乙酸乙酯皂化反应动力学1目的1了解二级反应的特点2用电导法测定乙酸乙酯皂化反应的速率常数3用不同温度下的反应速率常…
-
,乙酸乙酯皂化反应速率常数的测定
学号20xx14370135基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学师范班班级03组号实验人姓名xxx同…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…