实验二十一ds区金属
实验二十一ds区金属
一、实验目的
1、掌握铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;
2、掌握Cu (Ⅰ)、 Cu (Ⅱ)重要化合物的性质及相互转化条件;
3、试验铜、银、锌、镉、汞的配位能力以及亚汞离子和汞离子的转化。
二、实验内容
(一)、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质:
1 、 铜、锌、镉氢氧化物的生成和性质

2 银、汞氧化物的生成和性质
(1) Ag2O的生成和性质:
Ag++OH- ===AgOH↓白色→Ag2O+H2O
Ag2O+2HNO3===2AgNO3+H2O
 Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O
Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O
Ag2O微溶于水,溶液呈微碱性。它的△fHm﹩很小,不稳定,加热易分解,具有氧化性。
(2)HgO的生成和性质
Hg2++2OH-==Hg(OH)2==HgO↓+H2O
HgO+2HNO3==Hg(NO3)2+H2O
HgO+NaOH(40℅)-----不溶
HgO 有黄色和红色变体,结构相同,颜色差别完全是由于其颗粒的大小不同所致,黄色HgO晶粒较细小,红色颗粒较大。
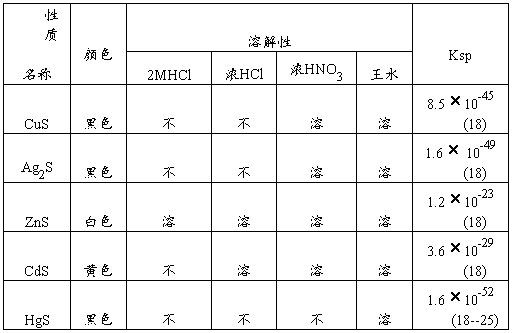
(二)、铜、银、锌、镉、汞硫化物的生成和溶解
说明:
1.生成的CdS中,个别学生得到的沉淀是黄色中夹有白色沉淀,有可能是CdS晶形不一样,或有可能是生成Cd(OH)2白色沉淀。补充:CdS沉淀颜色变化与溶液的酸度及温度有很大关系。在冷氨性、中性或弱酸性溶液中,其沉淀为淡黄;若H+浓度增大,则沉淀将加变为深黄色。
2.在Hg(NO3)2中加入Na2S,开始生成白色沉淀,再加Na2S后变黑。对白色沉淀再加热也不会再变化。个别学生得到白中带有黄色的沉淀。
在中性或酸性汞盐溶液中加入S2-,即首先形成一个白色的复合物(HgCl2·2HgS):
3Hg2++2Cl-+2S2-====HgCl2·2HgS
若再加S2-,则白色沉淀→ 黄色→ 棕色→ 黑色:
2HgCl·2HgS+S2-====3HgS+2Cl-
此沉淀不溶与其它,只溶于王水、Na2S。
将HgS与稀HNO3长时煮沸使之转变为一白色化合物,浓HNO3也有相同作用。HgS在浓HNO3中长时煮沸才溶:
5HgS+8NO3-+8H+=====3Hg(NO3)2·2HgS+3S+2NO+4H2O
(三)、铜、银、锌、汞的配合物
1、氨合物的生成
1)CuSO4+NH3?H2O====Cu2(OH)2SO4(浅蓝色)+(NH4)2SO4
Cu2(OH)2SO4+8NH3====2[Cu(NH3)4]2++SO42-+2OH-
2)2Ag++2NH3.H2O====Ag2O+2NH4++H2O
Ag2O+2NH3.H2O====2Ag(NH3)2++2OH-+H2O
3)Zn2++NH3H2O====Zn(OH)2+2NH4+
Zn(OH)2+4NH3H2O====[Zn(NH3)4]2++2OH-+4H2O
2、汞配合物的生成和性质
(1)、Hg(NO3)2+2I-====HgI2↓(红色)+2NO3-
HgI2+2I-====[HgI4]2-(无色)
奈斯勒试剂-----K2[HgI4]+KOH
NH4++2K2[HgI4]+4KOH====Hg2NI·H2O↓(红棕色)+7KI+K++3H2O
(2)、Hg(NO3)2+2SCN-====Hg(SCN)2↓(白色)+2NO3-
Hg(SCN)2+2SCN-====[Hg(SCN)4]2-(无色)
Zn2++[Hg(SCN)4]2-=====Zn[Hg(SCN)4] ↓(白色,在中性或微酸性溶液中稳定)
(四)、铜、银、汞的氧化还原性
1、Cu2O的生成和性质:
2[Cu(OH)4]2-+CH2OH(CHOH)4CHO=====Cu2O↓+CH2OH(CHOH)4COOH+4OH-+2H2O
Cu2O晶粒大小不同而呈现多种颜色,例如黄色、红色、深棕色,Cu2O为共价化合物,呈弱碱性,对热十分稳定。在实验中大多数学生得到“铜镜”。加稀HCl溶解。
(1)、Cu2O+H2SO4====Cu2SO4+H2O
Cu2SO4====CuSO4+Cu
(2)、Cu2O+4NH3·H2O===2[Cu(NH3)2]+(无色)+2OH-+3H2O
2[Cu(NH3)2]++4NH3·H2O+1/2 O2====2[Cu(NH3)4]2++2OH-+3H2O
2、CuCl的生成和性质
Cu2++Cu+2Cl-====CuCl↓(白色)
CuCl+HCl====H[CuCl2]
当Cu作还原剂时,由于难溶的CuCl附着在Cu的表面,影响了反应的继续进行。因此需加入浓HCl使CuCl溶解生成配离子[CuCl2]-,使溶液中的Cu2+浓度降低到非常小,可使反应进行到完全程度。再者,浓HCl还抑制CuCl的水解。加水后稀释了溶液,[CuCl2]-被破坏而析出大量CuCl。
CuCl+2NH3·H2O====Cu(NH3)2+(无色)+Cl-+2H2O
↓ →蓝色[Cu(NH3)4]2+
CuCl+HCl====H[CuCl2]
3、CuI的生成和性质
2Cu2++4I-====2CuI+I2
I- 即是还原剂又是沉淀剂,因为CuI是沉淀剂,所以在I-存在时Cu2+ 的氧化性大大增强:
Cu2++I-+e=====CuI Φ?==0.86V
I2+2e =====2I- Φ?==0.536V
加Na2S2O3溶液应适量,将I2还原。若Na2S2O3加过量:
2CuI+2S2O32- (过量)====[Cu(S2O3)2]2-+2I-
有的学生加Na2S2O3后,上部溶液显黄绿色,是因为CuSO4加过量。
4、Hg(Ⅰ)与Hg(Ⅱ)的相互转化
(1)、Hg2+的氧化性
Hg(NO3)2+SnCl2(适量)=====Hg2Cl2 ↓(白色)+Sn(NO3)4
Hg2Cl2+SnCl2(过量)====2Hg↓(黑色)+H2SnCl6
在酸性溶液中Hg(Ⅱ)是一个较强的氧化剂。
(2)、Hg2+转化为Hg2+2和Hg2+2的歧化分解
Hg(NO3)2+Hg====Hg2(NO3)2
Hg2(NO3)2+2NaCl====Hg2Cl2↓(白色)+2NaNO3
Hg2(NO3)2+2NH3=====HgNH2NO3↓(白色)+Hg↓(黑色)+NH4NO3
第二篇:实验二十一ds区金属
实验二十一ds区金属
一、实验目的
1、掌握铜、银、锌、镉、汞氧化物或氢氧化物的酸碱性,硫化物的溶解性;
2、掌握Cu (Ⅰ)、 Cu (Ⅱ)重要化合物的性质及相互转化条件;
3、试验铜、银、锌、镉、汞的配位能力以及亚汞离子和汞离子的转化。
二、实验内容
(一)、铜、银、锌、镉、汞氢氧化物或氧化物的生成和性质:
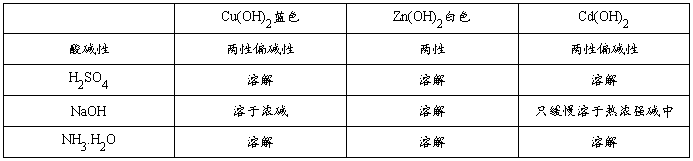
1 、 铜、锌、镉氢氧化物的生成和性质
2 银、汞氧化物的生成和性质
(1) Ag2O的生成和性质:
Ag++OH- ===AgOH↓白色→Ag2O+H2O
Ag2O+2HNO3===2AgNO3+H2O
 Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O
Ag2O+2NH3.H2O==2[Ag(NH3)2]++2OH-+H2O
Ag2O微溶于水,溶液呈微碱性。它的△fHm﹩很小,不稳定,加热易分解,具有氧化性。
(2)HgO的生成和性质
Hg2++2OH-==Hg(OH)2==HgO↓+H2O
HgO+2HNO3==Hg(NO3)2+H2O
HgO+NaOH(40℅)-----不溶
HgO 有黄色和红色变体,结构相同,颜色差别完全是由于其颗粒的大小不同所致,黄色HgO晶粒较细小,红色颗粒较大。
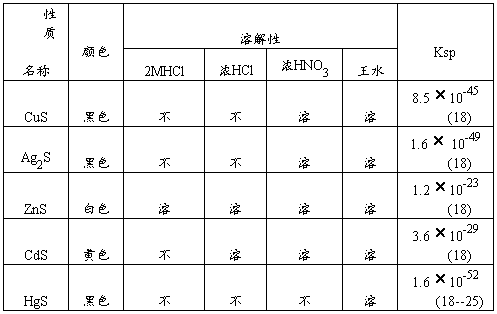
(二)、铜、银、锌、镉、汞硫化物的生成和溶解
说明:
1.生成的CdS中,个别学生得到的沉淀是黄色中夹有白色沉淀,有可能是CdS晶形不一样,或有可能是生成Cd(OH)2白色沉淀。补充:CdS沉淀颜色变化与溶液的酸度及温度有很大关系。在冷氨性、中性或弱酸性溶液中,其沉淀为淡黄;若H+浓度增大,则沉淀将加变为深黄色。
2.在Hg(NO3)2中加入Na2S,开始生成白色沉淀,再加Na2S后变黑。对白色沉淀再加热也不会再变化。个别学生得到白中带有黄色的沉淀。
在中性或酸性汞盐溶液中加入S2-,即首先形成一个白色的复合物(HgCl2·2HgS):
3Hg2++2Cl-+2S2-====HgCl2·2HgS
若再加S2-,则白色沉淀→ 黄色→ 棕色→ 黑色:
2HgCl·2HgS+S2-====3HgS+2Cl-
此沉淀不溶与其它,只溶于王水、Na2S。
将HgS与稀HNO3长时煮沸使之转变为一白色化合物,浓HNO3也有相同作用。HgS在浓HNO3中长时煮沸才溶:
5HgS+8NO3-+8H+=====3Hg(NO3)2·2HgS+3S+2NO+4H2O
(三)、铜、银、锌、汞的配合物
1、氨合物的生成
1)CuSO4+NH3?H2O====Cu2(OH)2SO4(浅蓝色)+(NH4)2SO4
Cu2(OH)2SO4+8NH3====2[Cu(NH3)4]2++SO42-+2OH-
2)2Ag++2NH3.H2O====Ag2O+2NH4++H2O
Ag2O+2NH3.H2O====2Ag(NH3)2++2OH-+H2O
3)Zn2++NH3H2O====Zn(OH)2+2NH4+
Zn(OH)2+4NH3H2O====[Zn(NH3)4]2++2OH-+4H2O
2、汞配合物的生成和性质
(1)、Hg(NO3)2+2I-====HgI2↓(红色)+2NO3-
HgI2+2I-====[HgI4]2-(无色)
奈斯勒试剂-----K2[HgI4]+KOH
NH4++2K2[HgI4]+4KOH====Hg2NI·H2O↓(红棕色)+7KI+K++3H2O
(2)、Hg(NO3)2+2SCN-====Hg(SCN)2↓(白色)+2NO3-
Hg(SCN)2+2SCN-====[Hg(SCN)4]2-(无色)
Zn2++[Hg(SCN)4]2-=====Zn[Hg(SCN)4] ↓(白色,在中性或微酸性溶液中稳定)
(四)、铜、银、汞的氧化还原性
1、Cu2O的生成和性质:
2[Cu(OH)4]2-+CH2OH(CHOH)4CHO=====Cu2O↓+CH2OH(CHOH)4COOH+4OH-+2H2O
Cu2O晶粒大小不同而呈现多种颜色,例如黄色、红色、深棕色,Cu2O为共价化合物,呈弱碱性,对热十分稳定。在实验中大多数学生得到“铜镜”。加稀HCl溶解。
(1)、Cu2O+H2SO4====Cu2SO4+H2O
Cu2SO4====CuSO4+Cu
(2)、Cu2O+4NH3·H2O===2[Cu(NH3)2]+(无色)+2OH-+3H2O
2[Cu(NH3)2]++4NH3·H2O+1/2 O2====2[Cu(NH3)4]2++2OH-+3H2O
2、CuCl的生成和性质
Cu2++Cu+2Cl-====CuCl↓(白色)
CuCl+HCl====H[CuCl2]
当Cu作还原剂时,由于难溶的CuCl附着在Cu的表面,影响了反应的继续进行。因此需加入浓HCl使CuCl溶解生成配离子[CuCl2]-,使溶液中的Cu2+浓度降低到非常小,可使反应进行到完全程度。再者,浓HCl还抑制CuCl的水解。加水后稀释了溶液,[CuCl2]-被破坏而析出大量CuCl。
CuCl+2NH3·H2O====Cu(NH3)2+(无色)+Cl-+2H2O
↓ →蓝色[Cu(NH3)4]2+
CuCl+HCl====H[CuCl2]
3、CuI的生成和性质
2Cu2++4I-====2CuI+I2
I- 即是还原剂又是沉淀剂,因为CuI是沉淀剂,所以在I-存在时Cu2+ 的氧化性大大增强:
Cu2++I-+e=====CuI Φ?==0.86V
I2+2e =====2I- Φ?==0.536V
加Na2S2O3溶液应适量,将I2还原。若Na2S2O3加过量:
2CuI+2S2O32- (过量)====[Cu(S2O3)2]2-+2I-
有的学生加Na2S2O3后,上部溶液显黄绿色,是因为CuSO4加过量。
4、Hg(Ⅰ)与Hg(Ⅱ)的相互转化
(1)、Hg2+的氧化性
Hg(NO3)2+SnCl2(适量)=====Hg2Cl2 ↓(白色)+Sn(NO3)4
Hg2Cl2+SnCl2(过量)====2Hg↓(黑色)+H2SnCl6
在酸性溶液中Hg(Ⅱ)是一个较强的氧化剂。
(2)、Hg2+转化为Hg2+2和Hg2+2的歧化分解
Hg(NO3)2+Hg====Hg2(NO3)2
Hg2(NO3)2+2NaCl====Hg2Cl2↓(白色)+2NaNO3
Hg2(NO3)2+2NH3=====HgNH2NO3↓(白色)+Hg↓(黑色)+NH4NO3
-
实验七_ds区金属(铜、银、锌、镉汞)
ds区金属铜银锌镉汞一目的要求了解铜锌铬汞氧化物氢氧化物的酸碱性硫化物的溶解性了解CuCu重要化合物的性质及相互转化条件试验并熟悉…
-
实验二十一ds区金属
实验二十一ds区金属一实验目的1掌握铜银锌镉汞氧化物或氢氧化物的酸碱性硫化物的溶解性2掌握CuCu重要化合物的性质及相互转化条件3…
-
实验6 ds区金属
湖北工程学院化学与材料科学学院无机化学实验报告20xx实验6ds区金属铜银锌镉何艳学号012301314211实验日期20xx年4…
- ds区元素实验报告
-
实验七 ds区金属(铜、银、锌、镉汞)
实验七ds区金属铜银锌镉汞一目的要求了解铜锌铬汞氧化物氢氧化物的酸碱性硫化物的溶解性了解CuCu重要化合物的性质及相互转化条件试验…