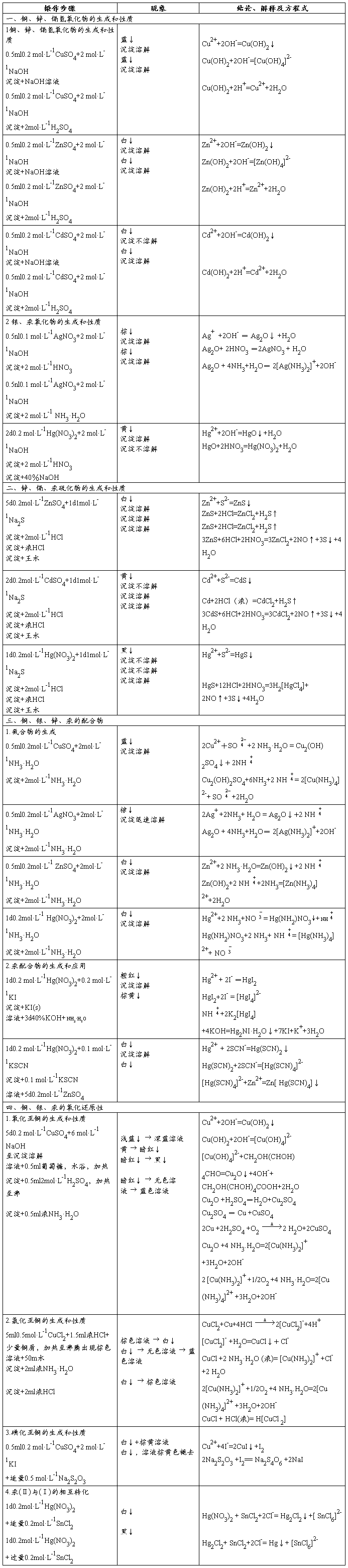
实验七_ds区金属(铜、银、锌、镉汞)
ds区金属(铜、银、锌、镉、汞)
一. 目的要求
了解铜锌铬汞氧化物氢氧化物的酸碱性。
硫化物的溶解性
了解Cu(Ⅰ)Cu(Ⅱ)重要化合物的性质及相互转化条件。
试验并熟悉铜银锌铬汞的配位能力及Hg(Ⅰ)和Hg(Ⅱ)的转化
二. 实验原理
三. 操作步骤
第二篇:ds区元素
1 ds区元素
1.1 本章学习要求
(1)掌握铜和银的重要化合物的性质,Cu(Ⅰ)和Cu(Ⅱ)的相互转化。
(2)掌握锌和汞的重要化合物的性质,Hg(Ⅰ)和Hg(Ⅱ)的相互转化。
(3)了解镉的重要化合物性质。
(4)了解含汞、镉废水的处理。
ds区元素包括铜族元素(铜、银、金)和锌族元素(锌、镉、汞)。这两族元素原子的价电子构型与其它过渡元素有所不同,为(n-1)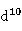 n
n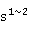 。由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
。由于它们的次外层d能级有10个电子(全满结构),而最外层的电子构型又和s区相同,所以称为ds区。
1.2 铜族元素通性和单质
1.2.1 概述
ⅠB族元素包括铜(Cu)、银(Ag)、金(Au)三种元素,通常称为铜族元素。铜族元素原子的价电子构型为(n-1)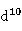 n
n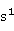 。最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
。最外层与碱金属相似,只有1个电子,而次外层却有18个电子(碱金属有8个电子)。因此与同周期的ⅠA族元素相比,铜族元素原子作用在最外层电子上的有效核电荷较多,最外层的s电子受原子核的吸引比碱金属元素原子要强得多,所以铜族元素的电离能比同周期碱金属元素显著增大,原子半径也显著减小,铜族元素单质都是不活泼的重金属,而相应的碱金属元素的单质都是活泼的轻金属。
表 1.2?1 碱金属与铜族元素比较

自然界的铜、银主要以硫化矿存在,如辉铜矿( S),黄铜矿(CuFe
S),黄铜矿(CuFe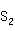 ),孔雀石[
),孔雀石[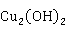 C
C ]等;银有闪银矿(
]等;银有闪银矿( S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
S);金主要以单质形式分散在岩石或沙砾中,我国江南、甘肃、云南、新疆、山东和黑龙江等省都蕴藏着丰富的铜矿和金矿。
铜族元素密度较大,熔点和沸点较高,硬度较小,导电性好,延展性好,尤其是金。1克金可抽3公里长的金丝,可压成0.1微米的金箔,500张的总厚度比头发的直径还薄些。金易生成合金,尤其是生成汞齐。铜是宝贵的工业材料,它的导电能力虽然次于银,但比银便宜得多。目前世界上一半以上的铜用在电器、电机和电讯工业上。铜的合金如黄铜(Cu-Zn)、青铜(Cu-Sn)等在精密仪器、航天工业方面都有广泛的应用。
银的导电、传热性居于各种金属之首,用于高级计算器及精密电子仪表中。自20世纪70年代以来,金在工业上的用途已经超过制造首饰和货币。
铜是许多动植物体内所必须的微量元素之一。铜和银的单质及可溶性化合物都有杀菌能力,银作为杀菌药剂更具奇特功效。
1.2.2 与空气的反应
Cu在常温下不与干燥的空气中的 反应,加热时生成CuO:
反应,加热时生成CuO:
2Cu+ (空气)→2CuO(黑色)
(空气)→2CuO(黑色)
Cu在常温下与潮湿的空气反应:
2Cu+ +
+ O+C
O+C →Cu
→Cu ·CuC
·CuC (铜绿)
(铜绿)
Au、Ag加热时也不与空气中的 反应。银与硫具有较强的亲和作用,和含有
反应。银与硫具有较强的亲和作用,和含有 S的空气接触逐渐变暗:
S的空气接触逐渐变暗:
4Ag+2 S+
S+ →2
→2 S(黑色)+2
S(黑色)+2 O
O
1.2.3 与酸的反应
铜族元素不能从非氧化性稀酸中置换出氢气,铜在加热的条件下能与浓硫酸反应,可以溶于硝酸,银能溶于硝酸,金只能溶于王水。
1.2.4 络合反应
铜、银、金都易形成配合物。湿法冶金(用氰化物从Ag、Au的硫化物矿或砂金中提取银和金)就是利用这一性质。例如:
2 S+10NaCN+
S+10NaCN+ +2
+2 O→4Na[Ag
O→4Na[Ag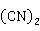 ]+4NaOH+2NaCNS
]+4NaOH+2NaCNS
2Au+4NaCN+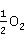 +4
+4 O→Na[Au
O→Na[Au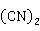 ]+2NaOH
]+2NaOH
然后加入锌粉,银、金即被置换出来:
2Na[Ag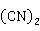 ]+Zn→
]+Zn→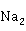 [Zn
[Zn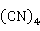 ]+2Ag
]+2Ag
2Na[Au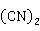 ]+Zn→
]+Zn→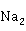 [Zn
[Zn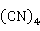 ]+2Au
]+2Au
1.2.5 其他
铜族元素在高温下也不能与氢、氮和碳反应;
与卤素反应情况不同:铜在常温下就有反应,而银较慢,金只有在加热时才能反应。
1.3 铜的化合物
1.3.1 概述
通常铜有+1、+2两种氧化值的化合物。以Cu(II)化合物最为常见,如氧化铜CuO、硫酸铜CuS 等。Cu(I)化合物通常称为亚铜化合物,多存在于矿物中,如氧化亚铜
等。Cu(I)化合物通常称为亚铜化合物,多存在于矿物中,如氧化亚铜 O、硫化亚铜
O、硫化亚铜 S。
S。
下面对Cu(I)和Cu(II)两类化合物的性质做一对比:
(1)Cu(I)化合物,如氧化亚铜、硫化亚铜、卤化亚铜、氰化亚铜等大多难溶解于水(配合物除外);较多的Cu(II)化合物易溶解于水。
(2)在固相状态Cu(I)很稳定,因为Cu(I)的价层电子构型为3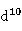 (d轨道为全满的稳定结构),而Cu(II)的价层电子构型为3
(d轨道为全满的稳定结构),而Cu(II)的价层电子构型为3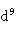 ,固相中Cu(I)比Cu(II)更稳定。自然界存在的辉铜矿(
,固相中Cu(I)比Cu(II)更稳定。自然界存在的辉铜矿( S)、赤铜矿(
S)、赤铜矿( O)都是亚铜化合物。又如
O)都是亚铜化合物。又如 O的热稳定性比CuO还高:CuO在1100℃时分解成
O的热稳定性比CuO还高:CuO在1100℃时分解成 O和
O和 ,而
,而 O在高达1800℃时才开始分解。
O在高达1800℃时才开始分解。
在溶液中,Cu(II)化合物比较稳定,因为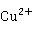 有较大的水合热(2119kJ/mol),在水溶液中形成了稳定的
有较大的水合热(2119kJ/mol),在水溶液中形成了稳定的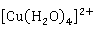 配离子。
配离子。
(3)Cu(I)在水溶液中发生岐化反应。
铜元素的电势图为:
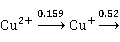 Cu
Cu
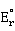 >
> ,说明Cu(I)在水溶液中不能稳定存在,易发生岐化反应生成Cu和Cu(II):
,说明Cu(I)在水溶液中不能稳定存在,易发生岐化反应生成Cu和Cu(II):
2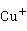 →
→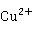 +Cu
+Cu
该反应的平衡常数为lg =
=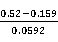 =
=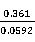 =6.098
=6.098
 =1.6×
=1.6×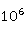 (25℃),可见
(25℃),可见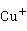 的岐化反应比较彻底。
的岐化反应比较彻底。
在生产实践中,制得的亚铜化合物必须迅速从溶液中滤出并立即干燥,然后密封包装,才能保持其稳定性。然而要完全隔绝潮气并不容易,所以亚铜化合物往往不能长期保存。
1.3.2 Cu(I)化合物
Cu(I)是Cu元素的中间价态,它既有氧化性,又有还原性。
1.3.2.1 氧化亚铜(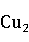 O)
O)
 O为暗红色的固体,有毒。它是制造玻璃和搪瓷的红色颜料,还用作船舶底漆(可杀死低级海生动物)及农业上的杀虫剂。
O为暗红色的固体,有毒。它是制造玻璃和搪瓷的红色颜料,还用作船舶底漆(可杀死低级海生动物)及农业上的杀虫剂。 O不溶于水,对热稳定,在潮湿空气中缓慢被氧化成CuO。它具有半导体性质,曾用作整流器的材料。
O不溶于水,对热稳定,在潮湿空气中缓慢被氧化成CuO。它具有半导体性质,曾用作整流器的材料。
 O的制备有干法和湿法:
O的制备有干法和湿法:
 O的干法制备在密闭容器中煅烧铜粉和CuO的混合物,即得暗红色的
O的干法制备在密闭容器中煅烧铜粉和CuO的混合物,即得暗红色的 O:
O:
Cu+CuO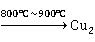 O
O
 O的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性(PH=5),
O的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性(PH=5), O即按以下反应析出:
O即按以下反应析出:
2CuS +3
+3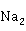 S
S →
→ O↓+3
O↓+3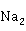 S
S +2S
+2S ↑
↑
 O溶于稀硫酸,之后立即歧化:
O溶于稀硫酸,之后立即歧化:
 O+
O+ S
S →CuS
→CuS +Cu+
+Cu+ O
O
 O溶于氨水和氢卤酸时,仍保持+1的氧化值,分别形成稳定的无色配合物,例如
O溶于氨水和氢卤酸时,仍保持+1的氧化值,分别形成稳定的无色配合物,例如 、
、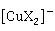 、
、 等。
等。
 O+4
O+4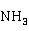 ·
· O→2[
O→2[ ]OH+3
]OH+3 O
O
可见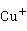 在水溶液中不稳定会发生岐化反应,而Cu(I)在固相或配位状态下可以稳定存在。
在水溶液中不稳定会发生岐化反应,而Cu(I)在固相或配位状态下可以稳定存在。
1.3.2.2 氯化亚铜CuCl
CuCl为白色固体物质,属于共价化合物,其熔体导电性差。通过测定其蒸气的相对分子质量,证实它的分子式应该是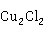 ,通常将其化学式写为CuCl。CuCl是重要的亚铜盐,在有机合成中用作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂肪和油类的凝聚剂,也常用作杀虫剂和防腐剂。它能吸收CO而生成氯化羰基亚铜CuCl·CO,此反应在气相分析中可用于测定混合气体中CO的含量,应用颇为广泛。
,通常将其化学式写为CuCl。CuCl是重要的亚铜盐,在有机合成中用作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂肪和油类的凝聚剂,也常用作杀虫剂和防腐剂。它能吸收CO而生成氯化羰基亚铜CuCl·CO,此反应在气相分析中可用于测定混合气体中CO的含量,应用颇为广泛。
CuCl和 O一样,难溶于水。在潮湿空气中迅速被氧化,体现Cu(I)有还原性,由白色而变绿:
O一样,难溶于水。在潮湿空气中迅速被氧化,体现Cu(I)有还原性,由白色而变绿:
4CuCl+ +4
+4 O→Cu
O→Cu ·3CuO·3
·3CuO·3 O+2HCl
O+2HCl
Cu(I)也有氧化性:
CuI(白)+2Hg→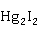 (黄色)+Cu
(黄色)+Cu
将涂有白色CuI的纸条挂在室内,若常温下3小时白色不变,表明空气中汞的含量不超标。
CuCl能溶于氨水、浓盐酸以及NaCl、KCl溶液,并生成相应的配合物。
在CuCl的制备过程中,综合应用了配位平衡、氧化还原平衡、沉淀平衡等的基本概念。用S 还原CuS
还原CuS 制备CuCl,主要发生了以下三步反应:
制备CuCl,主要发生了以下三步反应:
合成(配合反应),硫酸铜与过量的食盐作用:
CuS +4NaCl→
+4NaCl→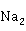 [Cu
[Cu ](绿色)+
](绿色)+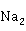 S
S
还原,将S 通入上述溶液中:
通入上述溶液中:
2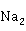 [Cu
[Cu ]+S
]+S +2
+2 O→CuCl↓+NaH[Cu
O→CuCl↓+NaH[Cu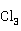 ](茶褐色)+2NaCl+2HCl+NaHS
](茶褐色)+2NaCl+2HCl+NaHS
将上述溶液加入到大量水中,冲稀分解,让配合物转为沉淀物:
NaH[Cu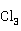 ]→NaCl+HCl+CuCl↓(白色)
]→NaCl+HCl+CuCl↓(白色)
1.3.2.3 氢氧化亚铜CuOH
CuOH为黄色固体,当用NaOH处理CuCl在盐酸中的冷溶液时,生成黄色的CuOH。它及不稳定,易脱水变为 O。
O。
1.3.3 Cu(II)化合物
1.3.3.1 氧化铜CuO
氧化铜CuO为黑色粉末,难溶于水。它是偏碱性氧化物,溶于稀酸:
CuO+2 →
→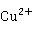 +
+ O
O
由于发生配合反应,CuO也溶于N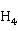 Cl或KCN等溶液。加热分解硝酸铜或碱式碳酸铜都能制得黑色的氧化铜:
Cl或KCN等溶液。加热分解硝酸铜或碱式碳酸铜都能制得黑色的氧化铜:
2Cu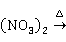 2CuO+4N
2CuO+4N ↑+
↑+ ↑
↑
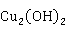 C
C 2CuO+C
2CuO+C ↑+
↑+ O↑
O↑
后一反应可以避免N 对大气的污染,更适合于工业生产。
对大气的污染,更适合于工业生产。
目前,工业上生产CuO常利用废铜料,先制成CuS ,再由金属铁还原得到比较纯净的铜粉。铜粉再经过焙烧得CuO。有关反应如下:
,再由金属铁还原得到比较纯净的铜粉。铜粉再经过焙烧得CuO。有关反应如下:
Cu+2 S
S (浓)
(浓)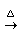 CuS
CuS +S
+S ↑+2
↑+2 O
O
CuS +Fe→FeS
+Fe→FeS +Cu
+Cu
2Cu+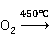 2CuO
2CuO
1.3.3.2 氢氧化铜Cu
Cu 为浅蓝色粉末,难溶于水。60~80℃时,逐渐脱水而生成CuO,颜色随之变暗。Cu
为浅蓝色粉末,难溶于水。60~80℃时,逐渐脱水而生成CuO,颜色随之变暗。Cu 稍有两性,易溶于酸:
稍有两性,易溶于酸:
Cu +
+ S
S →CuS
→CuS +2
+2 O
O
只溶于较浓的强碱,生成四羟基合铜(II)配离子:
Cu +2
+2 →
→
Cu 也易溶于氨水,生成深蓝色的四氨合铜(II)配离子:
也易溶于氨水,生成深蓝色的四氨合铜(II)配离子:
Cu +4
+4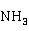 →[
→[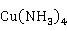 ]
]
1.3.3.3 铜(II)盐
铜(II)盐很多,可溶性的有CuS 、Cu
、Cu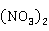 、Cu
、Cu ;难溶性的有CuS、
;难溶性的有CuS、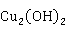 C
C 等。
等。
(1)硫酸铜(CuS ·5
·5 O):CuS
O):CuS ·5
·5 O为蓝色结晶,又名胆矾或蓝矾。在空气中慢慢风化,表面上形成白色粉状物。加热至250℃左右失去全部结晶水成为无水盐。无水CuS
O为蓝色结晶,又名胆矾或蓝矾。在空气中慢慢风化,表面上形成白色粉状物。加热至250℃左右失去全部结晶水成为无水盐。无水CuS 为白色粉末,不溶于乙醇和乙醚,其吸水性很强,吸水后即显出特征蓝色。可利用这一性质来检验乙醚、乙醇等有机溶剂中的微量水分,并可作干燥剂使用。
为白色粉末,不溶于乙醇和乙醚,其吸水性很强,吸水后即显出特征蓝色。可利用这一性质来检验乙醚、乙醇等有机溶剂中的微量水分,并可作干燥剂使用。
硫酸铜有多种用途,如作媒染剂、蓝色染料、船舶油漆、电镀、杀菌及防腐剂。CuS 溶液有较强的杀菌能力,可防止水中藻类生长。它和石灰乳混合制得的“波尔多液”能消灭树木的害虫。CuS
溶液有较强的杀菌能力,可防止水中藻类生长。它和石灰乳混合制得的“波尔多液”能消灭树木的害虫。CuS 和其它铜盐一样,都是有毒的。
和其它铜盐一样,都是有毒的。
工业用的CuS 常由废铜在600~700℃进行焙烧,使其生成CuO,再在加热下溶于硫酸,即可得到硫酸铜:
常由废铜在600~700℃进行焙烧,使其生成CuO,再在加热下溶于硫酸,即可得到硫酸铜:
2Cu+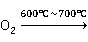 2CuO
2CuO
CuO+ S
S →CuS
→CuS +
+ O
O
将所得的粗品用重结晶法提纯。
在水溶液中,CuS 能和许多物质发生反应,如图 1.3?1所示:
能和许多物质发生反应,如图 1.3?1所示:
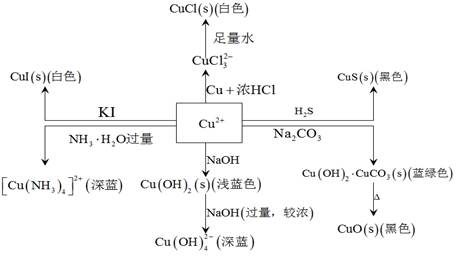
图 1.3?1铜化合物相互转化关系图
(2)氯化铜(Cu ·2
·2 O)在卤化铜Cu
O)在卤化铜Cu 中较为重要。由氧化铜或硫酸铜与盐酸反应可以得到氯化铜,也可由单质直接合成。
中较为重要。由氧化铜或硫酸铜与盐酸反应可以得到氯化铜,也可由单质直接合成。
无水氯化铜(Cu )为黄棕色固体,X射线研究证明,它是共价化合物,具有链状的分子结构(如图 1.3?2,与Cu原子相连的4个Cl原子只有对角的2个Cl原子与Cu原子在一个平面):
)为黄棕色固体,X射线研究证明,它是共价化合物,具有链状的分子结构(如图 1.3?2,与Cu原子相连的4个Cl原子只有对角的2个Cl原子与Cu原子在一个平面):

图 1.3?2 Cu 链状的分子结构
链状的分子结构
Cu 不但易溶于水,还易溶于乙醇、丙酮等有机溶剂。
不但易溶于水,还易溶于乙醇、丙酮等有机溶剂。
从溶液中结晶出来的氯化铜为Cu ·2
·2 O的绿色晶体。Cu
O的绿色晶体。Cu 的溶液通常为黄绿色或绿色,这是由于溶液中含有
的溶液通常为黄绿色或绿色,这是由于溶液中含有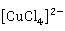 和
和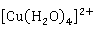 两种配离子的缘故。它们在水溶液中存在下列平衡:
两种配离子的缘故。它们在水溶液中存在下列平衡:
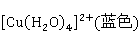 +4
+4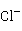 ?
?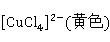 +4
+4 O
O
很稀的溶液呈蓝色,是由于主要以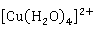 配离子存在,在浓盐酸、卤化物溶液中以及很浓的溶液为黄色,是由于主要以
配离子存在,在浓盐酸、卤化物溶液中以及很浓的溶液为黄色,是由于主要以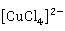 存在;在较浓的溶液中
存在;在较浓的溶液中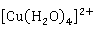 和
和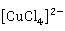 的量相当时便显出绿色。
的量相当时便显出绿色。
Cu ·2
·2 O在潮湿的空气中易潮解,在干燥的空气中却易风化。对其加热,按下式分解:
O在潮湿的空气中易潮解,在干燥的空气中却易风化。对其加热,按下式分解:
2Cu ·2
·2 O
O Cu
Cu ·Cu
·Cu +2HCl
+2HCl
无水氯化铜分解按下式进行:
2Cu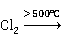 2CuCl+
2CuCl+
(3)碱式碳酸铜[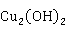 C
C ]
]
碱式碳酸铜又名孔雀石,是一种名贵的矿物宝石。它是铜与空气中的氧气、二氧化碳和水等物质反应生成的,又称铜锈(铜绿)。碱式碳酸铜是有机合成的催化剂、种子处理的杀虫剂、饲料中铜的添加剂,也可用作颜料、烟火、其他铜盐和固体荧光粉激活剂等。
工业上采用可溶性铜盐和可溶性碳酸盐反应来制备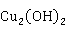 C
C 。为了保证产品的纯度,反应系统中的
。为了保证产品的纯度,反应系统中的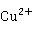 、
、 和C
和C 的浓度是有严格要求的,可以通过酸碱平衡、配位平衡和沉淀平衡加以控制。具体地说,生成之初先往N
的浓度是有严格要求的,可以通过酸碱平衡、配位平衡和沉淀平衡加以控制。具体地说,生成之初先往N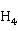 HC
HC 溶液中通入氨气:
溶液中通入氨气:
N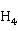 HC
HC +
+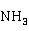 →
→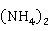 C
C
以保持溶液中有足够多的游离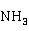 和C
和C ,慢慢地向该溶液中加入Cu
,慢慢地向该溶液中加入Cu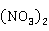 ,由于
,由于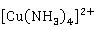 的生成,溶液呈深蓝色;随着Cu
的生成,溶液呈深蓝色;随着Cu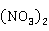 的增多,其水解使系统的酸性增强,导致
的增多,其水解使系统的酸性增强,导致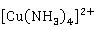 的离解,到
的离解,到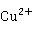 足够多的时候,便析出蓝绿色沉淀:
足够多的时候,便析出蓝绿色沉淀:
2 +2
+2 +C
+C →
→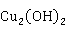 C
C ↓
↓
1.4 银的化合物
1.4.1 概述
银通常形成氧化值为+1的化合物。首先对它们的性质作一概述。
(1)在常见的银的化合物中,除AgN 、AgF、AgCl
、AgF、AgCl 易溶,
易溶, S
S 微溶外,其它银盐及
微溶外,其它银盐及 O大都难溶于水。这是银盐的一个重要特点。
O大都难溶于水。这是银盐的一个重要特点。
(2)银的化合物都有不同程度的感光性。例如AgCl、AgN 、
、 S
S 、AgCN等都是白色结晶,见光变成灰黑色或黑色。AgBr、AgI、
、AgCN等都是白色结晶,见光变成灰黑色或黑色。AgBr、AgI、 C
C 等为黄色或浅黄结晶,见光也变成灰黑或黑色。故银盐一般都用棕色瓶盛装,并避光存放。
等为黄色或浅黄结晶,见光也变成灰黑或黑色。故银盐一般都用棕色瓶盛装,并避光存放。
(3)银离子易与许多配体形成配合物。常见的配体有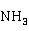 、
、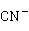 、S
、S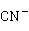 、
、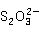 等,形成的配合物可溶于水,因此难溶解的银盐(包括
等,形成的配合物可溶于水,因此难溶解的银盐(包括 O)可与上述配体作用而溶解。
O)可与上述配体作用而溶解。
下面介绍几种银的重要化合物。
1.4.2 氧化银(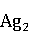 O)
O)
向可溶性银盐溶液中加入强碱,得到暗褐色 O沉淀:
O沉淀:
2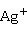 +2
+2 →
→ O↓+
O↓+ O
O
该反应可以认为先生成极不稳定的AgOH,常温下它立即脱水生成 O。
O。
 O受热不稳定,加热至300℃即完全分解为Ag和
O受热不稳定,加热至300℃即完全分解为Ag和 。此外,
。此外, O具有较强的氧化性,有机物摩擦可引起燃烧,能氧化CO、
O具有较强的氧化性,有机物摩擦可引起燃烧,能氧化CO、 ,本身被还原为单质银。
,本身被还原为单质银。
 O可溶于硝酸,也可溶于氰化钠或氨水溶液中:
O可溶于硝酸,也可溶于氰化钠或氨水溶液中:
 O+2
O+2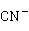 +
+ O→2
O→2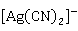 +2
+2
 O+4
O+4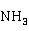 +
+ O→2
O→2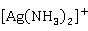 +2
+2
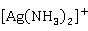 的溶液在放置过程中,会分解为黑色的易爆物Ag
的溶液在放置过程中,会分解为黑色的易爆物Ag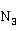 。因此,该溶液不易久置。而且,凡是接触过
。因此,该溶液不易久置。而且,凡是接触过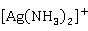 的器皿、用具,用后必须立即清洗干净,以免潜伏安全隐患。
的器皿、用具,用后必须立即清洗干净,以免潜伏安全隐患。
1.4.3 硝酸银AgN
AgN 是最重要的可溶性银盐,可由单质银与硝酸作用制得:
是最重要的可溶性银盐,可由单质银与硝酸作用制得:
3Ag+4HN (稀)→3AgN
(稀)→3AgN +NO↑+2
+NO↑+2 O
O
Ag+2HN (浓)→AgN
(浓)→AgN +N
+N ↑+
↑+ O
O
因为AgN 容易制得,所以它是制备其它银的化合物的原料。图 1.4?1列出了由AgN
容易制得,所以它是制备其它银的化合物的原料。图 1.4?1列出了由AgN 制备各种银的化合物的方法:
制备各种银的化合物的方法:
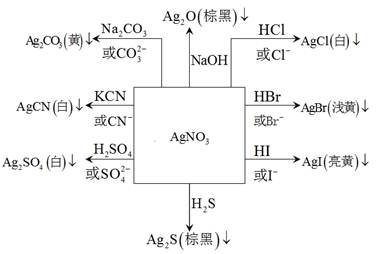
图 1.4?1 银化合物相互转化关系图
AgN 在干燥空气中比较稳定,潮湿状态下见光容易分解,并因析出单质银而变黑:
在干燥空气中比较稳定,潮湿状态下见光容易分解,并因析出单质银而变黑:
2AgN →2Ag+2N
→2Ag+2N ↑+
↑+ ↑
↑
AgN 具有氧化性
具有氧化性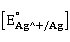 =0.799V,遇到微量有机物即被还原成单质银。实验过程中,皮肤或工作服上不小心沾有AgN
=0.799V,遇到微量有机物即被还原成单质银。实验过程中,皮肤或工作服上不小心沾有AgN 后,会逐渐变成黑紫色。含有
后,会逐渐变成黑紫色。含有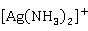 的溶液能把醛或某些糖类氧化,本身被还原为单质银。例如:
的溶液能把醛或某些糖类氧化,本身被还原为单质银。例如:
2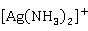 +HCHO+3
+HCHO+3 →HCO
→HCO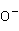 +2Ag(s)+4
+2Ag(s)+4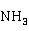 +2
+2 O
O
工业上利用这类反应来制镜或在暖水瓶的夹层中镀银。
1.4.4 卤化银
溶解度:卤化银中只有AgF易溶于水,其余的卤化银均难溶于水。
难溶卤化银溶解度依Cl—Br—I的顺序降低(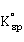 依次减小),
依次减小),
颜色:颜色也依此顺序加深。
卤化银光敏性比较强,在光照下分解:2AgX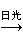 2Ag+
2Ag+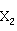
从AgF到AgI稳定性依次减弱,分解的趋势增大,因此在制备AgBr和AgI时常在暗室内进行。基于卤化银的感光性,也可将易于感光变色的卤化银加进玻璃以制造变色眼镜。
1.5 锌副族元素通性和单质
ⅡB族元素包括锌、镉、汞三种元素,通常称为锌副族元素。锌副族元素原子的价电子构型为(n-1)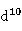 n
n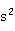 。它们的化合物都呈+2的氧化值,对汞而言,还有+1的氧化值,且常以
。它们的化合物都呈+2的氧化值,对汞而言,还有+1的氧化值,且常以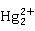 的形式存在。锌副族元素的水合离子均无色。
的形式存在。锌副族元素的水合离子均无色。
汞在室温下可以与硫粉作用,生成HgS。所以可以把硫粉撒在有汞的地方,防止有毒的汞蒸气进入空气中。若空气中已有汞蒸气,可以把碘升华为气体,使汞蒸气与碘蒸气相遇,生成Hg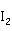 ,以除去空气中的汞蒸气。
,以除去空气中的汞蒸气。
常温下,IIB族元素单质都很稳定。加热条件下,Zn、Cd、Hg均可与 反应,生成MO式氧化物:
反应,生成MO式氧化物:
2Zn+ →2ZnO(白色)
→2ZnO(白色)
2Cd+ →2CdO(褐色)
→2CdO(褐色)
2Hg+ →2HgO(红色)
→2HgO(红色)
在潮湿的空气中,Zn将生成碱式盐:
4Zn+2 +C
+C +3
+3 O→ZnC
O→ZnC ·3Zn
·3Zn
Zn、Cd都能与稀盐酸、稀硫酸反应,放出 ,Hg不能。Hg与氧化性酸反应,生成汞盐:
,Hg不能。Hg与氧化性酸反应,生成汞盐:
Hg+2 S
S (浓)→HgS
(浓)→HgS +S
+S ↑+
↑+ O
O
Hg+4HN (浓)→Hg
(浓)→Hg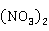 +2N
+2N ↑+2
↑+2 O
O
冷硝酸与过量的汞反应生成亚汞:
6Hg+8HN →3
→3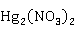 +2NO↑+4
+2NO↑+4 O
O
Zn既能与酸反应,也可与碱性溶液反应,是典型的两性元素:
Zn+2NaOH+2 O→
O→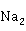 [Zn
[Zn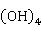 ]+
]+ ↑
↑
Cd、Hg不和碱反应。
1.6 锌和镉的化合物
1.6.1 锌和镉的氧化物和氢氧化物
1.6.1.1 锌和镉的氧化物
ZnO为白色粉末状固体,CdO为棕黄色粉末状固体,它们均不溶于水。氧化锌和氧化镉可由金属在空气中燃烧制得,也可由相应的碳酸盐、硝酸盐加热分解而制得:
金属锌氧化法:金属锌经过加热熔融(熔点419℃)后,吹入空气。
2Zn+ →2ZnO
→2ZnO
碱式碳酸锌加热分解法:由锌盐与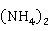 C
C 或
或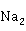 C
C 等可溶性碳酸盐合成碱式碳酸锌,然后将其加热分解,即可得到ZnO
等可溶性碳酸盐合成碱式碳酸锌,然后将其加热分解,即可得到ZnO
ZnC ·2Zn
·2Zn ·2
·2 O
O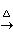 3ZnO+C
3ZnO+C ↑+4
↑+4 O↑
O↑
ZnO是两性氧化物,既能与酸反应,也能与碱反应:
ZnO+2HCl→Zn +
+ O
O
ZnO+2NaOH→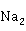 Zn
Zn +
+ O
O
或者ZnO+2NaOH+ O→
O→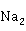 [Zn((OH)4]
[Zn((OH)4]
1.6.1.2 锌和镉的氢氧化物
氢氧化锌Zn 和Cd
和Cd 都是难溶于水的白色固体物质。Zn
都是难溶于水的白色固体物质。Zn 具有明显的两性,可溶于酸和过量强碱中:
具有明显的两性,可溶于酸和过量强碱中:
Zn +2
+2 →
→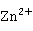 +2
+2 O
O
Zn +2
+2 →
→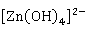
这是因为在水溶液中有两种离解方式[与Al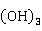 、Cr
、Cr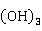 相似]:
相似]:
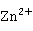 +2
+2 (碱式离解)?Zn
(碱式离解)?Zn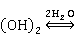 2
2 +
+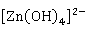 (酸式离解)
(酸式离解)
根据平衡移动原理,在酸性溶液中,平衡向左移动。当溶液酸度足够大时,得到锌盐;在碱性溶液中,平衡向右移动。当碱度足够大时,得到锌酸盐。
Cd 呈明显碱性,仅有微弱的酸性,只能稍溶于浓碱液中,生成
呈明显碱性,仅有微弱的酸性,只能稍溶于浓碱液中,生成 。
。
Zn 和Cd
和Cd 都能溶于氨水中,形成配合物:
都能溶于氨水中,形成配合物:
Zn +4
+4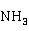 →
→ +2
+2
Cd +4
+4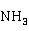 →
→ +2
+2
1.6.2 锌和镉重要的盐
1.6.2.1 锌和镉的氯化物
卤化锌Zn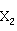 (X=Cl、Br、I)是白色结晶,极易吸潮。可由锌和卤素单质直接合成:
(X=Cl、Br、I)是白色结晶,极易吸潮。可由锌和卤素单质直接合成:
Zn+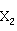 →Zn
→Zn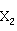
ZnBr2、Zn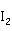 用于医药和分析试剂。Zn
用于医药和分析试剂。Zn 因为有很强的吸水性,在有机合成中常用作脱水剂、缩合剂和氧化剂,以及染料工业的媒染剂,也用作石油净化剂和活性炭活化剂。
因为有很强的吸水性,在有机合成中常用作脱水剂、缩合剂和氧化剂,以及染料工业的媒染剂,也用作石油净化剂和活性炭活化剂。
Zn 溶于水,由于
溶于水,由于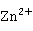 水解而呈酸性:
水解而呈酸性:
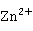 +2
+2 O?Zn
O?Zn +2
+2
Zn 浓溶液中由于形成配位酸,而有显著的酸性:
浓溶液中由于形成配位酸,而有显著的酸性:
Zn +
+ O?H[Zn
O?H[Zn (OH)]
(OH)]
配位酸能溶解金属氧化物:
2H[Zn (OH)]+FeO→Fe
(OH)]+FeO→Fe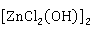 +
+ O
O
所以Zn 能用作焊药,清除金属表面的氧化物,便于焊接。
能用作焊药,清除金属表面的氧化物,便于焊接。
1.6.2.2 硫酸锌ZnS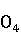 ·7
·7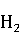 O
O
ZnS ·7
·7 O俗称皓钒,是常见的锌盐。大量用于制备锌钡白(商品名“立德粉”),它是由ZnS
O俗称皓钒,是常见的锌盐。大量用于制备锌钡白(商品名“立德粉”),它是由ZnS 和BaS经复分解反应而得。实际上锌钡白是ZnS和BaS
和BaS经复分解反应而得。实际上锌钡白是ZnS和BaS 的化合物:
的化合物:
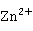 +S
+S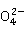 +
+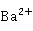 +
+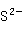 →ZnS·BaS
→ZnS·BaS ↓
↓
锌钡白遮盖力强、无毒,并且在空气中比较稳定,是优良的白色颜料,所以大量用于涂料、油墨和油漆工业。
1.6.3 锌和镉的硫化物
在可溶性的锌盐和镉盐溶液中,分别通入 S时,都会有不溶性硫化物析出:
S时,都会有不溶性硫化物析出:
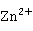 +
+ S→ZnS↓(白色)+2
S→ZnS↓(白色)+2
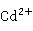 +
+ S→CdS↓(黄色)+2
S→CdS↓(黄色)+2
从溶液中析出的CdS呈黄色,常根据这一反应来鉴别溶液中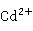 的存在。由于ZnS的溶度积较大(
的存在。由于ZnS的溶度积较大(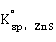 =1.6×
=1.6×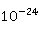 ),若溶液的
),若溶液的 的浓度超过0.3mol/L时,ZnS就能溶解。而CdS比ZnS溶度积小得多,它不溶于稀盐酸,但可溶于较浓的盐酸,如6mol/L的盐酸:
的浓度超过0.3mol/L时,ZnS就能溶解。而CdS比ZnS溶度积小得多,它不溶于稀盐酸,但可溶于较浓的盐酸,如6mol/L的盐酸:
CdS+2 +4
+4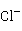 →
→ +
+ S↑
S↑
1.6.4 锌和镉的配合物
和大多数过渡元素一样,锌和镉都可以形成稳定的配合物。除前面介绍过的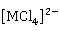 、
、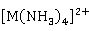 、
、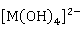 外,常见的还有
外,常见的还有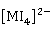 、
、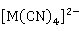 等。它们的特征配位数是4,空间构型是四面体。
等。它们的特征配位数是4,空间构型是四面体。 离子除与
离子除与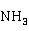 形成的配位数为4的配合物以外,还存在配位数为6的配离子
形成的配位数为4的配合物以外,还存在配位数为6的配离子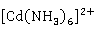 。另外
。另外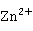 和
和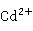 都可以与多齿配体形成螯合物。
都可以与多齿配体形成螯合物。
1.7 汞的化合物
汞与锌、镉不同,有氧化值为+1和+2两类化合物。在汞的化合物里,许多是以共价键结合。氧化值为+1的化合物称为亚汞化合物,如氯化亚汞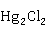 、硝酸亚汞
、硝酸亚汞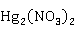 等。经过X射线衍射实验证实,亚汞离子不是
等。经过X射线衍射实验证实,亚汞离子不是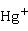 ,而是
,而是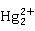 (两个汞原子之间以共价键结合—Hg—Hg—)。
(两个汞原子之间以共价键结合—Hg—Hg—)。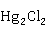 的分子结构是Cl—Hg—Hg—Cl。汞单质和大多数汞的化合物都是有毒的。
的分子结构是Cl—Hg—Hg—Cl。汞单质和大多数汞的化合物都是有毒的。
1.7.1 硫化汞
硫化汞的天然矿物叫做辰砂或朱砂,呈朱红色,中药用作安神镇静药。
硫化汞颜色的不同是由于晶型不同,这两种晶型在386℃时呈平衡状态,410℃以上,黑色型可转变为红色型。
硫化汞HgS是最难溶的金属硫化物,它不溶于盐酸及硝酸,但溶于王水生成配离子:
3HgS+12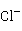 +2N
+2N +8
+8 →3
→3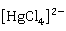 +3S↓+2NO↑+4
+3S↓+2NO↑+4 O
O
HgS也溶于硫化钠溶液,生成 :
:
HgS+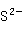 →
→
 遇酸将重新析出HgS沉淀:
遇酸将重新析出HgS沉淀:
 +2
+2 →HgS↓+
→HgS↓+ S↑
S↑
人工合成的朱砂是由汞与硫直接反应,加热升华而成:
Hg+S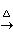 HgS
HgS
实验室中,在汞盐溶液中通入硫化氢,得到黑色硫化汞沉淀:
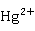 +
+ S=HgS↓+2
S=HgS↓+2
1.7.2 氯化汞和氯化亚汞
Hg 为共价型化合物,氯原子以共价键与汞原子结合成直线型分子Cl—Hg—Cl。Hg
为共价型化合物,氯原子以共价键与汞原子结合成直线型分子Cl—Hg—Cl。Hg 熔点较低(280℃),易升华,因而俗名升汞,中药上把它叫做白降丹。Hg
熔点较低(280℃),易升华,因而俗名升汞,中药上把它叫做白降丹。Hg 是剧毒物质,误服0.2~0.4g就能致命。Hg
是剧毒物质,误服0.2~0.4g就能致命。Hg 易溶于水,其稀溶液有杀菌作用,例如1:1000的稀溶液可用作外科手术器械的消毒剂。
易溶于水,其稀溶液有杀菌作用,例如1:1000的稀溶液可用作外科手术器械的消毒剂。
Hg 主要用作有机合成的催化剂(如氯乙烯的合成),也用于干电池、染料、农药等。医药上用来作防腐剂、杀菌剂。
主要用作有机合成的催化剂(如氯乙烯的合成),也用于干电池、染料、农药等。医药上用来作防腐剂、杀菌剂。
Hg 在酸性溶液中是较强的氧化剂,适量的Sn
在酸性溶液中是较强的氧化剂,适量的Sn 可将其还原为难溶于水的白色丝状氯化亚汞
可将其还原为难溶于水的白色丝状氯化亚汞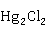 沉淀:
沉淀:
2Hg +
+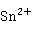 +4
+4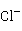 =
=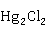 ↓(白色)+
↓(白色)+
如果Sn 过量,生成的
过量,生成的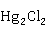 可进一步被Sn
可进一步被Sn 还原为金属汞:
还原为金属汞:
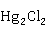 +
+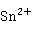 +4
+4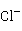 =2Hg↓(黑色)+
=2Hg↓(黑色)+
分析化学中利用此反应鉴定Hg(Ⅱ)或Sn(Ⅱ)。
另外,Hg 与
与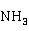 ·
· O反应可生成一种难溶解的白色氨基氯化汞沉淀:
O反应可生成一种难溶解的白色氨基氯化汞沉淀:
Hg +2
+2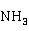 =Hg(N
=Hg(N )Cl↓(白色)+N
)Cl↓(白色)+N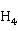 Cl
Cl
而在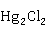 溶液中加入
溶液中加入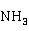 ·
· O,不仅有上述白色沉淀,同时还有黑色汞析出:
O,不仅有上述白色沉淀,同时还有黑色汞析出:
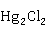 (白色)+2
(白色)+2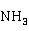 =Hg(N
=Hg(N )Cl↓+Hg(黑色)↓+N
)Cl↓+Hg(黑色)↓+N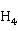 Cl
Cl
Hg 可通过在过量的氯气中加热金属汞制得:
可通过在过量的氯气中加热金属汞制得:
Hg(l)+ (g)→Hg
(g)→Hg (s),
(s),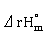 =-230kJ/mol
=-230kJ/mol
该反应一般在石英甄中进行:液态汞Hg(l)微热后通入 (g),伴随化合反应放出大量的热,使Hg
(g),伴随化合反应放出大量的热,使Hg 升华。反应始终都要保持
升华。反应始终都要保持 (g)过量,以防止
(g)过量,以防止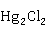 的生成。也可由氧化汞和盐酸作用,在溶液中制得Hg
的生成。也可由氧化汞和盐酸作用,在溶液中制得Hg :
:
HgO+2HCl→Hg +
+ O
O
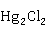 分子结构也为直线型(Cl—Hg—Hg—Cl),它是白色固体,难溶于水。少量的
分子结构也为直线型(Cl—Hg—Hg—Cl),它是白色固体,难溶于水。少量的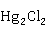 无毒。因为
无毒。因为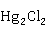 味略甜,俗称甘汞,为中药轻粉的主要成份。内服可作缓泻剂,外用治疗慢性溃疡及皮肤病。
味略甜,俗称甘汞,为中药轻粉的主要成份。内服可作缓泻剂,外用治疗慢性溃疡及皮肤病。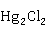 也常用于制作甘汞电极。
也常用于制作甘汞电极。
金属汞与Hg 固体一起研磨可制得氯化亚汞
固体一起研磨可制得氯化亚汞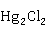 :
:
Hg +Hg→
+Hg→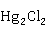
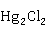 见光易分解:
见光易分解:
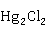 →Hg
→Hg +Hg
+Hg
1.7.3 硝酸汞和硝酸亚汞
Hg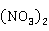 和
和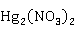 都可由金属汞和硝酸HN
都可由金属汞和硝酸HN 反应来制得,主要在于两种原料的比例不同:使用过量的65%的浓硝酸,在加热条件下,反应制得Hg
反应来制得,主要在于两种原料的比例不同:使用过量的65%的浓硝酸,在加热条件下,反应制得Hg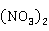 :
:
Hg+4HN (浓)
(浓)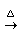 Hg
Hg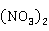 +2N
+2N ↑+2
↑+2 O
O
使用冷的稀硝酸与过量的汞反应则得到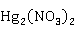 :
:
6Hg+4HN (稀)→3
(稀)→3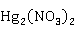 +2NO↑+4
+2NO↑+4 O
O
Hg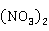 也可由HgO溶于硝酸HN
也可由HgO溶于硝酸HN 制得:
制得:
HgO+2HN →Hg
→Hg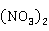 +
+ O
O
从溶液中结晶析出时常带结晶水,Hg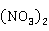 的最常见的水合物是Hg
的最常见的水合物是Hg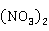 ·
· O。
O。
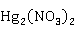 也可由Hg
也可由Hg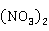 溶液与金属汞一起震荡而制得:
溶液与金属汞一起震荡而制得:
Hg+Hg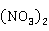 →
→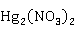
Hg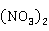 在水中强烈水解生成碱式盐沉淀:
在水中强烈水解生成碱式盐沉淀:
Hg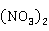 +
+ O→Hg
O→Hg ·Hg
·Hg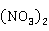 ↓+2HN
↓+2HN
所以配制溶液时,应将它溶于稀硝酸中。
硝酸汞受热分解为红色的氧化汞:
2Hg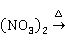 2HgO+4N
2HgO+4N ↑+
↑+ ↑
↑
从溶液中可结晶出二水合物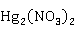 ·2
·2 O。
O。
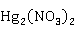 也易水解,形成碱式硝酸亚汞:
也易水解,形成碱式硝酸亚汞:
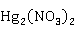 +
+ O→
O→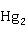 (OH)(N
(OH)(N )↓+HN
)↓+HN
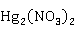 受热也容易分解:
受热也容易分解:
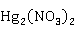
 2HgO+2N
2HgO+2N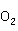 ↑
↑
1.7.4 汞的配合物
 易和
易和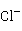 、
、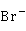 、
、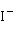 、
、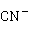 、S
、S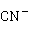 等配体形成稳定的配离子,
等配体形成稳定的配离子, 主要形成2配位的直线形配合物和4配位的四面体配合物,例如
主要形成2配位的直线形配合物和4配位的四面体配合物,例如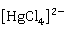 、
、 、
、 等。例如,
等。例如, 与
与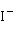 反应,生成红色Hg
反应,生成红色Hg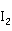 沉淀:
沉淀:
 +2
+2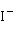 →Hg
→Hg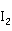 ↓(红色)
↓(红色)
在过量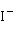 作用下,Hg
作用下,Hg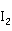 又溶解生成
又溶解生成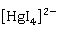 配离子:
配离子:
Hg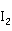 +2
+2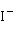 →
→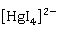 (无色)
(无色)
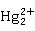 形成配合物的倾向较小。
形成配合物的倾向较小。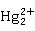 也能与I-反应,生成绿色
也能与I-反应,生成绿色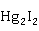 沉淀,在过量
沉淀,在过量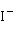 作用下,
作用下,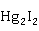 发生歧化和络合反应,也生成
发生歧化和络合反应,也生成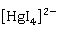 配离子:
配离子:
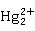 +2
+2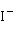 →
→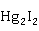 ↓(绿色)
↓(绿色)
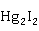 (无色)+2
(无色)+2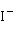 →
→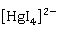 +Hg(黑色)
+Hg(黑色)
此反应可用于鉴定Hg(Ⅰ)。
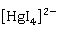 的碱性溶液称为奈斯勒(Nessler)试剂。如果溶液中有微量的
的碱性溶液称为奈斯勒(Nessler)试剂。如果溶液中有微量的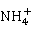 存在,滴加奈斯勒试剂,会立即生成红棕色沉淀,此反应常用来鉴定出微量的
存在,滴加奈斯勒试剂,会立即生成红棕色沉淀,此反应常用来鉴定出微量的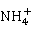 :
: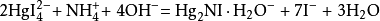
2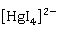 +
+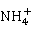 +4
+4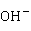 =
=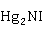 ·
·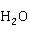 (红棕色)+7
(红棕色)+7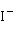 +3
+3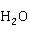
1.7.5 汞(Ⅰ)和汞(Ⅱ)的转化
汞元素的电势图如图 1.7?1:
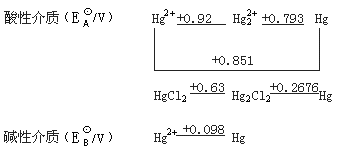
图 1.7?1 汞元素的电势图
从汞元素的电势图可看出,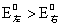 ,
,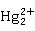 在溶液中不象
在溶液中不象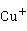 那样容易歧化。相反,在溶液中
那样容易歧化。相反,在溶液中 可氧化Hg而生成
可氧化Hg而生成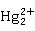 (逆岐化反应):
(逆岐化反应):
 +Hg→
+Hg→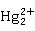
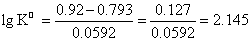
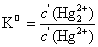 =165
=165
只要溶液中有Hg存在, 基本上都转变为
基本上都转变为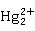 ,因此Hg(Ⅱ)化合物用金属汞还原,即可得到Hg(Ⅰ)化合物。
,因此Hg(Ⅱ)化合物用金属汞还原,即可得到Hg(Ⅰ)化合物。
由于 +Hg→
+Hg→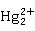 反应的平衡常数较大,平衡强烈偏向于生成
反应的平衡常数较大,平衡强烈偏向于生成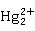 的一方,为使Hg(Ⅰ)转化为Hg(Ⅱ),即
的一方,为使Hg(Ⅰ)转化为Hg(Ⅱ),即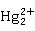 的歧化反应能够进行,必须降低溶液中
的歧化反应能够进行,必须降低溶液中 的浓度,例如使之变为某些难溶物或难解离的配合物:
的浓度,例如使之变为某些难溶物或难解离的配合物:
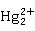 +2
+2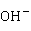 →HgO↓+Hg↓+
→HgO↓+Hg↓+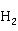 O
O
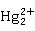 +
+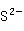 →HgS↓+Hg↓
→HgS↓+Hg↓
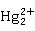 +2
+2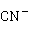 →Hg
→Hg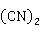 ↓+Hg↓
↓+Hg↓
1.8 含镉及含汞废水的处理
1.8.1 含镉废水
镉( )进入人体后,首先损害肾脏,并能置换骨骼中的钙(Ca2+)引起骨质疏松、骨质软化,使人感觉骨骼疼痛,故名“骨痛病”同时还伴有疲倦无力,头痛和头晕等症。并且镉在肾和肝脏中积蓄,造成积累性中毒。因此,含镉废水是世界上危害较大的工业废水之一。采矿、冶炼、电镀、蓄电池、玻璃、油漆、陶瓷、原子反应堆等部门是含镉废水的主要来源。国家规定含镉废水的排放标准为0.1mol/L。
)进入人体后,首先损害肾脏,并能置换骨骼中的钙(Ca2+)引起骨质疏松、骨质软化,使人感觉骨骼疼痛,故名“骨痛病”同时还伴有疲倦无力,头痛和头晕等症。并且镉在肾和肝脏中积蓄,造成积累性中毒。因此,含镉废水是世界上危害较大的工业废水之一。采矿、冶炼、电镀、蓄电池、玻璃、油漆、陶瓷、原子反应堆等部门是含镉废水的主要来源。国家规定含镉废水的排放标准为0.1mol/L。
含镉废水可采用以下方法处理:
(1)沉淀法对于一般工业含镉废水,可采用加碱或可溶性硫化物,使 转化为Cd
转化为Cd 或CdS沉淀出去:
或CdS沉淀出去:
 +2
+2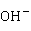 →Cd
→Cd ↓
↓
 +
+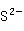 →CdS↓
→CdS↓
(2)氧化法氧化法常用于处理氰化镀镉废水。在废水中主要含有 ,另外,还有
,另外,还有 和
和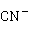 等有毒物质,因此在除去
等有毒物质,因此在除去 的同时,也要除去
的同时,也要除去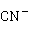 。以漂白粉作氧化剂加入废水中,使
。以漂白粉作氧化剂加入废水中,使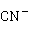 被氧化破坏,
被氧化破坏, 被沉淀而除去,其主要反应如下。
被沉淀而除去,其主要反应如下。
漂白粉在溶液中水解:
Ca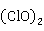 +2
+2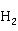 O→Ca
O→Ca +2HClO
+2HClO
HOCl将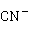 氧化为
氧化为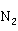 和C
和C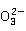 :
:
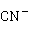 +O
+O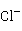 →O
→O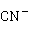 +
+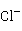
2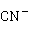 +3O
+3O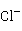 +2
+2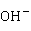 →2C
→2C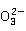 +N2↑+3
+N2↑+3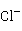 +
+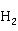 O
O
 转化为沉淀:
转化为沉淀:
 +2
+2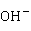 →Cd
→Cd ↓
↓
除上述介绍的两种方法外,还可采用电解法、离子交换法等方法来处理含镉废水。
1.8.2 含汞废水
含汞废水的处理早为世界各国所关注,它是重金属污染中危害最大的工业废水之一。催化合成乙烯、含汞农药、各种汞化合物的制备以及由汞齐电解法制备烧碱等都是含汞废水的来源,对环境和人体健康威胁极大。我国国家标准规定,汞的排放标准不大于0.050mg/L。
含汞废水的处理方法很多,如化学沉淀法、还原法、活性炭吸附法、离子交换法以及微生物法等。这些方法可以根据生产规模,含汞浓度以及汞化合物的类型进行选用。下面简述几种常用的方法。
化学沉淀法用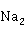 S或
S或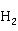 S为沉淀剂,使汞生成难溶的硫化汞HgS,这是经典的方法。由于HgS的溶解度极小(
S为沉淀剂,使汞生成难溶的硫化汞HgS,这是经典的方法。由于HgS的溶解度极小(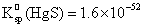 ),除汞效果很好。但HgS易造成二次污染,此乃美中不足。
),除汞效果很好。但HgS易造成二次污染,此乃美中不足。
凝聚沉淀法在废水中加入明矾K2S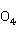 ·Al2(S
·Al2(S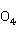 )3·2
)3·2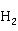 O或Fe
O或Fe 、Fe2(S
、Fe2(S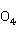 )3等铁盐,利用其水解产物如Al(OH)3或Fe(OH)3胶体,将废水中的汞吸附并一起沉淀除去。
)3等铁盐,利用其水解产物如Al(OH)3或Fe(OH)3胶体,将废水中的汞吸附并一起沉淀除去。
还原法用铁屑、铜屑、锌、锡等金属将废水中的 还原成Hg,再进行回收。这些金属离子进入水中不会造成二次污染。此外,还有的用肼、水合肼、醛类等作为还原剂还原废水中的
还原成Hg,再进行回收。这些金属离子进入水中不会造成二次污染。此外,还有的用肼、水合肼、醛类等作为还原剂还原废水中的 。
。
离子交换法让废水流经离子交换树脂, 被交换下来。此法操作简便,去汞效果好,得到普遍采用。但安装设备时需要一定的投资。
被交换下来。此法操作简便,去汞效果好,得到普遍采用。但安装设备时需要一定的投资。
对于含汞量较高的废水,例如化工厂制备汞化合物后的废水,有时高达500mg/L以上,适于采用先沉淀后离子交换的二级处理法。首先用废碱液(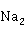 C
C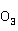 或NaOH)将废水中大量的汞沉淀出来,废水然后进入离子交换柱,既可使汞的含量达到排放标准,又可延长交换柱使用时间。
或NaOH)将废水中大量的汞沉淀出来,废水然后进入离子交换柱,既可使汞的含量达到排放标准,又可延长交换柱使用时间。
近年来,环保工作者不断寻求更加安全和经济的方法来处理含镉、汞废水,以减少或消除镉、汞在环境中的积累。含镉、汞废水成分复杂,处理达标要求又非常严格,传统的物理化学法各有优缺点。其缺点表现为处理剂使用量大,反应不易控制,水质差,回收贵金属难等。特别是镉等重金属离子浓度较低时,往往操作费用和材料的成本相对过高。而生物法因能耗少,成本低,效率高,而且容易操作,最重要的是没有二次污染,因此在城市污水和工业污水的处理中得到广泛应用。微生物能去除重金属离子,主要是因为微生物可以把重金属离子吸附到表面,然后通过细胞膜将其运输到体内积累,从而达到去除重金属的效果。
-
实验二十一ds区金属
实验二十一ds区金属一实验目的1掌握铜银锌镉汞氧化物或氢氧化物的酸碱性硫化物的溶解性2掌握CuCu重要化合物的性质及相互转化条件3…
-
实验二十一ds区金属
实验二十一ds区金属一实验目的1掌握铜银锌镉汞氧化物或氢氧化物的酸碱性硫化物的溶解性2掌握CuCu重要化合物的性质及相互转化条件3…
-
实验6 ds区金属
湖北工程学院化学与材料科学学院无机化学实验报告20xx实验6ds区金属铜银锌镉何艳学号012301314211实验日期20xx年4…
- ds区元素实验报告
-
实验七 ds区金属(铜、银、锌、镉汞)
实验七ds区金属铜银锌镉汞一目的要求了解铜锌铬汞氧化物氢氧化物的酸碱性硫化物的溶解性了解CuCu重要化合物的性质及相互转化条件试验…