乙酸正丁酯反应平衡常数的测定、制备及折光率的测定
乙酸正丁酯反应平衡常数的测定、制备及折光率的测定
Ⅰ 酯化反应平衡常数的测定
一、酯化反应平衡常数的测定原理
直接用酸催化的酯化反应是制备酯的经典方法,酯化反应是—个可逆反应并能建立平衡。
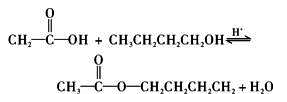
平衡常数可用下式表示:
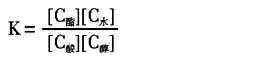
如果用等物质的量的酸和醇,并假设反应体系的总体积不变,那就可以用物质的量直接代入上式中的浓度项。而仅仅通过开始时和平衡时反应液中酸量的滴定就可以测定平衡常K。可从滴定中消耗碱的量来计算酸量。滴定所用的碱的浓度不必精确标定,因为在计算公式中碱的浓度C碱已被约去。
设n=开始时酸的物质的量=开始时醇的物质的量=碱的V0×C碱
X=平衡时酸的物质的量=平衡时醇的物质的量=碱的Va×C碱
n-x=平衡时酯的物质的量=平衡时水的物质的量=(V0—Va)×C碱
 则
则
二、药品:正丁醇32mL(25.9g×O.35mo1)
冰醋酸20mL(21g,O.35mol)
浓硫酸O.5mol·L-1氢氧化钠溶液,酚酞溶液
三、步骤
在装有回流冷凝管的100mL圆底烧瓶中,放入25.9g正丁醇和21g冰醋酸,充分摇动园底烧瓶使均匀混合。用移液管取出1.00mL反应液,放人盛有20mL蒸馏水和几滴酚酞溶液的250mL锥形瓶里。然后用0.5mol.L-1氢氧化钠溶液进行滴定(终点呈粉红色)。记录消耗的体积V0。
往烧瓶里加入4滴浓硫酸(大约0.1g)和沸石,加热回流30min。冷却溶液。用移液管取出1.00mL样品。必须从下层吸取样品,但不要把移液管插到底,先吹出少许气泡,然后取样品。用同样的氢氧化钠溶液对此样品进行滴定。记录下消耗碱的体积。
设n=开始时酸的物质的量=开始时醇的物质的量=碱的V0×C碱
x=平衡时酸的物质的量=平衡时醇的物质的量=碱的Va×C碱
n-x=平衡时酯的物质的量=平衡时水的物质的量=(V0-Va)×C碱
 则:
则:
二、药品:正丁醇32mL(25.9g,0.35mol)
冰醋酸20mL(21g,0.35mol)
浓硫酸,0.5moL·L-1氢氧化钠溶液,酚酞溶液
三、步骤
加入新的沸石,把反应混合物重新加热回流20min。再次冷却,并吸取1.00mL样品和进行滴定。如果这次碱耗用量比上次少0.3mL以上,那就要再次重复上述操作,即加入沸石,回流20min,冷却,取样1.00mL和滴定,直到连续两次滴定所耗用的碱量之差不超过0.3mL为止,记录各次碱的用量。
通过这些数据,计算酯化反应的平衡常数K。
剩余的混合液可按照乙酸正丁酯的制备实验制备乙酸正丁酯。
四、问题
1、假设作为催化剂的浓硫酸加入了0.1g,试估计由于加入硫酸在滴定中所引入的误差。
有人想要消除由于加入硫酸引起的误差,在测定V0之前就先把硫酸加入,这样做行不行?为什么?
2、用你测得的平衡常数,试解决如下的问题:2.6g正丁醇和21g冰醋酸(并加1滴浓硫酸作催化剂)共热,求反应物达到平衡时的组成。
Ⅱ、乙酸正丁酯的制备
一、实验目的
1.通过乙酸正丁酯的制备,了解酯化反应的基本原理。
2.了解和学会水分分离器的工作原理和使用方法,
3.进一步掌握液体有机物的精制方法。
4.学会液体有机化合物折光率的测定方法。
二、实验原理
1.在酸催化下,羧酸与醇反应生成酯和水,这个反应叫做酯化。羧酸与醇在酸催化下直接酯化是工业上制备酯的一种最重要的方法。
酯化反应是个可逆反应:

升高温度和使用催化剂(如H2SO4),可以提高酯化的反应速度,使反应在较短的时间内达到平衡。但一旦反应达到平衡后,酯的生成量就不再增加。为了提高酯的产量,可以采用下列措施以破坏平衡;
(1)使用过量的醇(或羧酸);
(2)使生成的酯与水或者两者之一及时蒸出。
本实验是在浓硫酸的催化下,使乙酸和正丁醇直接反应生成乙酸正丁酯;并采用过量的正丁醇和及时除去反应中生成的水的方法使平衡向生成产物的方向移动,从而提高产量。
2.主反应:

乙酸→正丁醇→乙酸正丁酯→水→
3.副反应:
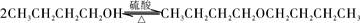
正丁醇 正丁醚

正丁醇 正丁烯
三、实验步骤
将酯化反应平衡常数的测定实验中所剩反应混合液冷却,在园底烧瓶中重新加入沸石,并安装分水器及冷凝装置。装置如图4-2所示
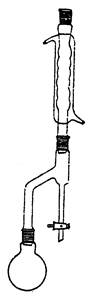
图4-2 乙酸正丁酯制备实验装置图
在加热套里加热圆底烧瓶,保持回流液成滴状,直至回流液中无水珠(大约4.5mL水)时,反应即告完成(为了观察分出的水量,实验开始前应该预先在分水器下端做个记号)。回流时间约35min。在此期间,反应液的温度由95℃逐渐升至117℃。
反应完毕后,将分水器上层酯液用分液漏斗分出,并同冷却后的反应液也一并加入到分液漏斗中,用1OmL水洗涤,分出水层,酯层用10%碳酸钠溶液洗涤(每次用1OmL),直至酯层不使兰色石芯试纸变红为止。最后,酯用lOmL水洗涤。静置lOmin,分去水层,酯层从分液漏斗上口倒入100mL干燥锥形瓶,用约2—3g无水MgSO4,干燥。
待酯液干燥后,进行蒸馏。收集120℃以前馏分,称重,倒入回收瓶中,然后收集124-126℃馏分的乙酸正丁酯粗产品,产量约20g。并测定其折光率。
四、思考题
1.本实验是根据什么原理来提高乙酸正丁酯的产率的?
2.计算反应完全时应分出多少水?
Ⅲ、折光率及其测定
折射率(又称折光率),是有机化合物的重要常数之一。它是液体化合物的纯度标志,也可作为定性的手段。
某一物质的折光率随入射光线波长、测定温度、被测物质结构、压力等因素而变化,所以折光率的表示须注明光线波长D,测定温度t,常表示为ntD,D表示钠灯的D线波长(5893A)。
用于测定液体化合物折光率的仪器是Abbe(阿贝)折射仪,其光学原理如下:
由于光在两个不同介质中的传播速度不相同,当光从一个介质进入另一个介质时,它的传播方向发生改变,这一现象称为光的折射。
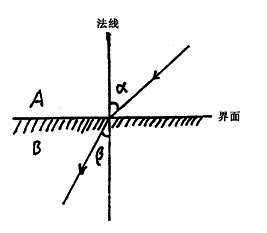
光的折射现象
根据折射定律,光线自介质A进入介质B,入射角α与折射角β的正弦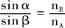 之比和两个介质的折光率成反比
之比和两个介质的折光率成反比
光的折射现象
 当入射角α为90°,sinα=1,此时折射角达到最大值,称为临界角,用β0表示。当nβ为已知时,测定临界角βO,就可得到介质A的折光率nA,即nA=nβsinβ0
当入射角α为90°,sinα=1,此时折射角达到最大值,称为临界角,用β0表示。当nβ为已知时,测定临界角βO,就可得到介质A的折光率nA,即nA=nβsinβ0
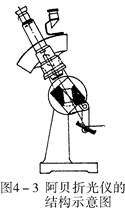
阿贝折光仪的结构如图4-3所示
测定时,先将折光仪与恒温槽相连接。恒温(一般是20℃)后,小心地扭开直角棱镜的闭合旋钮,把上下棱镜分开。用少量丙酮、乙醇或乙醚润冲上下两镜面,分别用擦镜纸顺一方向把镜面轻轻擦拭干净。待完全干燥,使下面毛玻面棱镜处于水平状态,滴加一滴高纯度蒸馏水。合上棱镜,适当扭紧闭合旋钮。调节反射镜使光线射入棱镜。转动棱镜,直到从目镜中可观察到视场中有界线或出现彩色光带。若出现彩色光带,可调整消色散镜调节器,使明暗界线清晰,再转动棱镜使界线恰好通过“十”字的交点。还需调节望远镜的目镜进行聚焦,使视场清晰。记下读数与温度。重复两次,将测得的纯水的平均折射率与纯水的标准值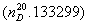 比较,就可求得仪器的校正值。然后用同样的方法,测定待测液体样品的折射率。一般说来,校正值很小。若数值太大时,必须请实验室专职人员或指导教师重新调整仪器。
比较,就可求得仪器的校正值。然后用同样的方法,测定待测液体样品的折射率。一般说来,校正值很小。若数值太大时,必须请实验室专职人员或指导教师重新调整仪器。
使用折光仪时要注意:不应使仪器曝晒于阳光下,要保护棱镜,不能在镜面上造成刻痕,在滴加液体样品时,滴管的末端切不可触及棱镜,避免使用对棱镜、金属保温套及其间的胶合剂有腐蚀或溶解作用的液体。
应引起注意的是,折射率有加合性。测得的折射率与某化合物的折射率等同,不能完全确定所测物就是该化合物,也可能是两种或两种以上物质的混合物,因为混合物的折射率也可以等于所测的值。
第二篇:乙酸丁酯的合成与精制
乙酸丁酯的合成与精制 1
化学实验报告
实验名称:乙酸丁酯的合成与精制
组员:
日期:
1
乙酸丁酯的合成与精制 2
乙酸丁酯的合成与精制
一.实验知识背景
1、简介
乙酸丁酯,又名乙酸-2-甲基丙脂,英文名isobutyl acetate,无色有果香气味的液体,分子式为C6H12O2,相对分子量111.16,沸点(101.3kPa)126.114℃,熔点-73.5℃,相对密度0.8807,折光率为1.3941,燃点为421℃,乙酸丁酯微溶于水,能与醇、醚等一般有机溶剂混溶,在酸或碱的作用下,水解生成乙酸和丁醇。

乙酸丁酯是一种重要的化工产品,也是重要的有机合成中间体,广泛用于有机合成、塑料、涂料等工业。它是化工、军工、医药等行业的主要溶剂,特别是清漆、人造革、塑料等物质的良好溶剂。此外,它还是制造油漆、飞机漆的主要原料,可用于香料、化妆品、食品添加剂、防腐防霉剂和药物的合成工业中。乙酸正丁酯具有广泛的应用价值和巨大的发展前景。随着经济的发展和人民生活水平的提高,对乙酸丁酯的需求量也越来越大。目前,工业上大多数采用浓硫酸催化酯化乙酸丁酯,但该法存在反应时间长、副反应多、后处理困难、产品损失大、设备腐蚀严重、存在安全隐患和三废污染严重等问题。因此,开发催化活性高和环保型的催化剂如固体酸催化剂代替浓硫酸势在必行。
4、传统实验原理
反应: CH3COOH + CH3CH2CH2CH2

3COOCH2CH2CH2CH3 + H2O
副反应:
2CHCHCHCH3222

3CH2CH2CH2OCH

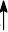
CH2CH2CH3 + H2O CHCHCHCH32223CH2CH=CH + H2O
为了促使反应向右进行,通常采用增加酸或醇的浓度或连续地移去产物(酯和水)的方式来达到的。在实验过程中二者兼用。至于是用过量的醇还是用过量的酸,取决于原料来源的难易和操作上是否方便等诸因素。提高温度可以加快反应速度。
2
乙酸丁酯的合成与精制 3
二.乙酸乙酯的合成方法文献探究
在合成乙酸乙酯过程中,有多种催化剂可以实现反应。传统上羧酸酯类的合成都是用浓硫酸作催化剂,但存在诸如设备易腐蚀、副反应多、废酸排放污染环境等弊端。因此人们不断寻求更优良的催化剂来代替硫酸。下面我们通过对前人用不同催化剂的进行反应取得的结果进行探讨。
(文献来源见尾页标注)
1. 采用活性炭负载四氯化锡做催化剂
采用活性炭负载四氯化锡做催化剂,用活性炭将四氯化锡分散,减少了四氯化锡的用量,提高了催化活牲,具有选择性好、后处理工艺简单、催化剂易回收等优点。但催化剂还要花时间制备。
2.采用等体积浸渍法:
负载型催化剂,并用于催化乙酸与正丁醇的酯化反应。考察了反应条件对乙酸转化率的影响。结果表明,适宜的反应条件为反应时间3h、原料醇酸比为4:1、催化剂用量为1.0g,乙酸的转化率为95%左右,乙酸正丁酯的选择性为100%,催化剂可重复使用。缺点温度太高,制备时间太长。
3、采用固载型12一磷钨杂多酸、六水合三氯化铁做催化剂
以浓硫酸、六水合三氯化铁、12一磷钨杂多酸、固载型12一磷钨杂多酸作催化剂分别催化制备乙酸正丁酯。通过实验探讨出各种催化剂催化合成的最佳工艺条件,并进行比较研究,结果表明:固载型12一磷钨杂多酸、六水合三氯化铁具有催化产率高、无污染、能重复使用等优点,具有良好的工业应用前景。
4、采用阳离子交换树脂催化
阳离子交换树脂的主要特点是价廉易得,不腐蚀设备,不污染环境,不会引起副反应,不溶于反应体系,能够重复使用,易于分离、回收和再生,操作简单,产品收率较高,具有工业推广价值。黎中良等人利用阳离子交换树脂作为催化剂合成乙酸正丁酯,最佳反应条件是:醇酸比为1.3:1.0,反应2h,阳离子交换树脂的用量为1.1g,产品的收率达到95.17% 。但存在催化剂制备过程复杂,易发生副反应等缺点。
5、固体超强酸催化合成乙酸正丁酯
自19xx年Hino M等首先合成了Ti02/ 一新型固体超强酸,并且介绍了其催化性能以来,TiO2/sO4。一在有机合成中不仅具有非常高的活性,而且不怕水、耐高温,反应条件比较容易控制,因此TiO2/SO4 一的使用越来越受到人们的重视。固体超强酸在有机合成中的优点是活性高、重复使用性好、不腐蚀设备、制备方法简便、处理条件易行、便于工业化,这对于节约能源,提高经济效益是很有意义的。古绪鹏等人利用SO4/ZrO2一Ti o2一La固体酸作为催化剂合成乙酸正丁酯,最佳反应条件是:在反应时间2h,醇酸摩尔比1/2 5,催化剂用量为反应物质量的17 9,6时,酯的产率高达97.6 9,6。实验发现,该催化剂使用后无需任何处理,可重复使用多次,是一种贮存稳定性高、选择性好、对环境友好的催化剂。
6、以固载杂多酸盐TiSiWl2O4o/rioz为催化剂合成了乙酸丁酯
探讨了反应时间、原料配比、催化剂用量等对乙酸丁酯产率的影响.实验结果表明,该催化剂对乙酸丁酯的合成具有良好的催化活性,在适宜的条件下,乙酸丁酯产率可达84.82%。
3
乙酸丁酯的合成与精制 4
7. 浓磷酸作催化剂:FloodD.T.用浓磷酸做催化剂,可获得较高的收率,但反应需要8h,时间较长[3].
8. 分子筛替代催化剂酯化:周迎春等提出了酯化的改,进用分子筛催化酯化反应,具有操作简单,酯的纯度高,后处理简单,催化剂可回收重复利用等特点,尤其是减少了酸性废液的排放,因而具有很大的实用意义,但由于其自制装置吸水管的规格与反应量对应,给操作上带来一定的限制。
9. 三氧化二钕作催化剂:此法在醇酸摩尔比为1:1.2,催化剂用量为醇重量的3%, 反应时间为2小时,转化率可达80. 4%,反应时间短,催化剂用量少。而且反应完毕分出催化剂,洗涤,干燥,回收可循环使用。操作简便, 腐蚀性远远小于硫酸。
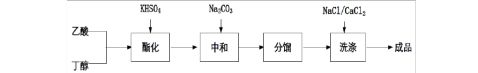
二、实验采用的合成与精制方案
经过一系列比较,综合原料的转化率、实验室做实验的可行性、经济成本等各方面的因素,最后决定本实验采用硫酸氢钾为催化剂合成乙酸丁酯。考察了催化剂用量、醇酸物质的量比、反应时间及催化剂重复使用次数等因素对收率的影响。结果表明该催化剂具有催化活性高,易分离回收,重复使用性良好,无废液排放等优势。最佳反应条件下,收率为82.7%。
1、实验目的
1) 学习和掌握醇与酸酯化反应的原理和实验方法。
2) 了解用水分器回流去水的操作。
3) 熟练液态有机物的分离、纯化的基本操作。
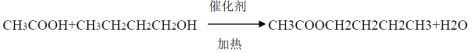
2、实验原理
乙酸乙酯主要是通过乙酸与正丁醇在催化剂作用下,加热可发生酯化反应,反应的合成路线如下:
3、反应条件
以硫酸氢钾为催化剂,对以乙酸和正丁醇为原料合成乙酸正乙酯的反应条件进行了研究,研究了酸醇摩尔比、催化剂用量、反应时间、回流温度等因素对酯化率的影响,优化反应条件如下:n(乙醇)∶n(乙酸)∶n(硫酸氢钾)=1∶1.4∶0.0074;反应时间45min;回流反应温度117 ̄124℃,酯化率可达86.5%。
4、仪器与试剂
仪器:圆底烧瓶(250ml)1个、分水器1支、球形冷凝管1
支 、直形冷凝管1支、蒸馏头1只、温度计1只、接收管1支、分液漏斗1支、 移 液管1支、滴定管(碱式)、锥形瓶、量筒(100ml)、 滤纸、铁架台、玻璃棒、酒精灯
设备:磁力搅拌加热套 1台、阿贝折射仪、天平
试剂:正丁醇、冰醋酸、硫酸氢钾、饱和碳酸钠溶液、无水硫酸镁、饱和氯化钙溶 液、 饱和氯化钠溶液、氢氧化钾无水乙醇溶液、沸石、棉花、pH 试纸。
5、实验流程及装置图
流程图
4
乙酸丁酯的合成与精制 5
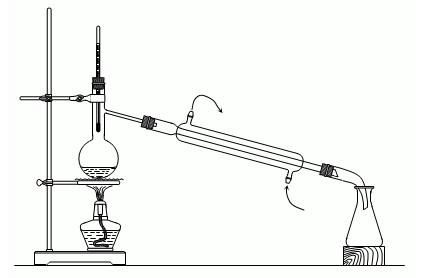
实验装置图

制备装置
蒸馏装置
实验步骤
1) 在250ml 的圆底烧瓶中加入63.0ml 正丁醇、 37.0ml 冰醋酸和2.4g 硫酸氢钾混合均匀后加入1-2 粒沸石。
2) 按试验装置图安装好仪器。
3) 在分水器中加入计量过的水,使水面稍低于分水器回流支管的下岩。打开冷凝水,反应瓶在磁力搅拌器上,小火加热回流。
4) 反应过程中,不断有水分出,并进入分水器的下部,通过分水器下部的开关将水分出,注意水层与油层的界面,不要将油层放掉。
5) 反应约50min后,此时停止加热冷却。
6) 过滤分离出催化剂,将分水器中液体倒入分液漏斗,分出水层。
7) 用40ml饱和碳酸钠溶液洗涤至中性,再依次用40ml饱和氯化钠溶液洗涤一次,饱和氯化钙溶液洗涤两次,分出酯层。
8) 将分离出来的上层油层倒入一干燥的小锥形瓶中,加入无水硫酸镁干燥,直至液 5
乙酸丁酯的合成与精制 6
体澄清。
9) 干燥后的液体,用少量棉花通过三角漏斗过滤至干燥的250ml蒸馏烧瓶中,加入沸石,安装蒸馏装置,磁力搅拌器加热,收集117-124℃的馏分。
10) 称量,计算产率,并测定产品的折光率。
实验结果分析
(1)通过测定反应前后混合液的酸值,计算酯化率。
(2)用阿贝折射仪测定所得产品的折射率,并与文献值相比较。
实验进度安排
第一天 上午: 联系老师,找好实验室,准备好实验器材 。
下午:做实验,得到数据。
第二天:分析实验过程和实验数据,撰写实验报告。
参考资料
1) 陈丹云,李杰,蔡永红. 乙酸丁酯的催化合成.化工中间体合成.2009.4:14-15
2) 虞大红,吴海霞主编.实验化学.(第二版),北京:化学工业出版社,20xx年5月:25-27
3) 谢川,鲁厚芳主编.工科化学实验.成都:四川大学出版社,20xx年10月:125-126
4) 白秀丽, 李晓莉.乙酸正丁酯的合成与应用.长春师范学院学报.2008(5) 13-14
5) 由宏君 ,乙酸正丁酯合成的研究进展 , 辽宁石油化工大学石油化工学院 , 维普资讯
6) 李常风1 杜黎明.磷酸二氢钠催化合成乙酸丁酯的研究. 首都师范大学学报(自然科学版).2005(12) 43-45
7) 蔡述兰,邹立科,郭小群. 硫酸镍催化合成乙酸丁酯. 四川理工学院学报(自然科学版).2008(2) 72-74
8)冯桂荣,耿静 , 乙酸正丁酯合成条件探讨 ,唐山师范学院 ,20xx年9月
9)何节玉 , 乙酸正丁酯合成实验的改进 湖南理工学院, 20xx年9月
6
-
乙酸正丁酯的制备
大学化学基础实验II实验报告课程名称有机化学实验实验名称乙酸正丁酯的制备与折光率的测定姓名张玉学号1108110191专业化学工程…
-
乙酸丁酯的合成与精制实验报告
化学工程学院本科生专业实验报告题目乙酸丁酯的合成及精制学生姓名##学号##实验组号2-12组员##指导教师##20##年11月2日…
-
实验十:乙酸正丁酯的制备报告模版
实验十乙酸正丁酯的制备一实验目的1学习羧酸与醇反应制备酯的原理和方法2学习利用恒沸去水以提高酯化反应收率的方法3学习使用分水器回流…
-
乙酸正丁酯的制备
贵州大学实验报告大学化学实验II实验报告物理化学实验学院化学与化工学院专业化学工程与工艺班级化工113120xx年月日2
-
乙酸正丁酯的制备
一实验目的1巩固酯化反应的原理2掌握共沸蒸馏分水法的原理和分水器油水分离器的使用二实验原理主反应CH3COOHCH3CH23OHC…
-
乙酸正丁酯的制备
大学化学基础实验II实验报告课程名称有机化学实验实验名称乙酸正丁酯的制备与折光率的测定姓名张玉学号1108110191专业化学工程…
-
乙酸丁酯的合成与精制实验报告
化学工程学院本科生专业实验报告题目乙酸丁酯的合成及精制学生姓名##学号##实验组号2-12组员##指导教师##20##年11月2日…
-
实验十:乙酸正丁酯的制备报告模版
实验十乙酸正丁酯的制备一实验目的1学习羧酸与醇反应制备酯的原理和方法2学习利用恒沸去水以提高酯化反应收率的方法3学习使用分水器回流…
-
乙酸正丁酯的制备
贵州大学实验报告大学化学实验II实验报告物理化学实验学院化学与化工学院专业化学工程与工艺班级化工113120xx年月日2
-
乙酸正丁酯的制备
乙酸正丁酯的制备实验报告班级工艺一班实验组号同组姓名实验时间撰写实验报告时间20xx年12月10日1实验目的1初步了解和掌握化工产…