河南省伊川县实验高中20xx届高三上学期第三次限时训练化学试卷

详细替换删除上移下移
1.下列离子方程式中,正确的是()
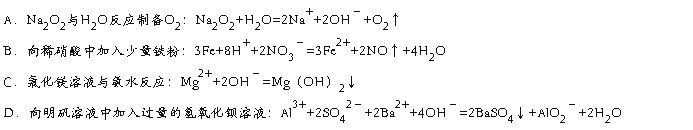
详细替换删除上移下移
2.下列各组离子在给定条件下能大量共存的是()
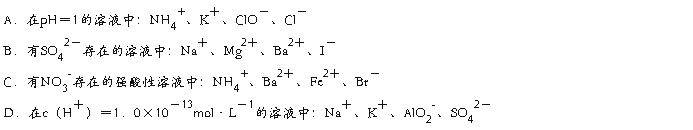
详细替换删除上移下移
3.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入一定量的稀盐酸。下列离子方程式与事实不相符的是()

详细替换删除上移下移
4.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是()
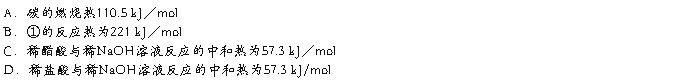
详细替换删除上移下移
5.下列有关性质的比较,不能用元素周期律解释的是()

详细替换删除上移下移
6.下列有关叙述:①非金属单质M能从N的盐溶液中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M形成的气态氢化物比N形成的气态氢化物稳定; ④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物对应水化物的酸性HmMOx>HnNOy;⑥熔点M>N。能说明非金属元素M比N的非金属性强的是()
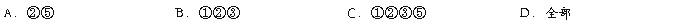
详细替换删除上移下移
7.X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是:()

详细替换删除上移下移
8.下列排列有错误的是()

详细替换删除上移下移
9.下列叙述中正确的是()

详细替换删除上移下移
10.四种短周期元素的相关信息如下表所示:()

下列说法正确的是()
A.原子半径:W>Z>Y>X
B.Y、Z两种元素只能形成化合物Z2Y
C.最低价气态氢化物的热稳定性:W>X
D.最高价氧化物对应水化物的酸性:X>W
详细替换删除上移下移
11.根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )

详细替换删除上移下移
12.X、Y、Z、R和W代表原子序数依次增大的5种短周期元素,X元素原子最外层电子数比次外层电子数多2,R与Y同主族,W元素族序数等于周期数的2倍。已知常温下:W氢化物(气态)+Z单质(气态)=Z氢化物(液态)+W单质(固态)。下列说法正确的是()

详细替换删除上移下移
13.X、Y、Z三种短周期元素,X元素的原子最外层只有一个电了,Y元素的原子M电子层的电子数为K、L上电子总数的一半,Z元素的原了L层电子数比Y原子L层电子数少2个,由这三种元素组成的化合物的化学式可能是()
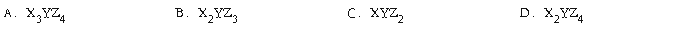
详细替换删除上移下移
14.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是()
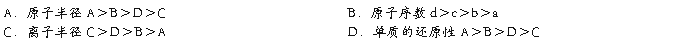
详细替换删除上移下移
15.为了测定酸碱反应的中和热,计算时至少需要的数据是()
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的质量;⑥前后温度的变化;⑦操作所需时间
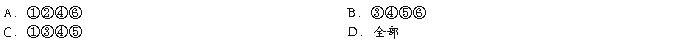
详细替换删除上移下移
16.下列反应中,属于氧化还原反应同时又是吸热反应的是()

详细替换删除上移下移
17.已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为()
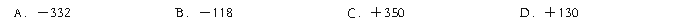
详细替换删除上移下移
18.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是()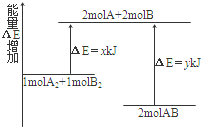
详细替换删除上移下移
19.强酸与强碱的稀溶液发生中和反应的热效应为: H+(aq)+OH-(aq)===H2O(l) ΔH =-57.3kJ·mol-1。分别向1 L 0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是()

详细替换删除上移下移
20.已知25℃时:①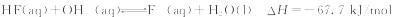
②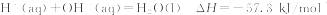 下列有关说法中正确的是()
下列有关说法中正确的是()

详细替换删除上移下移
21.已知:
(1)胆矾失水的热化学方程式为:CuSO 4 ·5H 2O(s)=CuSO 4 (s)+5H 2O(l) Δ H=+Q1 kJ/mol
(2)室温下,无水硫酸铜溶于水的热化学方程式为:CuSO 4 (s)=Cu 2+(aq)+SO 42-(aq) Δ H =-Q 2 kJ·mol-1
(3)胆矾(CuSO 4 ·5H 2 O)溶于水时溶液温度降低。则 Q1与 Q2的关系是( Q 1、Q2为正数) ()
详细替换删除上移下移
22.关于下图所示装置(盐桥含KCl)的叙述,正确的是()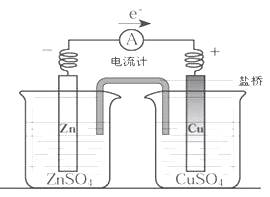

详细替换删除上移下移
23.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:()
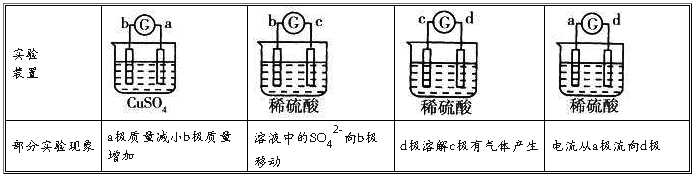
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c添加新题型设置详细替换删除上移下移
添加新题型设置
清空删除设置上移下移

详细替换删除上移下移
24.有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Y的原子结构示意图为 ,YW2的电子式为 。
(2)将X2、W2按下图所示通人某燃料电池中,其中,b电极的电极反应式为 。
若有16gW2参加反应,转移的电子是 NA。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为 。
第二篇:高二化学第一学期期终试卷(20xx)
20##学年第一学期上师大二附中期终考试
高二化学试卷
(总分:100分 答题时间:60分钟)
相对原子质量
Al-27 Fe-56 H-l C-12 Ba-137 O-16 Na-23 Mg-24 Cl-35.5 Cu-64 H-1
一、选择题
1.下列关于铁和铝的性质叙述错误的是
A.铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症
B.铝的导热性比铁强,因而用铝锅煮食物比铁锅好
C.铝能溶解于氢氧化钠溶液中,而铁不能与氢氧化钠溶液反应
D.补血剂中铁元素的化合价为+2价
2.铁属于:⑴重金属;⑵轻金属;⑶常见金属;⑷稀有金属;⑸黑色金属;⑹有色金属
(A)⑴⑵⑸ (B)⑵⑶⑸ (C)⑴⑶⑸ (D)⑴⑷⑹
3.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+ ,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
(A) 氧化性 (B)还原性 (C)碱性 (D) 酸性
4.从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是
(A)地壳中金属元素的含量 (B) 金属的延展性
(C)金属的导电性 (D) 金属冶炼的难易程度
5.两等质量的铝粉,分别与足量的稀硫酸和浓氢氧化钠反应,在相同状况放出气体体积
(A) 相等 (B) H2SO4放出的多
(C) 跟浓NaOH反应放出的多 (D) 只跟H2SO4反应放出气体
6.为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
(A)通入氯气 (B)加入稍过量的铁粉 (C)加入锌粒 (D)加入少量铜片
7.既能跟氢氧化钠溶液反应,又能跟盐酸反应,且生成不同气体的物质是
(A)Al2O3 (B)NH4HCO3 (C)Al (D)Al(OH)3
8.甲烷与水在低温高压下可生成甲烷水合物(固体),科学家已在深海中找到甲烷水合物,拟将其作为新型的能源进行开发。下面有关甲烷水合物的说法错误的是
A.采煤矿井中的甲烷气体是植物残体经微生物发酵而来的
B.天然气的主要成分是甲烷
C.甲烷是没有颜色、没有气味的气体,极易溶于水
D.甲烷和氯气发生取代反应所生成的产物四氯甲烷是一种灭火剂
9.甲烷和氯气在光照条件下发生的反应是
A.置换反应 B.化合反应 C.复分解反应 D.取代反应
10.下列物质中不是有机物的是
A.CH3COOH B.CH2Cl2 C.CaCO3 D.CH4
11.若甲烷与氯气以物质的量之比1∶2混合,在光照下得到的产物是
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有② C.①②③的混合物 D.①②③④的混合物
12.提出元素周期律并绘制了第一个元素周期表的科学家是
A.戴维 B.阿伏加德罗 C.门捷列夫 D.道尔顿
13.在周期表中金属和非金属的分界线附近能找到
A.制农药的元素 B.制催化剂的元素
C.做半导体的元素 D.制耐高温合金材料的元素
14.砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
A.HAt很稳定 B.砹易溶于某些有机溶剂 C.AgAt不溶于水 D.砹是有色固体
15.刻度“0”在上方的仪器是
A.温度计 B.量筒 C.滴定管 D.电子天平
16.按下列实验方法能达到要求的是
A、用电子天平称量25.28gNaCl B、用100ml量筒量取2.50ml稀盐酸
C、用滴定管量取11.40ml的溶液 D、用250ml容量瓶配制0.1mol/L 150mlNaCl溶液
17.下列关于中和滴定的操作中,错误的是
A、滴定时眼睛注视滴定管读数 B、要做两次实验,求其平均值
C、滴定时要不断振荡锥形瓶 D、滴定管用蒸馏水洗净后再用标准溶液润洗
18.下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;
③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A.⑥③①②⑤④ B.⑤①②⑥④③ C.⑤④③②①⑥ D.③①②④⑤⑥
19.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主、副族及族号取消,由左至右改为第1~18列,碱金属为第1列,稀有气体为第18列。据此规定,下列说法中不正确的是
A.第15列元素的最高价氧化物为R2O5 B.第2列元素中肯定没有非金属元素
C.第17列元素的第一种元素无含氧酸 D.第16、17列元素都是非金属元素
20.电子层数相同的三种元素X、Y、Z,已知最高价氧化物对应水化物的酸性HXO4>H2YO4>H3ZO4,则下列判断错误的是
A.非金属性X>Y>Z B.气态氢化物稳定性HX>H2Y>ZH3
C.原子半径X>Y>Z D.气态氢化物还原性HX<H2Y<ZH3
21.下列说法中,正确的是
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期序数等于原子核外电子层数
C.最外层电子数为8的粒子是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
22.下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是
A.a原子的最外层电子数比B原子的最外层电子数少
B.a原子电子层数比b原子的电子层数多
C.1mol a 从酸中置换H+生成的H2比1 mol b从酸中置换H+生成的H2多
D.常温时,a能从水中置换出氢,而b不能
23.某班学生在实验室分组实验测定胆矾晶体(CuSO4·nH2O)里结晶水的n值时,出现三种情况;①晶体中含有受热不分解的杂质;②晶体尚带蓝色,即停止加热;③晶体失去全部结晶水后,冷却时未放入干燥器中,其中能使实验结果n值偏低的是
A.①和② B.①和③ C.②和③ D.①②③
24.甲烷在空气中爆炸极限为5%~16%,爆炸最剧烈时空气中含甲烷体积分数是(空气中氧气占21%)
A.8.6% B.9.5% C.10.5% D.33.3%
25.在质量为Gg的坩埚中,加入BaCl2·nH2O晶体后称得质量为W1g,加热使结晶水全部失去,冷却后,称得质量为W2g。则n的值为
A、208(W1-W2)/18(W2-G) B、208(W2-W1)/18(W2-G)
C、18(W2-G)/208(W1-W2) D、208(W2-G)/18(W2-W1)
20##学年第一学期上师大二附中期终考试
高二化学答题卷
(总分:100分 答题时间:60分钟)
一、选择题

二、填空题
26.甲烷俗名叫_________,它的分子式为__________,电子式为___________,结构式为__________;甲烷分子是__________的立体结构;甲烷发生燃烧反应的化学方程式为_____________________________________。
27.用标准盐酸溶液滴定待测碱液时,一般用 作指示剂,滴定终点时,溶液由 色变为 色,且在半分钟内不变色;现用0.1586mol/l标准盐酸溶液滴定20.0ml氢氧化钠溶液,耗去18.65ml后达到滴定终点,此氢氧化钠溶液的物质的量浓度是 mol/L。
28.A、B、C均为短周期元素,A元素是地壳中含量最多的金属元素,其单质常用于制造日常生活中的炊具,但其离子对人体有害。B元素的单质常用于自来水消毒。C元素原子L层电子比K层电子多3个电子,它是植物生长必须的营养元素。试回答:
(1)A元素的名称为 ,其最高氧化物对应水化物与氢氧化钠溶液反应的化学方程式为______________________________________________
(2)B元素位于周期表中第____周期第____族,写出其单质与氯化亚铁溶液作用的离子方程式________________________ ___
(3)C元素单质分子的电子式为_____ , 其气态氢化物电子式为____________
29.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
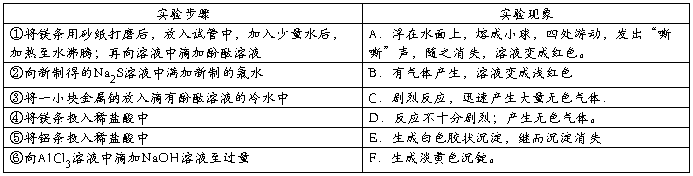
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)

① ,② ,
(4)实验结论: , 。
30.某学习小组用右图的实验装置测定标准状况下的气体摩尔体积(V m)。试回答以下问题:
(1)铝跟稀硫酸反应的化学方程式是 __。
(2)若用a g铝与足量的稀硫酸反应,产生的气体体积为V mL(已换算成标准状况),则标准状况下气体摩尔体积Vm =________________L/mol。
 (3)反应结束后,应先使量气管与水准瓶的
(3)反应结束后,应先使量气管与水准瓶的
____________________,才能对量气管读数。
(4)该小组测得标准状况下的Vm为23.1 L/mol,
可能的原因是_________(填序号)。
a.铝已部分氧化为氧化铝
b.反应放热,未冷却至温度不变就读数
c.铝中混有不与稀硫酸反应的杂质
三、计算题:
31.为了测定生铁(铁碳合金)样品中铁的质量分数,某实验小组取五份不同质量的生铁样品,分别与50.00mL同浓度的稀硫酸反应,下表是他们记录的实验数据,其中有两个数据不慎被试剂沾污了。
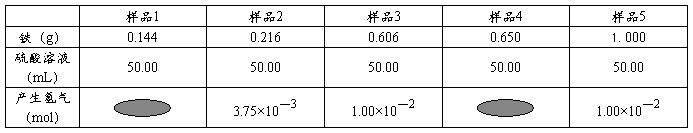
(1)上述测定中有关反应的化学方程式为 ;
(2)请你阅读表中数据,对这两个被沾污的数据作出估算后填写:
样品1产生氢气的物质的量为 mol;
样品4产生的氢气的物质的量为 mol;
(3)该稀硫酸物质的量浓度为 mol/L;
(4)该生铁样品中铁的质量分数为 %(精确到0.01)。
-
20xx届高三第一学期期中考试语文总结
20xx届高三第一学期期中考试语文学科总结灌云县第一中学高三年级卓洪飞转眼间三个月已经过去,学生新学期的兴奋感与喜悦感,以及种种不…
-
20xx~20xx学年度高三第一学期期中总结
20xx20xx学年北京市第十九中学高三学部第一学期期中总结一整体情况及各项成绩的数据分析一考试基本情况理科语文数学外语物理化学生…
-
高三第一学期期中成绩分析总结
高三2第一学期期中考试成绩分析及提高措施王端贵一班级的整体情况全班参加考试共58人其中300分以上3人290300分4人28029…
-
校长在高三期中考试总结及表彰大会上的讲话
校长在高三期中考试总结及表彰大会上的讲话各位老师、同学:大家上午好!今天我们举行高三年级期中总结及表彰大会,对上半学期的学习情况进…
-
高三上学期期中考试
本试卷34小题满分120分考试用时100分钟一选择题本题包括20小题每小题2分共40分每小题只有一个选项最符合题意1科学的研究方法…
-
收费班长工作总结
工作总结不知不觉,又一个月过去了,我的收费工作还在紧张而有序的进行着。总体来说,感觉不错,从最开始的不适应到慢慢适应,到现在的习惯…
-
20xx程序员年终总结
20xx年工作总结去年差不多这个时候,我还是一名学生,看着同学们相继找到工作,表面不急,心里对工作多多少少都有点急切和盼望。投简历…
-
自律部工作体验活动总结
“自律部工作体验”活动总结活动名称:“自律部工作体验”活动时间:20xx年x月x日活动范围:药学与生物科学学院全体在院学生主办单位…
-
市粮食局20xx年工作总结及20xx年工作安排
市粮食局20xx年工作总结及20xx年工作安排一、20xx年工作总结1、实施品牌战略,继续推进盘锦大米精品工程建设今年以来,我们以…
-
中药鉴定学来源总结
中药鉴定学——来源总结一、植物类药材(一)菌类(4种)麦角菌科(1种):虫草(为冬虫夏草寄生在蝙蝠蛾科昆虫幼虫上的子座及幼虫尸体复…