分析化学实验报告8. Cyt.C-20xx-1126
实验七 细胞色素c的制备及其测定
[目的和要求]
掌握细Cyt. c的制备原理及含量测定方法。
[实验原理]
细胞色素是多种能够传递电子的含铁蛋白质总称。它广泛存在于各种动物、植物组织和微生物中。
1). 作用:Cyt. c是呼吸链中极重要的电子传递体。它主要存在于线粒体中,在需氧较多的组织如心肌及酵母细胞中,Cyt. c含量丰富。
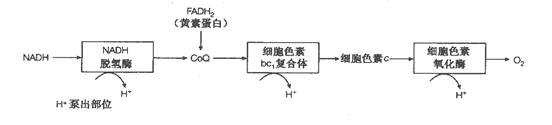
2). 结构:
Cyt. c为含铁卟啉的结合蛋白质,相对分子质量约为12 000~13 000 Dr.,蛋白质部分由约104个氨基酸残基组成, 等电点pI为
10.4左右。
Cyt. c易溶于水和酸性溶液,故可从酸性水中提取。
Cyt. c可分为氧化型(深红色)和还原型(桃红色)两种。
细胞色素C对热、酸和碱都比较稳定,但三氯乙酸可使之变性失活。
3). 光吸收特性:氧化型Cyt. c的最大吸收峰:480nm, 530nm。
还原型Cyt. c的最大吸收峰:415nm, 520nm, 550nm。
4). 制备原理:本实验以新鲜猪心为原料,经酸溶液抽提,人造沸石吸附,硫酸铵溶液洗脱和三氯乙酸沉淀,得到Cyt.c粗制品,经分光光度法测定其含量。
工艺原理:


[实验器材]
捣碎机,离心机,磁力搅拌器,可见分光光度计,玻璃层析柱,透析袋,玻璃器皿。
[实验材料及试剂]
(1) 新鲜的猪心。
 (2) 人造沸石( )过60—80目筛。
(2) 人造沸石( )过60—80目筛。
(3) 0.2%NaCl溶液,25%(NH4)S04溶液,12%BaCl2溶液,20%三氯乙酸(TCA)溶液,连二亚硫酸钠等。
(4) Cyt.c标准液浓度:3 mg/mL。
[实验步骤]
1.提取
称取新鲜猪心71g,加25mL水,除尽脂肪、血管和韧带,切成小块,放入捣碎机捣碎。
① 称取心肌肉糜100g,加水150mL,置l 000 mL烧杯中,加入2M H2SO4,调pH至4.0 (呈暗紫色),室温用磁力搅拌器提取1h。
② 用2 M NH4OH调pH至6.0,3000rp, 离心15’。
③ 收集红色上清液调pH至7.5, 置4℃冰箱储存。(第一次实验毕)。
2.吸附及洗脱
④ 若4℃冰箱储存液有沉淀用纱布过滤,收集红色滤液。
⑤称取人造沸石15g 于150mL烧杯内,加入150ml蒸馏水,用浓硫酸(约15滴)调pH至中性。倒去上层混浊液,加入蒸馏水轻轻搅拌,再用2mol/L硫酸细调pH=7.0~7.5。
倒入Cyt.c粗提液,磁力器搅拌经人造沸石柱吸附40'~1h,随着Cyt.c被吸附,人造沸石逐渐由白色变为红色。
⑥吸附完毕,将红色人造沸石转至100mL烧杯中,先用蒸馏水洗涤至水清(约4次),然后用60 mL 0.2%NaCl溶液分两次洗涤,再用蒸馏水洗涤至水清。
⑦将人造沸石装柱(1.6 X 20cm)。连接恒流泵(流速控制在3mL/min),25%(NH4)S04溶液洗脱(流速控制在2mL/min, 液量少于50mL)。收集红色洗脱液(洗脱液一旦变白,立即停止收集),洗脱完毕,人造沸石可再生使用。(第二次实验毕)。
3.盐析及浓缩
在上述洗脱液中按20% 慢慢添加入固体硫酸铵[(NH4)2SO4],边加边搅拌,使硫酸铵溶液质量浓度为45%(约相当于67%的饱和度),静置30min, 3000rp,离心15’,杂蛋白沉淀析出收集红色上清液。
在搅拌下,按每100 mLCyt.c滤液:4 mL TCA(20%三氯乙酸)比例,沉淀Cyt.c,并立即3000 rp, 离心15 min,倾去上清液。
收集沉淀,加2.5mL蒸馏水,使沉淀溶解,装入透析袋,于500 mL烧杯中,在磁力器搅拌下用蒸馏水透析,5min换水一次,换水3~4次后,检查SO4-是否被除净(方法:取2 mL透析外液,滴加2~3滴乙酸钡,若出现白色沉淀, 表示SO4- 存在;若无沉淀出现,表示透析完全)。量取并记录透析后Cyt.c的体积。
4.Cyt.c含量的测定
取透析后Cyt.c 0.5mL,加3.5mL水进行比色。因本法制备的Cyt.c是氧化型和还原型的混合物,测定含量时要加入少许连二亚硫酸钠,使混合物中的氧化型Cyt.c变为还原型。
还原型Cyt.c水溶液在波长520 nm 处有最大光吸收。
根据这一特性,绘出Cyt.c浓度和相应的吸光度的标准曲线,然后根据所测溶液的吸光度,由标准曲线求出所测样品的含量。
[结果计算]
1.标准曲线的制作:数据如下表所示:
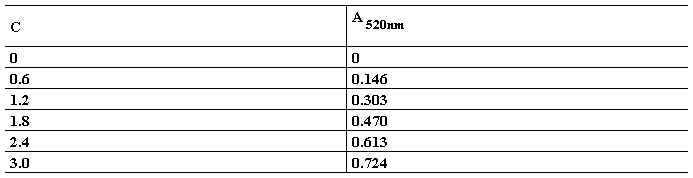
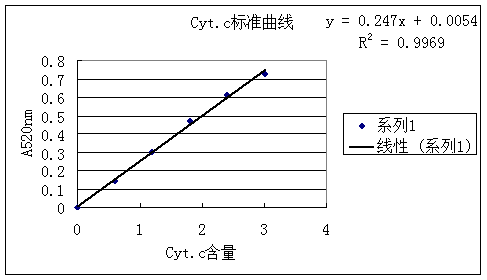
标准曲线公式:y = 0.247 x + 0.0054
∴ x = (y -0.0054)/0.247
2. Cyt.c的含量的计算:


[注意事项]
1.尽量除尽猪心非心肌组织,脂肪、血管、韧带和积血。
2.提取、中和步骤要注意调节pH。洗脱步骤应严格掌握流速。
3. 盐析时,加入固体硫酸铵,要边加边搅拌,不要一次快速加入。
4.逐滴加入三氯乙酸溶液,搅匀,加完后,尽快离心。
5.注意透析袋要求不漏。
[思考题]: 试以细胞色素C的制备为例,总结蛋白质制备的步骤和方法。
第二篇:分析化学实验报告样本
实验名称 游标卡尺的使用
实验目的:1 掌握游标卡尺的使用方法
2 了解游标卡尺的结构原理
3 学习数据处理的相关内容
4 养成良好的写实验报告的习惯
5 测量物体的长度
实验器材:1 游标卡尺 (精确度0.02mm)
2 被测物-五页书的厚度
实验原理:1. 如果将游标尺的9mm等分为10份,则每一份的长度为0.9mm.它与主尺的每一格相差0.1mm。如果将主尺的零刻度线与游标尺的零刻度线对齐的话,则二者之间所放置物体的长度如果为0.1mm的话,则游标尺上记为1的那条线就与主尺上的一条线对齐了。于时,此时,所夹物体的小数部分就应当是0.1毫米。如果所夹物体为0.2毫米的话,则游标尺上记为2的那条线就与主尺上的某一条线对齐。而如果相差n个0.1的话,则游标尺上记为n的那条线就与主尺上的线对齐了。可见,测量时,小数部分只要看游标尺的哪条线与主尺上的线对齐就可以知道是多少了。
而如果要测量一个物体的长度,只要将这个物体夹在主尺和游标尺之间,整毫米数由游标尺上零线对应的主尺的读数读数,而不数部分由游标尺上读出然后相加即为所测物体的长度。这样的游标卡尺精确度为0.1毫米。
2.如果将游标尺的19mm等分为20格,则游标尺上的每一格和主尺上的一格相差0.05毫米。于时,当将被测物夹在主尺和游标尺间时,如果游标尺标号为1的线与主尺对齐,则所夹物体的长度小数部分就是0.05毫米。此时在游标尺的第一条线标上5,第二条线标上10第三条线标上15,则今后读数时更方便了。
这种游标卡尺的精确度为0.05毫米。 3。如果将游标尺的49毫米等分为50格,则这种游标卡尺的精确度为0.02毫米,相应标数的时候第一条线标上2,第二条标上4第三条标上6.。。。。。。这样以后用的时候也就更方便了。
实验过程:实验时严格按照以下步骤进行。
1.首先观察游标卡尺的精确度和型 号以及生产厂家。
2.将固定螺钉松开,滑动游标尺,看游标尺是否能能在主尺上灵活地滑动。如果已经卡死,则此游标卡尺不可用。
3.将两只测脚并拢,观察主尺的零线和游标尺的零线是否对齐。如果没有对齐,则要记录下此数值(修正值),以便在最后的测量结果中加或减去此修正值。
4.将被测物卡在两测量脚之间进行测量。(注意读数前一定要将固定螺钉拧紧再读数)
5.记录测量的结果入下表。

6.数据处理: 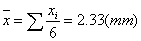

据格罗布斯判据只有在
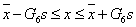
范围内的测量值才可用。所以所测数据均可用。
测量中的不确定度的计算:偶然误差引起的不确定度
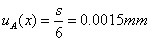
系统误差引起的不确定度
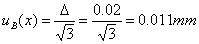
所以总不确定度为:
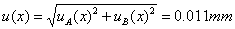
测量结果: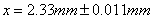
实验心得:(如实写出实验心得)
-
分析化学实验报告
分析化学实验报告20xx0218200858分类理工类标签字号大中小订阅盐酸和氢氧化钠标准溶液的配制和标定时间12月15号指导老师…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验报告
级名分析化学实验报吉林农业大学告班姓同组人实验酸碱标准溶液的配制和比较滴定实验目的实验原理实验步骤1酸碱标准溶液的配制101mol…
-
分析化学实验报告本模版
分析化学实验报告实验一电子分析天平的操作及称量练习学院专业班级姓名学号实验日期年月日教师评定实验目的掌握电子分析天平的基本操作和粉…
-
分析化学实验报告
HarbinEngineeringUniversityHarbinEngineeringUniversity实验题目姓名班级学号同…
-
分析化学实验报告七
硫酸铜中铜含量的测定摘要:利用间接碘量法测定铜离子的含量。旨在掌握硫代硫酸钠溶液的配制和保存,并掌标定握硫代硫酸钠溶液浓度的原理和…
-
分析化学实验报告
四川农业大学实验报告课程名称:分析化学实验实验名称:班级学号学生姓名指导教师硫酸铜中铜含量的测定作者:李豪杨蕊摘要:利用间接碘量法…
-
分析化学实验报告3. CAT-20xx-0924-ST
血红蛋白过氧化物酶特性的测定一.目的了解血红蛋白的特殊性质,学习利用时间扫描法测定酶活力的方法,并加深理解过氧化物酶的催化作用。二…
-
《分析化学实验》总结
定量分析是一门实验性课程,通过分析化学实验可以是我们对分析学化学基本理论进一步加深理解,并能够熟练地掌握定量分析的基本操作技能,为…
-
分析化学实验心得
分析化学实验心得体会分析化学是人们获得物质化学组成和结构信息的科学,它所要解决的问题是物质中含有哪些组分,各个组分的含量多少,以及…