【设计性实验报告】由苯胺为起始原料合成对溴苯胺
由苯胺为起始原料合成对溴苯胺
摘要:对溴苯胺是非常重要的有机化工原料,其一般合成路线是由苯为原料,经要经历硝化、还原、保护、溴代、去保护等多个步骤合成最终产物。而本实验是从这个合成路线的中间步骤开始,以中间体苯胺为原料进行合成保护、溴代、去保护三个步骤进行合成对溴苯胺。
关键词:对溴苯胺;合成;苯胺
Synthesized from aniline as starting materials Bromoaniline
Abstract: Bromoaniline is very important organic chemical raw materials, the general synthetic route is from benzene as raw material to undergo nitration, reduction, protection, bromination, and many other steps to protect the final product synthesis. The present study is an intermediate step in the synthetic route begins with aniline as raw materials for synthetic intermediates protection, bromo, to protect three steps synthesis Bromoaniline.
Keyword:aniline;para-bromoaniline;synthesis
1 引言
对溴苯胺是一种重要的染料原料,如偶氮染料、哇琳染料等,它也是有机合成和医药合成的重要中间体。对溴苯胺的相对分子质量为172.03,熔点为66.4℃,有毒(LD50mg/kg),其毒性较抓苯胺更强,可经过皮肤吸收,具有溶血性,能引起膀脱癌。[1]
本实验以中间体苯胺为原料进行合成保护、溴代、去保护三个步骤进行合成对溴苯胺。
2 实验部分
2.1 实验原理
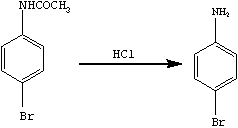
苯胺很容易进行酰基化反应,即氨基的氢原子被酰基取代,这样可以保护芳胺的氨基。卤素在苯环上的取代反应属于亲电取代反应,苯环上如有取代基,则按取代基的亲电取代定位规则进行反应。对溴乙酰苯胺在酸性条件下去保护生成目标产物。
其反应步骤如下:

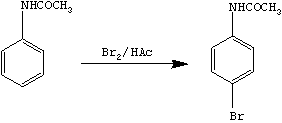
2.2 实验仪器及药品
锥形瓶;圆底烧瓶;回流冷凝管;水蒸气蒸馏装置;刺形分馏柱;直形冷凝管;温度计;抽滤瓶;布氏漏斗;电动搅拌器;250ml三口烧瓶;恒压滴液漏斗。
苯胺,冰醋酸,锌粉,活性炭,溴,乙醇,亚硫酸氢钠,浓盐酸,20%氢氧化钠溶液。
2.3 中间体乙酰苯胺的制备
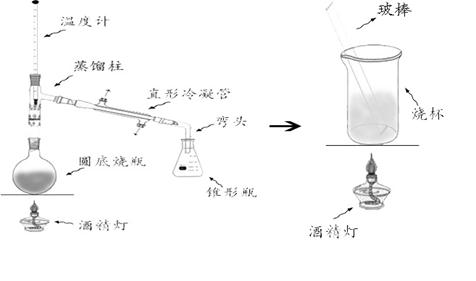
在50ml 圆底烧瓶中10ml新蒸馏过的苯胺、12ml 冰醋酸及少许锌粉(约0.1g),装上一分馏柱,插上温度计,用小量筒收集蒸出的水和乙酸(图1)。
将圆底烧瓶在石棉网上用小火加热回流,保持温度计读数于105℃约1h,反应生成的水及少量醋酸被蒸出,当温度下降则表明反应已经完成。(图1)
在搅拌下趁热将反应物倒入盛有100ml 冷水的烧杯中(图2),冷却后抽滤,用冷水洗涤粗产品。
将粗产品移至500ml 烧杯中,加入100ml 水,置烧杯于石棉网上,加热使粗产品溶解,稍冷后,乙酰苯胺结晶析出,抽滤。晾干后称量,计算产率。


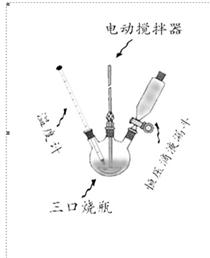
2.4 中间体对溴乙酰苯胺的合成
在250ml 三口烧瓶上配置电动搅拌器、温度计和恒压滴液漏斗,并在恒压滴液漏斗上连接气体吸收装置(图3),以吸收反应中产生的溴化氢。在100ml 锥形瓶中,将上一步的产物乙酰苯胺溶解于20.0ml 乙醇中,将2.0g 溴溶解于4.2ml 冰醋酸中,一边搅拌一边慢慢地将溴-冰醋酸溶液滴加至乙酰苯胺的醇溶液中,滴加速度以棕红色的溴色较快褪去为宜。滴加完毕,在45℃浴温下,继续搅拌反应1h,然后将浴温提高至60℃,再搅拌一段时间,直到反应混合物液面不再有红棕色蒸气溢出为止。在搅拌下将反应物慢慢加至100ml 冷水中,此时即有固体析出。若有黄色,可加入饱和的亚硫酸氢钠水溶液洗涤,使溶液黄色恰好褪去。减压过滤收集产物,并用冷水充分洗涤,干燥,用乙醇重结晶,得到白色针状晶体。

2.5 目标产物对溴苯胺的合成与测定
在100ml 三口烧瓶上,配置回流冷凝管和恒压滴液漏斗(图4),向三口烧瓶中加入上一步骤产物对溴乙酰苯胺、18ml95%乙醇和三粒沸石,加热至沸,自滴液漏斗慢慢滴加8.5ml 浓盐酸。加毕,回流30min,加入25ml 水使反应混合物稀释。将回流装置改为蒸馏装置,加热蒸馏。将残余物对溴苯胺盐酸盐倒入盛有50ml冰水的烧杯中,在搅拌下滴加20%氢氧化钠溶液,使之刚好呈碱性。抽滤,水洗,抽干后,用乙醇-水重结晶,自然晾干。用b形管测定产物的熔点,检验纯度。


2.6 对溴苯胺熔点的测定
用数字显微熔点仪对目标产物的熔点进行测定,以检验其纯度。
3 实验结果
表1产品的产量数据
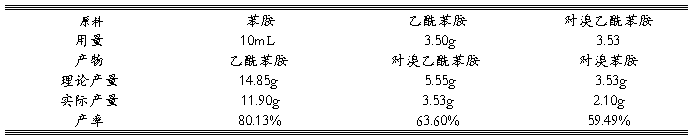
表2产品的熔点数据

4 实验讨论
4.1 由于各种因素所致,本次实验过程中并无将上一步实验所得的所有产物全部作为下一步的反应物,故无法计算总产率。
4.2 实验2.3“中间体乙酰苯胺的制备”中的产率达到80%以上,比较理想,而2.4“中间体对溴乙酰苯胺制备”以及2.5“对溴苯胺制备”的产量偏低,大概在60%左右,其原因如下:
4.2.1 用苯胺制备乙酰苯胺时,温度控制的不好,若是温度过高,则会使大量的乙酸蒸出而降低产率。若温度过低,则不能将生成的水及时蒸出,使反应向逆反应方向进行,同样会影响产率。所以反应温度应该控制在105℃,该温度为醋酸与水的混合物的共沸点。
4.2.2 用苯胺和冰醋酸制备乙酰苯胺时,反应速率较慢而且反应是可逆的,所以应该在分馏的同时把生成物水尽快蒸出,以使反应正移。
4.2.3 利用乙酰苯胺制备中间体对溴乙酰苯胺时,滴加溴的速度太快,导致反应会太剧烈,一部分溴来不及参与反应就与溴化氢一起逸出,导致产率降低,也有可能会产生二溴代物。
4.2.4 用对溴乙酰苯胺制备目标产物乙酰苯胺时,对粗产品进行重结晶时使用了过多的乙醇-水,导致产物会损失较多。
4.2.5 用对溴乙酰苯胺制备目标产物乙酰苯胺时反应温度较高,导致对溴苯胺再次被氧化而造成目标产物的损失,影响产率。
4.2.6 用对溴乙酰苯胺制备目标产物乙酰苯胺时,滴加浓盐酸太快。浓盐酸的挥发性很大,导致反应物的量减少,反应不完全。
4.2.7 本实验只用了一天左右来完成,反应时间不足导致反应产率下降。
4.3 经熔点测定后,发现目标表产物熔点平均在64.3℃-66.3℃,基本符合文献数据,三次测定的溶程均为2℃,故可以初步确定目标产物即为对溴苯胺,且纯度较高。
4.4 乙酰苯胺是由苯胺和乙酸在加热条件下反应而成的。
4.4.1 加入锌的目的:锌可以防止苯胺被氧化,并可使少许已被氧化的苯胺(棕黄色)还原成苯胺(白色),但是,加入太多锌的话,会出现不溶于水的氢氧化锌,影响提纯。
4.4.2 把水从反应物中分馏出去的目的:因为乙酸易溶于水,除去水能使乙酸释放出来,从而使反应向右移动,这也是本实验要保持105℃反应一个小时的原因。为了达到即要将水份除去,又不使醋酸损失太多的目的,必需控制柱顶温度在105ºC左右。
4.4.3 采用分馏的目的:乙酸沸点118℃,水沸点100℃,二者相差较小,若采用简单的蒸馏是无法分离这两者的,故需要进行分馏。
4.5 乙酰苯胺的醇溶液与溴-冰醋酸在搅拌下反应,生成邻对位的一溴代物和溴化氢气体。由于邻位位阻大,因此产物以对溴乙酰苯胺为主。在将溴滴加到乙酰苯胺里面时,滴加速度不能过快,否则反应太过剧烈,会导致一部分溴来不及参与反应就与溴化氢一起逸出,用时也可能会产生二溴代产物。乙酰苯胺是活性居中的芳香族化合物,为了加快反应的进行,本实验将反应温度提高到45℃,后又升到60℃使反应进行完全。将反应物倒入水中,产生了偏黄色的的固体,这是由于固体里含有溴单质,此时用亚硫酸氢钠洗涤固体可除去溴。
4.6 用对溴乙酰苯胺在酸性条件下去保护生成目标产物对溴苯胺时,在用滴液漏斗滴加浓盐酸时,应该缓慢滴加。否则会使反应太过剧烈而导致部分浓盐酸挥发,反应不充分。最后在加20%的氢氧化钠时,溶液如果刚好呈碱性但还只是浑浊而已的话,应该继续滴加,直至溶液出现明显沉淀为止。否则在抽滤时会流失过多的产物。
5 实验心得
经过将近一年的有机实验的学习,我觉得我最大的收获就是能够从动手实践过程中去理解有机化学。在高中时期,我们学习化学的方法基本都是强调理论而忽视实验,而由于当时所在学校的条件限制,我们不能经常去做化学实验,所以最终的结果就是我们能够熟悉什么苯,苯酚等物质的性质,理论上知道怎么去辨别它们,但实际把它们摆在我们面前要我们动手去鉴别时,我们却难以下手。而到了大学之后,通过各种实验课程,让我有机会去做各种实验,让我能更深刻的理解有机化学。化学是一门以实验为基础的学科,所以实验在化学的地位极为重要,学好实验才是学好化学的根本。
而在有机化学实验的过程中,老师经常强调要学会思考,这不但让我学会如何去处理实验过程中遇到的问题,在平时处事过程中,在做事之前或者遇到困难时也会积极去思考,对我帮助很大。
6 参考文献
[1]百度百科.对溴苯胺[DB/OL]. [20##-5-29].http://baike.baidu.com/view/441956.htm
[2]杨定乔. 基础化学实验有机化学实验[M]. 北京:化学工业出版社.2010:162-169
[3] 唐敏. 绿色条件下三溴吡啶催化有机反应的研究[D]. 江西师范大学化学化工学院. 2009:1
[4] Veerababurao, K.; Sarala, Naik.; Bhisma K. P. A New Recyclable Ditribromide Reagent for Efficient Bromination under Solvent Free Condition [J]. J. Org. Chem.20##, 70, 4267–4271
[5] Upasana, B.; Gopal, B.; Mihir, K. C. Regioselective Bromination of Organic Substrates by Tetrabutylammonium Bromide Promoted by V2O5?H2O2: An Environmentally Favorable Synthetic Protocol [J]. Org. Lett.20##, 2, 247–249
[6] 陈中俊, 周克瑜. 四丁基三溴化铵在有机合成中的应用[J]. 大学化学. 1995, 10, 10–12, 15
第二篇:实验资料
目 录(◆为必做实验 ※为选做实验 )
第一部分 有机化学实验的一般知识????? 1 一、有机化学实验室规则??????????1 二、有机化学实验室的安全知识???????1 三、常用玻璃仪器简介???????????3 四、其他常用仪器设备简介?????????15 实验二十 苯乙酮的制备?????????91 实验二十一 4-氯苯氧乙酸的制备?????93 实验二十二 乙酸异戊酯的制备??????95 实验二十三 己二酸的制备????????97 ◆实验二十四 乙酰苯胺的制备??????99 五、实验预习和实验报告??????????19 第二部分 基本操作???????????? 21 液态有机物的分离和提纯??????????21 ◆实验一 蒸馏?????????????? 21 实验二 分馏??????????????? 25 ※实验三 水蒸气蒸馏??????????? 28 实验四 减压蒸馏????????????? 32 固态有机物的分离和提纯??????????36 ◆实验五 重结晶及过滤?????????? 36 实验六 升华??????????????? 41 实验七 萃取??????????????? 43 ◆实验八 熔点的测定??????????? 47 ◆实验九 沸点的测定??????????? 51 色谱法??????????????????53 ※实验十 柱色谱分离植物色素??????? 54 ※实验十一 纸色谱法鉴定氨基酸?????? 57 ◆实验十二 薄层色谱法分离偶氮染料???? 59 ※实验十三 气相色谱法分析苯与甲苯???? 61 ※实验十四 反相离子对高效液相色谱仪定
性分析硝基酚类化合物???????????65 ※实验十五 紫外-可见光谱和红外光谱????66 ◆实验十六 阿贝折射仪测定乙醇的纯度??? 73 ◆实验十七 旋光度的测定????????? 76 第三部分 有机化合物的制备???????? 79 ◆实验十八 1-溴丁烷的制备???????? 79 ◆实验十九 乙酸乙酯的制备???????? 82
※实验四十一 氨基酸、蛋白质的性质????151 第六部分 ◆ 有机化合物官能团的鉴定? 第七部分 ※ 微型与小型实验简介???? 第八部分 附录??????????????
◆※实验二十五 苯甲酸的制备??????99 ※实验二十六 乙酰水杨酸的制备?????99 第四部分 天然有机化合物的提取????? ◆实验二十七 茶叶中咖啡因的提取及其
性质????????????????? 101 实验二十八 烟草中烟碱的提取和烟碱
的性质???????????????? 105 ※实验二十九 油料作物中粗脂肪的提取
和油脂的性质????????????? 109 实验三十 从胆汁中提取胆红素??????110 实验三十一 从槐花米中提取芦丁?????110 实验三十二 从果皮中提取果胶??????113 第五部分 有机化合物的基本性质?????116 实验三十三 元素的定性分析???????118 ※实验三十四 烃的性质?????????121 ※实验三十五 卤代烃的性质???????124 ※实验三十六 醇、酚的性质???????127 ※实验三十七 醛、酮的性质???????130 ※实验三十八 羧酸及其衍生物的性质???134 ※实验三十九 胺和酰胺的性质??????138 ※实验四十 糖类性质??????????144
九、常见的共沸混合物?????????158 十、常见发色团的特征吸收峰??????158 十一、红外光谱中的一些特征吸收频率
???????????????????159
一、 常见元素的相对原子质量表???????
二、试剂的配制??????????????151
三、乙醇溶液的相对密度及浓度组成表
?????????????????????154
四、常用酸、碱溶液的相对密度和浓度
?????????????????????154
五、常用酸、碱溶液的配制?????????156
六、常用洗涤剂的配制???????????156
七、指示剂的配制?????????????157
八、常用试纸的制备????????????157 十二、常用有机溶剂的物理常数?????160 十三、关于有毒化学药品的知识?????161 十四、有机物质的干燥剂????????165 十五、部分实验术语英文检索??????166 主要参考文献?????????????168
有机化学实验 使用设备名称
1. 常用普通玻璃仪器
2. 常用标准磨口玻璃仪器
3. 国产微型化学制备仪器
4. 天津产T32型半微量制备仪
5. 色谱柱、研钵、粗颈漏斗、滴液漏斗、色谱缸
6. 索氏提取器
7. 吹风机、喷雾器
8. 气流烘干器
9. 电动搅拌器
10. 旋转蒸发器
11. 电子天平
12. 电磁搅拌器
13. SHB-III型循环水多用真空泵
14. 压力计
15. 减压蒸馏装置
16. 水泵
17. 抽滤装置
18. b形熔点测定管
19. X-型显微熔点仪
20数字熔点仪
21阿贝折射仪
22旋光仪
※23GC-14A气相色谱仪
※24高效液相色谱仪
※25紫外-可见光光度计
※26双光束红外分光光度计
打※者为选用仪器
有机实验报告评分标准
一.对报告的要求:
1.字迹清楚、整洁、无涂改、乱画现象。
2.符合实验报告的基本格式,要具备以下内容:
(1) 实验目的
(2) 实验原理,实验装置图。
(3) 操作步骤
(4) 数据纪录、处理。
(5) 问题讨论。
二.实验报告工分五个评分标准即优、良、中、一般、差。 优:符合1、2原理,步骤基本清楚,有结果,回答问题准确。
中:符合1、2原理,但目的、原理、步骤不甚清楚,回答问题基本正确。
差:不符合1、2原理,目的、原理、步骤缺一至二项,或不清楚,
有机化学实验基本技能测试标准
一.蒸馏
基本要求:熟练安装普通蒸馏装置。
测试标准:安装顺序“自下而上,由左到右“温度计水银位置正确,能说出各个部件名称,知道加沸石和冷凝水方向。
测试方法:蒸馏实际操作或沸点测定。
成绩评定:根据学生操作情况,依据测试标准给分。
二.测熔点
基本要求:能够熟练运用毛细管方法测熔点。
测试标准:b形管内溶液用量略高于上侧管,毛细管封口、装样、看温度操作正确:熔点管及温度计固定位置符合要求。
测试方法:熔点测定实际操作
成绩评定:根据学生操作情况,依据测试标准给分。
三.重结晶苯甲酸
基本要求:装一套热过滤装置,重结晶操作正确。
测试标准:会折叠菊花形滤纸。
测试方法:热过滤实际操作或结合仪器叙述实验步骤。
成绩评定:根据学生操作或叙述,依据测试标准给分。
四.抽滤
基本要求:装一套抽滤装置,熟知仪器名称和各部分作用。
测试标准:正确说出抽滤的优点,所用滤纸大小,仪器名称和各自的作用;会用真空泵,抽滤操作熟练。 测试方法:抽滤实际操作或结合仪器叙述实验方法。
成绩评定:根据学生操作或叙述,依据测试标准给分。
五.色普法分离
基本要求:掌握利用薄层色谱分离偶氮料的方法。
测试标准:熟练制备薄层板,点样位置大、小适中,操作正确,展开剂爬升前沿定位准确,吹干快速;Rf值计算正确。
测试方法:学生实际操作或结合仪器叙述实验方法。
成绩评定:依据测试标准逐项给分。
六.萃取
基本要求:能够熟练正确使用分液漏斗。
测试标准:活塞涂凡士林的方法正确,分液漏斗的震荡方法正确并能开启活塞排气;在铁架台铁环上静置分层;知道上、下是何物;能够做到下层液放出、上层液倒出。
测试方法:实验操作或结合仪器叙述实验操作方法。
成绩评定:根据学生操作情况,依据测试标准给分。
七.乙酸乙酯制备
基本要求:能够熟练正确安装乙酸乙酯制备装置
测试标准:安装仪器规范,熟知各个部件名称;知道为什么要使乙醇过量;能正确叙述精制时加饱和碳酸钠、饱和食盐水、饱和氯化钙、无水硫酸镁的作用。
测试方法:学生实际操作或安装完仪器叙述实验操作方法。
成绩评定:根据学生操作情况,依据测试标准给分。
八.乙酰苯胺制备
基本要求:能够熟练正确安装制备乙酰苯胺的装置
测试标准:安装制备仪器规范,熟知各个部件名称;能说出采取什么方法可提高产率;能简述为什么需要控温105℃左右。
测试方法:学生实际操作或安装完仪器叙述实验步骤。
成绩评定:根据学生实际操作情况,依据评分标准逐项给分。
九.提取
基本要求:能够熟练安装提取茶叶中咖啡因的装置。
测试标准:熟知索氏提取器各部件名称;仪器安装规范,滤纸筒折叠操作正确,滤纸筒高度、茶叶高度无误。冷凝液刚刚虹吸下去时才能停止。
测试方法:学生实际操作或结合仪器简叙实验方法、步骤。
成绩评定:根据学生实际操作情况,依据评分标准逐项给分。
十.升华
基本要求:掌握咖啡因升华的操作方法。
测试标准:蒸气浴蒸发、石棉网小火焙烧操作正确;滤纸的孔、漏斗颈塞的棉花大小适中,温度不能过高。 测试方法:学生实际操作或结合仪器叙述实验方法。
成绩评定:依据测试标准逐项给分。
有机实验操作技能抽测题
一.实验一 重结晶苯甲酸:装一套热过滤装置
(回答下列问题)
1.重结晶操作中,为什么要用抽滤方法?
2.热过滤时,漏斗中为什么要放折叠滤纸?如何折叠?
3.重结晶操作中,加入活性炭的目的是什么?加活性炭应注意什么问题?
4.重结晶的原理。
二.装一套抽滤装置:(问答)
1.所用名称及各部件作用?
2.抽滤的优点?
3.抽滤所用滤纸多大合适?过大有什么不好?
4.抽滤操作要注意什么问题?
5.简述重结晶的步骤。
三.实验二 熔点的测定,装一套熔点的测定装置。(回答:)
1.测熔点对有机化合物的研究有何实际意义?
2.毛细管法测熔点时,b形管中应倒入多少浴液?
3.为什么一根毛细管中的样品只用于一次测定?
4.接近熔点时升温速度为何要放的较慢?
5.什么时候开始纪录始熔温度和全熔温度?
四.实验三 沸点的测定,装一套蒸馏装置,(回答:)
1.所用仪器名称及作用?
2.安装蒸馏装置时应注意什么?
3.蒸馏时为什么要加入沸石?如果加热后才发现未加沸石应如何处理?为什么?
五.薄层色谱
1.实验中,样品斑点过大有什么坏处?
2.Rf值的计算公式?
3.简述实验步骤。
六.乙酸乙酯制备
1.安装制备乙酸乙酯的装置并指出各部件名称。
2.实验中为什么采用乙醇过量?
3.实验中采取了哪些措施提高酯的产率?
4.实验中加入饱和碳酸钠,饱和食盐水,饱和氯化钙,无水硫酸镁的作用?
5.实验中萃取时,产品在那一层?萃取的方法及操作。
七.乙酰苯胺制备
1.乙酰苯胺实验仪器的安装及仪器名称。
2.实验中采取了什么方法提高产率?
3.实验中温度控制在105℃左右,过高过低有什么影响?
4.实验中苯胺最好用新蒸苯胺,为什么。
八、 茶叶中咖啡因的提取及性质
1.什么叫回流?
2.提取咖啡因所用仪器的名称是——各部件名称是——,滤纸筒及茶叶的高度各自应低于什么位置?
3.简述实验步骤
4.索氏提取器的萃取原理是什么?它与一般的浸泡萃取比较有哪些优点?
5.本实验进行升华操作时,应注意什么?
6.实验仪器如何安装?
九、 有机化合物官能团的鉴定(Ⅰ)
1.所有碳水化合物都能与无机酸(浓H2SO4)作用,在与α-萘酚反应生成——色物质,成为——反应
2.鉴别酮糖与醛糖的反应是用——显——色物质的是--糖。
3.醛糖和酮糖都能还原——,——-,——-。
4.如何区别1-氯丁烷、氯苯、氯化苄?
5.碘代烷、溴代烷、氯代烷与硝酸银溶液反应速度快慢次序?
6.如何区别伯、仲、叔醇?
7.伯、仲、叔醇与重铬酸钾发生氧化还原反应,各生成什么?
8.苯酚是否有酸性?酸性大小?
9.苯酚与FeCI3反应现象?
10.苯酚与饱和溴水反应现象?
11.醛、酮与2,4-二硝基苯肼反应现象?
12.甲醛、乙醛、丙酮、乙醇、异丙醇是否发生碘仿反应?
13.甲醛、乙醛、苯甲醛、丙酮与Tollens试剂、Fehling试剂,Benedlct试剂反应产物各是什么?
14.乙醛、苯甲醛、丙酮与重铬酸钾生成什么?
15.乙醛、冰醋酸、三氯乙酸酸性大小次序?
16.乙酰乙酸乙酯、结构是什么?与FeCI3反应现象是什么?加入溴水后有何现象?
17.苯胺是否溶于盐酸?是否溶解于NaOH 。
18.伯、仲、叔胺分别与亚硝酸纳的反应各生成什么?
19.如何生成重氮盐、重氢盐与β-萘酚、苯酚的氢氧化钠溶液反应现象如何?
20.伯、仲、叔、芳胺与苯磺酰氯反应生成什么?
21.尿素水解产物?
22.二缩脲反应是什么?
23.乙酰胺发生Hofann降解反应产物是什么?
有机实验操作技能抽测题答案
实验一 重结晶苯甲酸
1.重结晶操作过程中热过滤是为了使物质与杂质形成不同温度下的溶解,同时又避免溶解物质在过滤过程中因
冷却而结晶,从而达到有效的分离提纯。
2.放菊花形折叠滤纸是充分利用滤纸的有效面积以加快过滤速度。
折叠:
(1)首先将滤纸对折成半圆形(1/2)
(2)对折后的半圆滤纸向同方向进行等分对折即1/4→1/8对折
(3)八等分的滤纸相反方向对折成16等分成扇形
(4)两段对称部位向反方向再对折一次。
(5)滤纸中心勿重压,使用时讲折好滤纸翻转使用。
3. 加入活性炭的目的是为了脱去杂质中的颜色。
加入活性炭时应注意,量不可过多否则会对样品也产生吸附影响产率,另加活性炭应在加热溶解前加入,如果开始加热则应冷却片刻至室温时再加入,避免爆沸。
4.重结晶是纯化固体有机物的常用方法之一,它是利用混合物中各组分在某溶剂或混合溶剂中溶解度的不同而使他们互相分离。主要过程:a.称样溶解 b.脱色 c.热过滤 d.冷却析结晶 e.抽滤干燥称重
二.实验二
1.抽滤装置:抽滤瓶、布氏漏斗、吸滤瓶、接收滤液
布氏漏斗。
2.抽滤的优点:使过滤和洗涤速度加快母液和晶体分离较完全,易干燥。
3.抽滤滤纸应与漏斗内径相切为宜,过大可造成结晶损失,达不到抽滤的最佳效果。
4.抽滤时应注意先用少量溶剂将滤纸润湿,然后打开抽气泵抽气,使滤纸贴与漏斗底部,然后再开始过滤,洗涤时应少用水 ,停止时应先通大气 ,然后关泵。
5.过程:a.称样溶解 b.脱色 c.热过滤 d.冷却析结晶 e.抽滤干燥称重
三.实验三 沸点的测定
1.普通蒸馏:电热套(或酒精)蒸馏烧瓶、蒸馏头、温度计、冷凝管、接受管、锥形瓶。
2.安装应先固定热源一方,从下往上,从左至右安装,首先要检查气密性,自下开始时应先固定好圆底烧瓶(或蒸馏烧瓶)加入反应物并加入2-3颗沸石,温度计水银球的上缘与蒸馏头支管的下缘齐平,并夹好烧瓶,然后调整好各仪器的位置及倾斜度,达到装置同轴,最后安好接受器,两个铁架台要平行放好。先开冷凝水后开热源。
3.加沸石的目的是防止溶液暴沸溅出伤人,如加热后才发现未加沸石,应停止加热,稍冷后再加,否则会引起暴沸,溶液冲出伤人,同时损失产率。
五.薄层色谱
1.样品斑点过大,展开过程中分散,分布不均,不利于色斑中心的判断。
原点到色斑中心的距离
2.R f= ——————————————
原点纸溶剂前沿的距离
2. 步骤:(1)制板:(2)活化:(3)点样:(4)展开:(5)R f 值的计算
七. 乙酰苯胺制备
1.仪器安装:从下往上,从左至右
名称:电热套,韦氏分馏柱,接受管,圆底烧瓶
2.a蒸出产物水 b乙酸过量 c加入锌粉 d 热过滤
3.温度过高:a苯胺可能被氧化 b 反应物乙酸被蒸出太多,均降低产率,影响质量。
温度过低:a 产物水蒸不出,影响产率,b 反应速度慢,反应时间长。
4.久置苯胺被氧化,有杂质,影响产品质量。
三.熔点的测定,装一套熔点测定装置
1.测熔点对有机化合物的研究有何实际意义?
答:借测定熔点来鉴别未知的固态有机化合物和判断有机物的纯度。
2.略高于b形管的上测管为易。某些样品熔化后冷却成固体,会因部分分解而使再加热时所得熔点不准确。缓慢升温是准确测定熔点的保证,这样一则可保证有充分的时间让热量由熔点管外传至管内,使固体熔化,二则也可便于观察者兼顾样品变化及温度计读数。始熔温度:熔点管中样品开始塌落,湿润,出现小液滴时,表示样品开始熔化。全熔温度:固体全部消失变为透明液体时。
七、乙酸乙酯制备(三颈烧瓶、滴液漏斗、温度计、蒸馏头、冷凝管、接受管、小锥瓶)
H2SO4
2.答:因乙醇有副反应 2CH3CH2OH————CH3CH2-O-CH2CH3 副反应
140-150 0C
只消耗乙醇,乙醇便宜、沸点低易回收。
3.答:增加醇的用量和不断将反应产物酯和水蒸出用浓H2SO4做催化剂。
4.馏出液中除乙酸乙酯外,还含有乙醇、水、乙酸、乙醚、亚硫酸等杂质。用Na2CO3饱和溶液除去酸;饱和食盐水除CO=3:酯在饱和食盐中溶解度小,除去杂质Na2CO3;饱和CaCI2:除去醇;无水MgSO4干燥,除去水分。
5.上层酯层
八、茶叶中咖啡因的提取及性质
1.在室温下,有些反应的速度很慢或难于进行。为加速反应,常常需要使反应物较长时间保持沸腾。在这种情况下,就需要使用回流冷凝装置,使蒸气不断地在冷凝管内冷凝而返回的方式叫做“回流”。
2.索氏提取器:蒸馏烧瓶、抽筒、冷凝管。滤纸筒上沿应低于蒸气上升管上口。茶叶应低于虹吸管最高处。
3.提取、称茶叶10g装入滤纸筒用120ml、 95%乙醇提2-3小时 ,蒸馏浓缩抽提液,抽提液加4g生石灰,在蒸气浴上蒸发至干,除去全部水份升华操作(沙浴)。
4.索氏提取器是利用溶剂的回流及虹吸原理,使固体物质每次都被纯的溶剂所萃取,因而比一般萃取效率高。
5.本实验进行升华操作时,应注意严格控制温度,否则将导致被烘物和滤纸碳化,一些有色物质也会被带出来,使产品不纯。
5.实验仪器应如何安装?
先固定好圆底烧瓶,然后再装好抽筒最后安装冷凝管,先开冷凝水后开热源。实验完毕按相反顺序拆。
九、答案(略)
评分标准:
优:仪器安装规范,实验操作正确。实验效果好,回答问题正确。
良:实验操作基本正确,实验效果可以,回答问题基本正确。
中:实验操作基本正确,实验效果一般,回答问题有小错误。
一般:仪器安装不规范,实验操作有小错误,效果不理想,回答问题有错误
不及格:仪器安装不规范,实验操作有明显重大错误,无结果,回答问题均不正确。
有机化学实验理论测试试题
一.填空题(每小题 5分,共30分)
1.液态物质加热到沸腾,使其汽化,再将蒸汽冷却为液体,这两个过程的联合操作叫——。
2.提纯固态有机化合物最常见的方法是——法。
3.萃取是利用物质在两种互不相溶(或微溶)的溶剂中——不同,使化合物从一种溶剂内转移到另一种溶剂中的操作。
4.蒸馏时应调整温度计的水银球的上缘恰好位于蒸馏烧瓶支管接口的——。
5.重结晶法是利用混合物中各组分在某种溶剂中的——不同而使它们相互分离的。
6、R f= ——————————————
二.回答问题(每题7分,共70分)
1、怎样鉴别伯、仲、叔醇?
2.采取哪些措施提高乙酸乙酯的产率?
3.简述粗乙酸乙酯精制时为什么要加饱和碳酸钠溶液,饱和氯化钠溶液,饱和氯化钙溶液和无水硫酸镁。
4.简述索氏提取器的萃取原理,它与一般的浸泡萃取比较,有哪些优点?
5、简述正确操作分液漏斗的方法。
6.简述重结晶的实验步骤。
7.绘普通蒸馏装置图,并指出图中各个玻璃仪器的名称。
答案(略)
- Word设计性实验报告模板
-
综合性设计性实验报告
河南理工大学物理化学学院化学综合设计实验报告学院物理化学学院班级应化100120xx学年第2学期1河南理工大学物理化学学院2河南理…
-
物理设计性试验报告
电磁学设计性实验报告题目激光雕刻机学院物理学院指导教师陈艳伟姓名郭文杰学号20xx012799一实验题目激光雕刻机二实验原理1从基…
-
设计性实验报告
设计性实验报告也不一样有喜芳香的也有喜恶臭的2虫媒花多半能产蜜汁蜜腺或是分布在花的各个部位或是发展成特殊的器官花蜜经分泌后积聚在花…
-
设计性实验报告模版
黄河科技学院医学院设计性实验报告课程:题目:实验者:专业:班级:联系电话:指导老师:年月日一、题目二、目的意义:阐述实验的主要内容…
-
乙酰苯胺的制备(实验报告实验总结范文模板)
(实验报告)乙酰苯胺的制备【目的要求】⑴熟悉氨基酰化反应的原理及意义,掌握乙酰苯胺的制备方法;⑵进一步掌握分馏装置的安装与操作;⑶…
-
苯佐卡因的合成实验设计报告
实验设计报告实验名称苯佐卡因的合成学号姓名专业化学20xx年5月13日一实验目标产物的名称及理化性质苯佐卡因又名对氨基苯甲酸乙酯一…
-
乙酰苯胺的制备实验报告南昌大学
南昌大学有机化学实验报告学生姓名彭以振学号专业班级实验类型验证综合设计创新实验日期20xx年9月28日实验地点同组学生姓名指导教师…
-
化学实验报告--乙酰苯胺的制备
化学实验报告乙酰苯胺的制备乙酰苯胺的制备11掌握苯胺乙酰化反应的原理和实验操作2学习固体样品的制备3学习分馏柱的原理及使用方法4掌…
-
乙酰苯胺实验报告
有机化学实验实验人钱泓旭辅导老师向清祥实验名称乙酰苯胺NPhenylacetamide编号003日期20xx926温度170气压9…
-
乙酰苯胺的重结晶实验报告(4)沈x
有机化学实验报告实验名称:乙酰苯胺的重结晶学院:化学工程学院专业:化学工程与工艺班级:化工11-4班姓名:沈x学号********…