酸碱中和滴定实验报告
酸碱中和滴定实验报告
姓名 学号 指导老师
一、实验目的:用已知浓度的盐酸(0.2000mol/L)滴定未知浓度的NaOH溶液
二、实验原理:
三、实验步骤
1.滴定前准备过程:
滴定管:检漏→水洗 →______→ 装液 →______ →调整液面并记录 (调到__ ______)
锥形瓶:水洗 →放出待测液→加
2.滴定操作:
①锥形瓶下垫张白纸的作用:
②操作时左手 ,右手 ,眼睛 。
3.终点的判断方法:最后一滴刚好使指示剂由 变为 ,且 不再变化。
4.重复操作2至3次 5.计算结果 c(碱)=
四、酸碱中和滴定的误差分析 (填“偏大、偏小、无影响) 分析原理: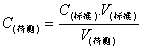
1、润洗不当
① 装标准液的滴定管用蒸馏水洗后,没有润洗( )
② 装待测液的滴定管用蒸馏水洗后,没有润洗( )
③ 锥形瓶用蒸馏水洗后,又用待测液洗( )
2、读数不当
①待测液,开始时仰视,结束时俯视( )②待测液,开始时俯视,结束时仰视( )
③标准液,开始时仰视,结束时俯视( )④标准液,开始时俯视,结束时仰视( )
3、操作不当
①锥形瓶装了待测液未洗净( )②锥形瓶装了标准液未洗净( )
③滴定过程中,标准液滴到锥形瓶外,或盛标准液的滴定管漏液( )
④盛待测液的滴定管漏液( )
⑤盛标准液的滴定管滴定前尖嘴处有气泡末排出,滴定后无气泡( )
⑥盛标准液的滴定管滴定前尖嘴处无气泡末排出,滴定后有气泡( )
⑦盛待测液的滴定管滴定前尖嘴处有气泡末排出,滴定后无气泡( )
⑧盛待测液的滴定管滴定前尖嘴处无气泡末排出,滴定后有气泡( )
5、终点判断不准确 ①滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液( )
6、样品含杂质
①用含氧化钠的氢氧化钠标准溶液滴定未知溶度的盐酸( )
②用含碳酸钠的氢氧化钠的标准液滴定未知溶度的盐酸( )
7、对结果无影响 ①锥形瓶用蒸馏水洗后末干燥( )
一、酸碱中和滴定的定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
二、实验原理:H++OH-=H2O
公式:a. n(H+)=n(OH-) b. c(H+)V(H+)==c(OH-)V(OH-)
三、实验步骤
1、准备过程:
滴定管:检漏→水洗 →______→ 装液 →______ →调整液面并记录 (调到________)
锥形瓶:水洗 →放出待测液→加指示剂
2.滴定操作:滴定→记录 →复滴→计算
注意:①锥形瓶下垫张白纸的作用:
②操作时左手 ,右手 ,眼睛 。
③滴速:先 后 (填“快”或“慢”),当接近终点时,应一滴一摇。
④ 终点的判断方法:最后一滴刚好使指示剂颜色发生改变,半分钟不再变化。
四、酸碱中和滴定的误差分析:
1、润洗不当
④ 装标准液的滴定管用蒸馏水洗后,没有润洗( )
⑤ 装待测液的滴定管用蒸馏水洗后,没有润洗( )
⑥ 锥形瓶用蒸馏水洗后,又用待测液洗( )
2、读数不当
①待测液,开始时仰视,结束时俯视( )
②待测液,开始时俯视,结束时仰视( )
③标准液,开始时仰视,结束时俯视( )
④标准液,开始时俯视,结束时仰视( )
3、操作不当用
①锥形瓶装了待测液未洗净( )
②锥形瓶装了标准液未洗净( )
③滴定过程中,标准液滴到锥形瓶外,或盛标准液的滴定管漏液( )
④盛待测液的滴定管漏液( )
⑤盛标准液的滴定管滴定前尖嘴处有气泡末排出,滴定后无气泡( )
⑥盛标准液的滴定管滴定前尖嘴处无气泡末排出,滴定后有气泡( )
⑦盛待测液的滴定管滴定前尖嘴处有气泡末排出,滴定后无气泡( )
⑧盛待测液的滴定管滴定前尖嘴处无气泡末排出,滴定后有气泡( )
5、终点判断不准确
①滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液( )
6、样品含杂质
①用含氧化钠的氢氧化钠标准溶液滴定未知溶度的盐酸( )
②用含碳酸钠的氢氧化钠的标准液滴定未知溶度的盐酸( )
7、对结果无影响
①锥形瓶用蒸馏水洗后末干燥( )
②用强酸滴定强碱时,碱液移入锥形瓶中,加入10ml蒸馏水再滴定 ( )
第二篇:酸碱性中和滴定及其强化练习
酸碱性中和滴定
一、酸碱中和滴定
1、概念:用已知浓度的酸的溶液测定未知浓度的碱溶液的过程,或者是用已知浓度的碱的
溶液测定未知浓度的酸溶液的过程。其中,已知浓度的酸碱溶液习惯称为标准溶液,未知浓度的酸碱溶液习惯称为待测溶液。
2、依据:酸碱恰好完全反应是中和滴定的计算依据。酸碱恰好完全反应,就是酸碱中和滴
定的滴定终点。最常用的是一元酸与一元碱的反应。就有:
C(标准溶液)·V(标准溶液)=C(待测溶液)·V(待测溶液)
C(标准溶液)·V(标准溶液) C(待测溶液)=V(待测溶液)
酸碱完全反应后,溶液不一定呈中性。
3、仪器:酸式滴定管、酸式滴定管、锥形瓶、烧杯、滴定管夹、胶头滴管。
4、试剂:标准溶液、待测溶液、指示剂、蒸馏水
5、步骤:①中和滴定首先进行的操作是检查滴定管是否漏水
②用蒸馏水洗涤滴定管,并用对应的标准溶液或待测溶液润洗滴定管。然后准确
量取待测溶液,记下待测溶液的体积,置于锥形瓶中,并向锥形瓶中滴加几滴指示剂。用滴定管取用标准溶液,置于滴定管夹固定。两个取用,一定要保证尖嘴部分没有气泡。
③滴定:左手控制滴定管的活塞或玻璃珠,右手振荡锥形瓶,眼睛观察指示剂颜
色的改变和滴定速率。到滴定终点时,记下所用标准溶液的体积。
④计算:平行做三次实验,取标准溶液体积的平均值进行计算。
6、指示剂选择规律和滴定终点的判断:强酸滴定强碱,一般选择酚酞,终点为:红色恰好变为无色。强碱滴定强酸,一般可选择酚酞,终点是:无色恰好变为红色,半分钟内不褪色;也可选择甲基橙,终点是红色恰好变为橙色。强酸滴定弱碱,选择甲基橙,终点是黄色变为红色。强碱滴定弱酸,选择酚酞,终点是无色变为红色,半分钟内不褪色。选择的规律是指示剂的变色范围要落在滴定终点PH值的跃迁范围内。
二、中和滴定的误差分析:C(待测溶液)随V(待测溶液)的体积增大而增大,C(待测溶液)随 V(待测溶液)的体积减小而减小。
1、盛待测溶液的滴定管用蒸馏水洗涤后没有润洗,C(待测溶液)偏低。
2、盛待测溶液的滴定管尖嘴部分有气泡,C(待测溶液)偏低。
3、锥形瓶中有少量蒸馏水,C(待测溶液)没有影响。
4、盛标准溶液的滴定管用蒸馏水洗涤后没有润洗,C(待测溶液)偏高。
5、盛待测溶液的滴定管尖嘴部分有气泡,C(待测溶液)偏高。
6、量取待测溶液时,最后读数时,仰视刻度线,C(待测溶液)偏低;俯视刻度线,C(待测溶 液)偏高。
7、最后读取标准溶液的体积时,仰视刻度线,C(待测溶液)偏高;俯视刻度线,C(待测溶 液)偏低。
8、滴定操作时,眼睛观察滴定管液面下降,最容易导致C(待测溶液)偏高。
9、滴定操作时,有少量标准溶液溅出,C(待测溶液)偏高。
10、滴定操作时,最后一滴挂在尖嘴部分,C(待测溶液)偏高。
三、强化练习
1、用0.10mol·L-1的盐酸滴定0.10mol·L-1的氨水,滴定过程中锥形瓶不可能表现的结果是( )
A、c(Cl)+<c(NH4), c(OH)>c(H)
+--B、c(NH4)=c(Cl), c(OH)>c(H+)
-+-C、c(Cl)>c(NH4), c(OH)<c(H+)
-+-D、c(Cl)=c(NH4), c(H+)=c(OH)
--2、25℃时用0.2mol·L1的HCl50mL去滴定0.2mol·L1NaOH50mL溶液,当还差一滴盐酸
和多一滴盐酸时的PH值的改变就是该中和滴定的PH值的突跃范围。已知一滴该溶液相当于0.05mL,则该中和滴定的PH值的突跃范围是( )
A、4—10 B、3—11 C、2—12 D、5—9
3、25℃时,用PH=a的强酸溶液V1L去滴定PH=b的强碱溶液V2L,溶液恰好成中性,已知V1:V2=10:1,则a与b的关系是( )
A、a+b=13 B、a+b=14 C、a+b=15 D、a+b=16
4、常温时,向pH =2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( ) -+-+
A、pH =12 的Ba(OH)2 B、pH =12的氨水
C、0.01mol/L NaOH D、0.05mol/LBaCl2
5、用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,
当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是 ( )
A、V1>V2 B、V1<V2 C、V1=V2 D、V1≤ V2
6、在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是( )
A、c(A-)=c(K+) B 、c(H+)=c(OH-)<c(K+)<c(A-)
C、反应后溶液的体积一定等于20mL D、反应后溶液的体积一定小于20mL 7、用0.1mol.L NaOH溶液滴定0.lmol.L盐酸,如达到滴定的终点时不慎多加了1滴NaOH-1-1
溶液(1滴溶液的体积约为0.05mL)。继续加水至50mL,所得溶液的pH是( )
A、4 B、7.2 C、10 D、11.3
8、用PH=13的强碱溶液与PH=2的强酸溶液混和,所得混和液的PH值=11,则强酸与强碱的体积比是( )
A、11:1 B、9:1 C、1:11 D、1:9
9、下列中和滴定操作正确的是( )
A、用碱式滴定管量取氢氧化钠溶液
B、滴定时眼睛观察滴定管液面的下降
C、用酸式滴定管量取盐酸的体积为20.1mL
D、锥形瓶底部垫一张白纸
10、在中和滴定中,用25mL滴定管量取待测溶液时,如果起始读数恰好在0刻度线,将所
有溶液放入干燥的锥形瓶中,锥形瓶内溶液的体积( )
A、等于25mL B、大于25mL C、小于25mL 无法确定与25mL的关系
11、用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸溶液,下列操作会使测得的盐酸浓度偏 高的是( )
A、量取盐酸的滴定管用蒸馏水洗涤后没有用盐酸润洗
B、盛氢氧化钠的滴定管用蒸馏水洗涤后没有用氢氧化钠溶液润洗
C、锥形瓶中含有少量蒸馏水没有干燥
D、其他读数都正确,在最后读取氢氧化钠溶液的体积时俯视刻度线。
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…