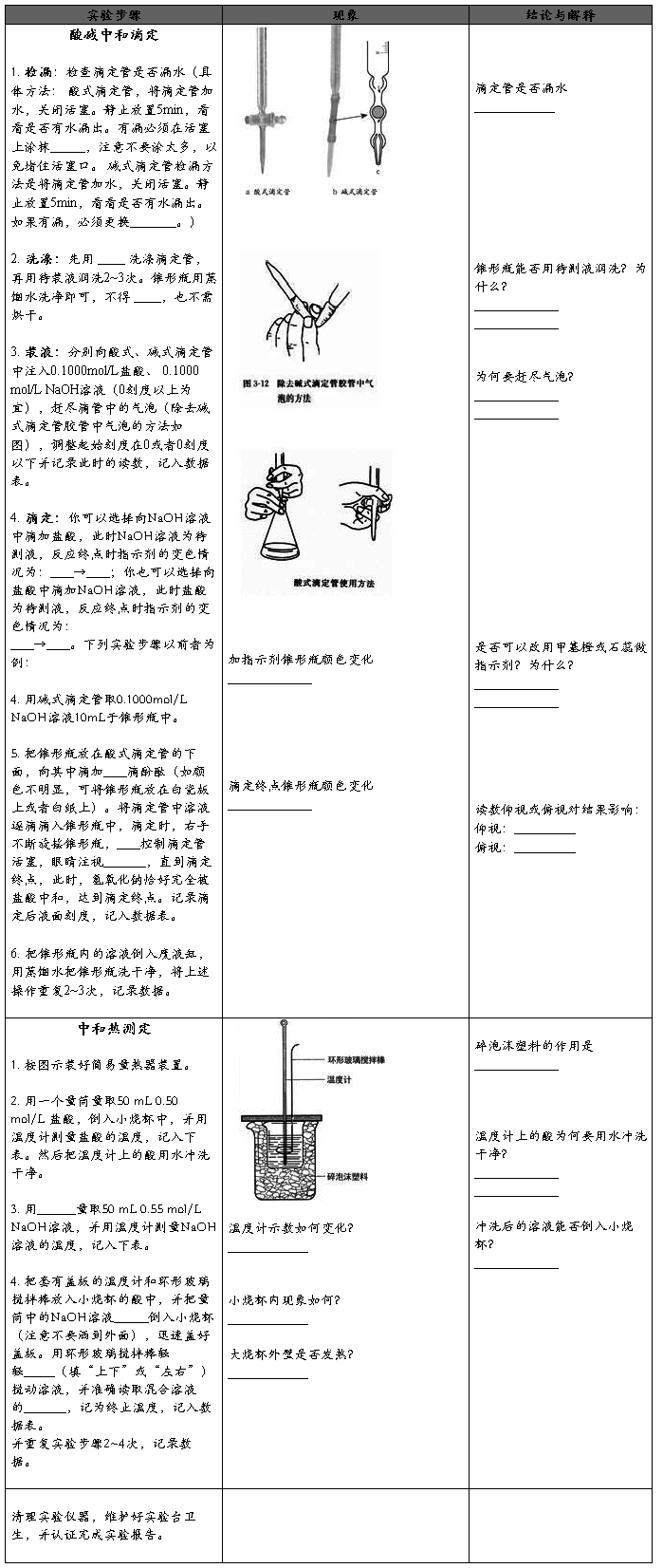
酸碱中和滴定、中和热测定实验报告
 学生实验 酸碱中和滴定 酸碱中和中和热测定
学生实验 酸碱中和滴定 酸碱中和中和热测定
一、预习思考
◆实验目的
1、练习使用pH计测量溶液的pH;探究酸碱中和反应过程中pH的变化特点;体会定量实验在化学研究中的作用。
2、测定强酸和强碱反应的反应热,体验化学反应的热效应。
◆实验原理
1、在酸碱中和反应中,使用一种 的酸(或碱)溶液跟 的碱(或酸)溶液完全中和,测出二者的 ,再根据化学方程式中酸和碱的物质的量的比值,就可以计算出碱(或酸)溶液的浓度。
计算公式: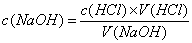 或
或 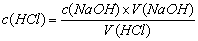 。
。
2、中和反应原理:H+(aq) + OH-(aq)===H2O(l);△H=-57.3kJ/mol
中和热计算方法:(强酸和强碱反应) Q=mCΔt
(1)其中 Q为 ,m为 ,C为反应混合液的比热容, △t为 ;
(2)因为m = V(酸)ρ(酸)+V(碱)ρ(碱),V(酸)=V(碱)=50mL,而酸的浓度是0.50 mol/L ,碱的浓度是0.55mol/L;且ρ(酸)=ρ(碱)=1 g/cm3、C=4.18 J/(g·℃),所以
Q = ; 。
。
◆实验用品
1、0.1mol/L左右的盐酸、0.1mol/L左右的NaOH溶液、酚酞溶液、蒸馏水、pH计、酸式滴定管、碱式滴定管,烧杯、锥形瓶、滴定管夹、铁架台
2、大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、
泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒、0.50 mol/L 盐酸、0.55 mol/L NaOH溶液(为了保证盐酸完全被氢氧化钠中和,采用 )。
◆要点提示
1、酸和碱反应的实质是 。
2、酸碱中和滴定选用酚酞作指示剂,但其滴定终点的变色点并不是pH=7,这样对中和滴定终点的判断有没有影响?
3、滴定管和量筒读数时有什么区别?
4、中和热实验所测得的数据若不是57.3 kJ/mol,则产生误差可能的原因有哪些?
二、记录与分析
实验时间: 年 月 日 第 节 同组成员:
三、数据记录与处理
酸碱中和滴定数据表

中和热测定数据表

四、问题讨论
1、误差分析

2、中和热测定实验酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
3、酸碱中和滴定的关键是什么?
实验成绩:
第二篇:酸碱中和滴定 实验报告
实验名称: 酸碱中和滴定
时间 实验(分组)桌号 合作者 指导老师
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
实验药品: 0.1000mol/L盐酸(标准溶液)、未知浓度的NaOH溶液(待测溶液)、酸碱指
示剂:酚酞(变色范围8~10)或者甲基橙(3.1~4.4)
三:实验原理: c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
【本实验具体为:c(H+)×V(酸) = c(OH-)×V(碱)】
四:实验过程:
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水(具体方法: 酸式滴定管,将滴定管加水,关闭活塞。静止放置5
min,看看是否有水漏出。有漏必须在活塞上涂抹凡士林,注意不要涂太多,以免堵住活塞口。 碱式滴定管检漏方法是将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。如果有漏,必须更换橡皮管。)
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次。
锥形瓶用蒸馏水洗净即可,不得润洗,也不需烘干。
3、量取:用碱式滴定管量出一定体积(如20.00ml)的未知浓度的NaOH溶液(注意,调整起始刻度
在0或者0刻度以下)注入锥形瓶中。
用酸式滴定管量取标准液盐酸,赶尽气泡,调整液面,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数
V1,读至小数点后第二位 。
(二)滴定阶段
1、把锥形瓶放在酸式滴定管的下面,向其中滴加1—2滴酚酞(如颜色不明显,可将锥形瓶放在白瓷板上或者白纸上)。将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴盐酸后溶液变为无色且半分钟内不恢复原色。此时,氢氧化钠恰好完全被盐酸中和,达到滴定终点。记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复2~3次。
(三)实验记录

(四).实验数据纪录:
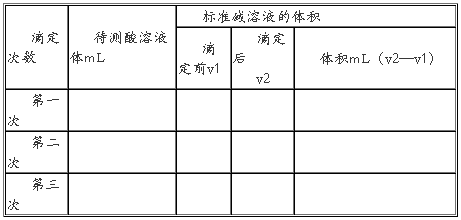
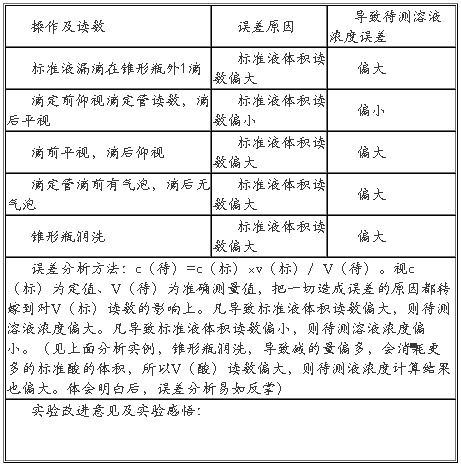
五、实验结果处理:c(待)=c(标)×V(标)/ V(待)
注意取几次平均值。
六、.实验评价与改进:[根据:c(H+)×V(酸) = c(OH-)×V(碱)分析]
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
酸碱中和滴定实验操作方法
酸碱中和滴定实验报告班级姓名学号合作者日期一实验目的用已知浓度溶液标准溶液本实验NaOH为标准溶液测定未知溶液待测溶液浓度本实验盐…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…