电解质溶液及配位化合物 实验报告
西安交通大学实验报告
课 程 大学化学实验 实验名称 电解质溶液及配位化合物
系 别 电气 实 验 日 期 2011年11月11日
专业班号 钱学森12 组别 二 交报告日期
姓 名 ## 学号 ##
同 组 者 陈思成 戴威尔 董世豪 教师审批签字
一、实验目的
(1)了解共同离子对弱电解质和强电解质(易溶挥和难溶)溶液的影响。
(2)了解缓冲溶液的配制和性质。
(3)了解溶液淀的生成,溶解和转化原理。
(4)了解配离子的形成和配离子与简单离子的区别。
(5)了解配离子的解离平衡及不稳定常数。 。
(6)了解盐类水解和影响盐类水解的因素。
二、实验原理
弱电解质在水中.其分子电离成离子的过程是可逆的,当这两个相反过程的速率相等时,就达到电离平衡,此时如果增加某种离子的浓度,平衡就向减少该离子浓度的方向移动。在强电解质的饱和溶液中加入含有共同离子的电解质时,这种电解质的溶解度降低。
弱酸或弱酸盐所组成的溶液,弱碱或弱碱盐所组成的溶液称为缓冲溶液
假如某缓冲溶液由弱酸和它的盐组成,则它的pH值计算方法如下:

由此式可知,缓冲溶液的pH值除主要决定于a外,同时也随盐和酸浓度的比值而变化。从配制溶液时所用弱酸。弱酸盐及弱酸的电解常数即可计算出该缓冲溶液的pH值。本实验中用pH测试仪及pH试纸来实测所配制的醋酸-醋酸盐缓冲溶液的pH值,并与计算值
相比较。由于溶液中存在电离平衡.当缓冲溶液中加入少量酸或碱时。溶液的pH值不会发生显著的变化。
在难溶电解质饱和溶液中。当温度一定时。其离子浓度的乘积等于浓度积,当溶液
中存在的某几种离子均能与加入的某种试剂生成沉淀时,其离子浓度乘积首先达到浓度积的化合物首先沉淀。如果在NaCl和K2CrO4的混合溶液中 : c(Cl-)=c(CrO4 2-)=0.1 mol/L,逐滴加入AgNO3时,逐滴加入AgNO3溶液时.可能发生下列反应:
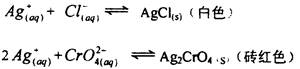
它们的溶度积数值:
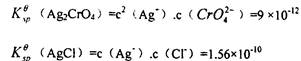
用溶度积原理可以计算出开始生成AgCl与Ag2Cro4沉淀时所用银离子最低浓度,通过计算可以说明AgCl首先沉淀。然后当Ag+溶度逐渐增大时,Ag2Cr04沉淀才出现。
对相同类型的的难溶电解质,如AgCI与Agl,可根据溶度积的大小.直接判断沉淀的先后及沉淀向溶解方向转化的易难。
另外,还可以根据溶度积原理,沉淀的溶解与转化成另一种溶解度更小的沉淀的情况,如要是沉淀溶解,只需加入某种试剂,降低溶液中一种离子的浓度。使其离子浓度相应方次乘积小于溶度积,就能使沉淀向溶解的方向转化。
由于副族元素有(n-1)d、ns、np等空轨道存在,因此,它们可以容纳配位体给予的电子对形成配离子,如[Ag(NH3)2]+、[Cu[NH3]4]2+、[AgI4]3-一等等。形成配离子以后,简单离子的性质就发生了变化。
含有配离子的化合物称为配合物,它在溶液中能解离:
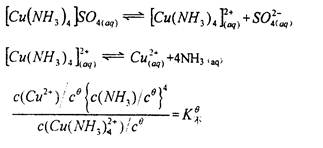
对具有相同配位数的配离子,K 越大,表示该配离子越不稳定:K 越小,表示该配离子越稳定,不易解离。
如
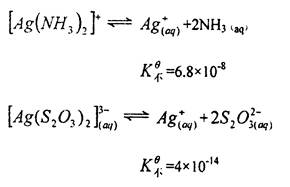
因此,在相同条件下,[Ag(NH3)2]+溶液中Ag浓度远远大于[Ag(S2O3)]3-溶液中Ag+的浓度
盐类水解造酸碱中和的逆反应,水解后溶液的酸碱性取决于盐的类型。由于水解是吸热反应,因此升高温度,有利于水解的进行。
两种都能水解的盐,如果其中一种水解后溶液显酸性,另一种水解后溶液显碱性,当这两种盐溶液相混合时.可以彼此加剧水解。
三、仪器与药品
1.仪器
2.药品
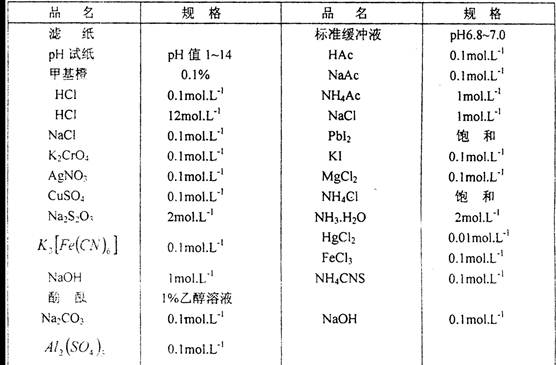
*pH值等于6.8的缓冲溶液,可用0.2 mol/L磷酸氢二钠溶液49mL和0.2 mol/L磷酸二氢钠溶液51mL混合配制而成。
四、实验步骤
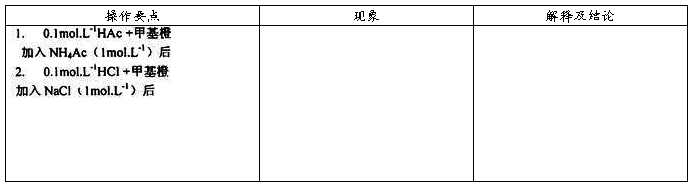
1.强弱电解质的区别
取两支试管,在第一支试管中加入O.1 mol/L。HAc溶液5滴,甲基橙溶液l滴,记录其颜色,再滴入1 mol/L NH4Ac溶液1滴,观察其颜色变化。在第二支试管中加入0.1 mol/L HCI溶液5滴,甲基橙溶液1滴,记录其颜色,再滴加1mol/L NaCl溶液l滴。观察其颜色变化。
2.缓冲溶液的制备及溶液pH值的测定
(1)缓冲溶液的配制:用量筒量取溶液0.1 mol/L HAc 10ml 及0.1 mol/L NaAc溶液10mL于50mL小烧杯中,混合均匀即制成某pH值的缓冲溶液。用试纸测定该溶液的pH值。
(2)用pH测试仪精确测定所配制缓冲溶液的pH值并与用pH试纸测定值及理论值进行比较。
(3)缓冲溶液的缓冲性能:在上述配好的缓冲溶液中加入0.5mL(约10滴)
0.1mol/L NaOH溶液,用pH测试仪测定其pH值,再加入l mL(约20滴)
溶液,再用pH测试仪测定其pH值。
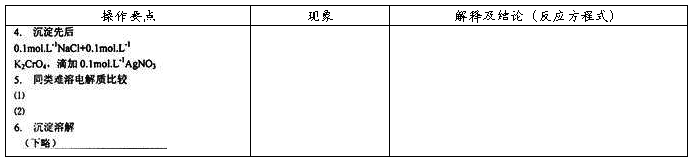
3.溶度积规则的应用
(1)沉淀的先后:在一支试管中加入 0.1 mol/L NaCl和 0.1 mol/L K2CrO4溶液各2滴,然后在振荡的情况下逐滴加O.1 mol/L AgNO3溶液5滴(小心不要滴在试管壁上)。记录沉淀的颜色变化,用溶度积原理解释之。
(2)同类型难溶电解质溶度积比较
取2支试管:每支试管加入0.1 mol/L AgNO3溶液2滴,在其中一试管中加入0.1 mol/L NaCl溶液2滴.另一试管中加入O.1 mol/L KI溶液2滴摇匀,观察AgCl白色沉淀和Agl黄色沉淀的生成,然后在沉淀中各加入2 mol/L 氨水2~3滴,观察二试管中沉淀溶解的情况有何不同.
(3)沉淀的溶解:在一试管中加入0.1 mol/L MgCl2溶液3滴,1 mol/L NaOH溶液2滴,观察现象,再加入饱和的NH4Cl溶液2滴,观察现象。
(4)沉淀的转化,在一支试管中加入O.1 mol/L K2Cr04溶液2滴,再加入0.1 mol/L AgNO3溶液4滴使砖红色Ag2Cr04沉淀完全,再加入0.1 mol/L NaCI溶液4~6滴,摇匀,使砖红色沉淀转化为白色的AgCl沉淀。
4.配合物的形成和性质
(1)正负配离子的形成
①[Ag(NH3)2]+的形成:在一试管中加入约1毫升0.1 mol/L AgN03溶液,再逐滴加入2 mol/L NH3H20溶液,每加一滴均应充分摇荡试管,观察褐色Ag2O沉淀的生成,再滴加2 mol/L NH3H20溶液,直到沉淀溶解.即得含有 [Ag(NH3)2]+的溶液。
② [Cu(NH3)4]2+ 的形成:在一试管中加入10滴0.1 mol/L CuSO4溶液,逐滴加入2 mol/L NH3H20溶液,观察浅蓝色Cu(OH)2沉淀的生成.再逐滴加入2 mol/L NH3H2O溶液,直到沉淀溶解而溶液转变为深蓝色,即得含有 [Cu(NH3)4]2+的溶液。
③[HgI4]2-的形成:在一试管中加入5滴0.01 mol/L HgCl2溶液,逐滴加入0.1 mol/L KI溶液,观察桔红色HgI2沉淀的生成,再逐渐加入O.1 mol/L KI溶液,直到沉淀溶解,即得含有[HgI4]2-的溶液。
(2)简单离子与配离子性质比较
Fe 3+与[Fe(CN)6]3-和NH4SCN的作用。
在一支试管中加 1 毫升O.1 mol/L FeCl3溶液在另一支试管中加入1mLO.1 mol/L K 3 [Fe(CN)6] 溶液,然后分别加人1滴NH4SCN,观察两试管中的变化。
(3)配离子稳定性的比较
[Ag(NH3)]2+与[Ag(S2O3)2]3-稳定性的比较
取一支试管加入O.1 mol/L AgN03溶液2滴,在逐滴加入2 mol/L氨水5滴即制得含有[Ag(NH3)2]+的溶液。
另取试管一支加入O.1 mol/L AgNO3溶液2滴,再逐滴加入2 mol/L Na2S2O3溶液5滴,制得含有[Ag(S2O3)2]3-的溶液。
将上述制得的-二种配合物溶液各加入O.1 mol/L KI溶液1滴,观察二试管中现象。
5.盐的水解
(1)在一支试管中加入O.1 mol/L NaAc溶液1mL,用pH试纸测pH值,再加入1滴酚酞溶液。然后用酒精灯加热,观察试管中颜色。
(2)取1支试管,加入2mL0.1 mol/L Al2(SO4)3溶液,用pH试纸测pH值,再加入3mL0.1 mol/L Na2CO3溶液,观察现象。
五、实验结果
(1) 强弱电解质的区别
(2) 缓冲溶液的制备及溶液pH值的测定
1.缓冲溶液的配制
0.1mol/L HAc 10ml +0.1mol/L NaAc 10ml
2.溶液的性能

(3)溶度积规则应用
-
电解质溶液及配位化合物 实验报告
西安交通大学实验报告课程大学化学实验实验名称电解质溶液及配位化合物系别电气实验日期2011年11月11日专业班号钱学森12组别二交…
-
稀土配合物的实验报告
新型稀土配位聚合物Ln2mbdc3H2O2nLnEuTbGd的合成及掺杂后结构和荧光分析一实验目的1了解稀土配合物的一些合成方法后…
-
稀土有机配合物的制备及性能测定实验报告
稀土有机配合物的制备及性能测定北京化工大学理学院姓名班级学号时间20xx5820xx521一实验目的1了解稀土元素的基本知识2理解…
-
稀土有机配合物的制备和性能研究实验报告
稀土有机配合物的制备及性能测定一实验目的1了解稀土元素的基本知识2理解光致发光的基本原理3熟练掌握稀土盐和稀土有机配合物的制备方法…
-
三氯化六氨合钴的制备实验报告
一实验目的1掌握三氯化六氨合钴III的合成及其组成测定的操作方法通过对产品的合成和组分的测定确定配合物的实验式和结构2练习三种滴定…
-
化学-电解质溶液-同离子效应”实验报告
中国石油大学华东现代远程教育实验报告课程名称普通化学化学原理1实验名称电解质溶液同离子效应实验形式在线模拟现场实践学生姓名号年级专…
-
化学-电解质溶液-同离子效应”实验报告
中国石油大学华东现代远程教育实验报告课程名称普通化学化学原理1实验名称电解质溶液同离子效应实验形式在线模拟现场实践学生姓名吴洪涛号…
-
化学-电解质溶液-同离子效应”实验报告
中国石油大学华东现代远程教育实验报告课程名称普通化学化学原理1实验名称电解质溶液同离子效应实验形式在线模拟现场实践学生姓名赵达飞号…
-
普通化学-电解质溶液-同离子效应”实验报告
中国石油大学华东现代远程教育实验报告课程名称普通化学化学原理1实验名称电解质溶液同离子效应实验形式在线模拟现场实践学生姓名学号年级…
-
电解质溶液实验报告
化学教学论实验电解质溶液实验报告学院:化学化工学院班级:10级化教班组:第八组组员:###电解质溶液一、实验目的1、了解电解质溶液…
-
稀土有机配合物的制备和性能研究实验报告
稀土有机配合物的制备及性能测定一实验目的1了解稀土元素的基本知识2理解光致发光的基本原理3熟练掌握稀土盐和稀土有机配合物的制备方法…