第六次实验预习报告
实验六预习报告
一:实验目的
1,进一步理解调制信号的解调原理和实现方法。
2,掌握包络检波器的基本电路和低通滤波器RC参数对检波器输出的影响。
3,进一步理解包络检波器中产生失真的机理及预防措施
二:仪器与设备
双踪示波器 数字频率计
直流稳压电源 数字万用表
三:实验原理及电路
二极管包络检波器分为峰值包络检波和平均包络检波。二极管峰值包络检波需要输入信号电压幅度大于0.5V,检波器输出、输入之间是线性关系,故又称为线性检波。输入回路提供调幅信号源。检波二极管通常选用导通电压小、
导通电阻和结电容小的点接触型锗管。RC电路有两个作用:一是作为检波器的负载,在两端产生解调输出的原调制信号电压;二是滤除检波电流中的高频分量。
检波过程实质上是信号源通过二级管向负载电容C充电和负载电容C对负载电阻R放电的过程,充电时间常数为RdC,Rd为二极管正向导通电阻。放电时间常数为RC,通常R>Rd,因此对C而言充电快、放电慢。经过若干个周期后,检波器的输出电压V0在充放电过程中逐步建立起来,该电压对二极管VD形成一个大的负电压,从而使二极管在输入电压的峰值附近才导通,导通时间很短,电流导通角很小。当C的充放电达到动态平衡后,V0按高频周期作锯齿状波动,其平均值是稳定的,且变化规律与输入调幅信号的包络变化规律相同,从而实现了AM信号的解调。
实验电路图:
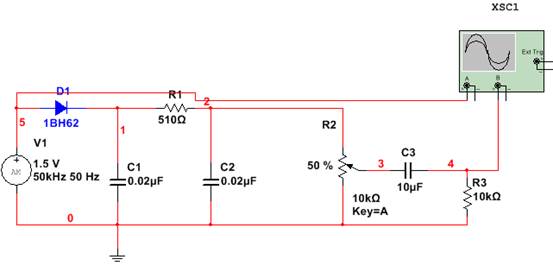
二极管峰值包络检波器
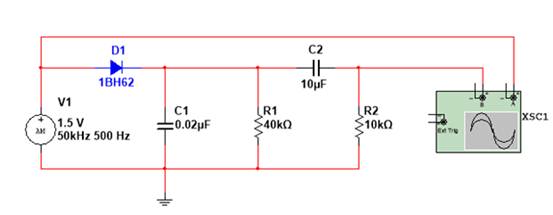
分负载检波电路
四:实验结果:
二极管峰值包络检波器:
1,将低通滤波器中的电容CL的值改为0.2uF,观察输出波形: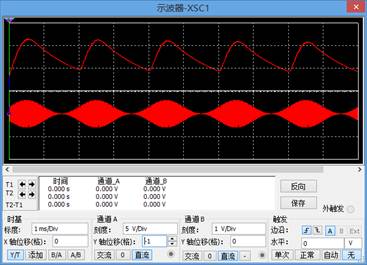
2,将检波电路参数改为RL=400K?,观察输出波形:
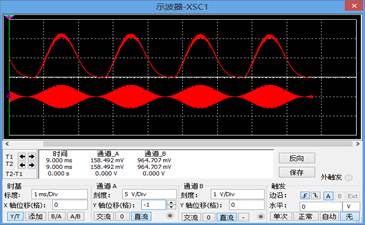
3,将AM信号的调制指数Ma改为0.8,观察输出波形:
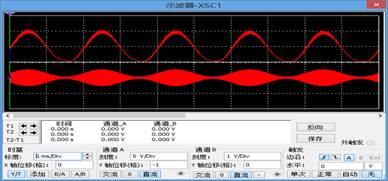
4,将电路汇总的R1改为5K?,观察输出波形:

5,令AM信号源的载波频率为20KHz,观察输出波形:
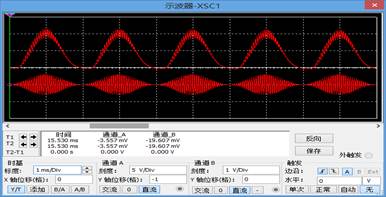
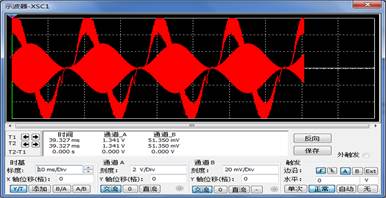
分负载检波电路:
电路示波器输出波形如下:
第二篇:实验预习与报告(中文)
无机化学实验
(预习提要、实验记录与报告单)
专业
班级
姓名
中国农业大学“无机及分析化学”教研组编
二OO四年
专业: 班级: 学号: 姓名: 日期:
前 言
为了加强无机化学实验课堂教学环节及作业的规范化、科学化管理,使学生通过无机化学实验的基本训练,养成严谨的学风,实事求是和严肃认真的科学态度,掌握化学实验的基本操作技能,获得全面的化学素质教育。为此,我们编写了这本“无机化学实验预习提要、实验记录与报告单”
要求学生在阅读实验教材内容之后,进入实验室之前完成预习题,记录及报告作为学生实验时记录原始数据之用。
实验预习、实验记录与报告单将作为学生实验课成绩评定的重要依据。
中国农业大学“无机及分析化学”教研组编
孙英修订
20xx年6月
2
专业: 班级: 学号: 姓名: 日期:
实验一 粗食盐的提纯
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 在使用台秤进行称量时,应该注意些什么?
2. 在固体试剂的取用中,应该注意些什么?在液体试剂的取用中,应该注意些什么?
3. 为什么选用有毒的BaCl2除去SO42,而不用无毒的CaCl2?过量的Ba2如何除去? -+
4. 为什么选用Na2CO3除去Ca2、Mg2等杂质,而不用别的可溶性碳酸盐?除去CO32为什++-
么要用盐酸而不用其它强酸?
5. 在实验中,为什么要先加入BaCl2,后加入Na2CO3?顺序相反行吗?加入BaCl2后,不经
过滤,待加入Na2CO3后再一并过滤行吗?
1
专业: 班级: 学号: 姓名: 日期: 实验报告
1.提纯NaCl的步骤:
( )滴,以沉淀( ) ( )g 粗食盐 加热 滴管逐滴加入1 mol·L1BaCl2溶液约-
15mL水 溶解 加热令生成的沉淀沉降
沉淀完全否? 过滤以除去( ) 加入2mL Na2CO3,以沉淀( )
( ) 洗涤 加热令生成的沉淀沉降
沉淀完全否? 过滤以除去( )
( ) 洗涤 向滤液中逐滴加入6 mol·L1盐酸,以除去( ) 蒸发至稀粥状 -
用pH试纸检验溶液的酸度,直至pH值为( )为止
趁热倒入布氏漏斗 检验
抽滤,以除去( ) 合格否( )
2.产品检验:
(1)产品外观:;
;检验SO42、CO32: ; (2)小试管实验检验Ca2:+--
(3)比浊法检验SO42含量 -
产品中SO42含量范围: -
3.写出实验过程中所涉及到的化学反应方程式
2
专业: 班级: 学号: 姓名: 日期:
实验二 由废白铁制备硫酸亚铁和硫酸亚铁铵
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 在制备实验中:
① 采取了什么措施防止Fe2被氧化? +
② 在铁与硫酸反应、蒸发浓缩溶液时,为什么采用水浴加热?
2. 如果你的产品含Fe3较多,请分析原因。 +
3. 怎样才能得到较大的晶体?
3
专业: 班级: 学号: 姓名: 日期: 实验报告
1. 硫酸亚铁与硫酸亚铁铵的制备
简要写出制备步骤及反应方程式。
2.产品含Fe3+的限量分析
比色法含Fe3+的限量分析
产品中Fe3+含量范围:
4
专业: 班级: 学号: 姓名: 日期:
实验三 铝锌合金中组分含量的测定
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 为什么在读取量气管中液面位置时,必须使之与漏斗中液面相齐?
2. 实验中检验装置是否漏气的操作原理是什么?反应过程中,实验装置漏气,对测定结果
有何影响?
3. 反应完毕,为什么要等试管冷却到室温再读数?否则,对实验结果有何影响?
4. 试分析下列情况对测定结果有无影响?
(1) 反应过程中,若由量气管压入漏斗的水过多,造成水由漏斗溢出;
(2) 固定合金样品时,不小心使其与稀酸溶液有了接触;
(3) 量气管内(包括量气管与漏斗相连接的橡皮管)气泡未赶尽;
5
专业: 班级: 学号: 姓名: 日期: 实验报告
铝锌合金样品的质量m ____________________ g 反应前量气管中液面位置V1 mL 反应后量气管中液面位置V2 V1 - V2
大气压P
室温T
T时的饱和水蒸汽压
氢气的物质的量n(H2)
合金中铝的质量分数
合金中锌的质量分数
问题讨论 mL kPa __________________ K mol % %
专业: 班级: 学号: 姓名: 日期:
实验四 化学反应速率、反应速率常数及活化能的测定 在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 计算将20mL 0.20mol·L1(NH4)2S2O8溶液和10mL 0.20mol·L1 KI溶液混合后,各自的--
初始浓度变为多少?
2.下列操作会对实验有无影响?
a) 取用试剂的量筒没有分开专用;
b) 先加入(NH4)2S2O8溶液,最后加入KI溶液;
c) (NH4)2S2O8溶液缓慢加入到KI等混合溶液中;
3.为什么在实验编号Ⅱ、Ⅲ和Ⅳ、Ⅴ为的实验中分别加入(NH4)2SO4(0.2mol·LKNO3(0.2mol·L1)溶液? --1)和
4.本实验设计中,如何巧妙地用平均速率近似代替瞬时速率而不引起较大误差?
7
专业: 班级: 学号: 姓名: 日期:
实验报告
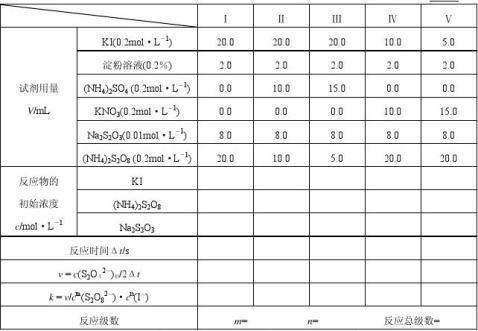
1.浓度对反应速率的影响,反应级数的测定
算出各次实验的反应速率填入下表中,并求出反应级数和速率常数k。
2.温度对反应速率的影响,活化能的测定
实 验 编 号 反应温度 /℃
Ⅰ
Ⅱ
Ⅲ
Ⅳ
反应时间Δt/s 反应速率常数k 反应活化能Ea/kJ ·mol-1
3. 催化剂对反应速率的影响
实 验 编 号
Ⅰ
Ⅱ
Ⅲ
加入Cu(NO3)2的滴数反应时间Δt 结论
8
专业: 班级: 学号: 姓名: 日期:
实验五 乙酸离解常数的测定及缓冲溶液的性质
在阅读实验内容之后,进入实验室之前,请完成以下习题。
θ1. 若改变被测乙酸溶液的浓度,解离度α和解离常数Ka如何改变?
2. 测定醋酸电离度和电离常数的实验中,为什么要记录室温?
3. 用pH计测定不同浓度乙酸溶液pH值时,为什么要按从稀到浓的顺序?
4. 关于pH电极(玻璃电极或复合电极),下列说法哪一条是错误的?
A.电极的敏感玻璃泡有轻微的破损或擦伤对其性能无影响
B.电极不可长期浸在蒸馏水、蛋白质溶液和酸性氟化物溶液
C.电极在长期未使用后再次使用前需活化
D.电极测量后,应及时清洗并保护放置
9
专业: 班级: 学号: 姓名: 日期:
实验报告
1. 乙酸溶液浓度的测定
表8-1 乙酸溶液浓度的测定
实验序号c(NaOH)/mol·L-1
滴定前滴定管内液面的读数V0滴定后滴定管内液面的读数V1/mL c(NaOH)溶液的用量V/mL c(HAc)/mol·L-1
测定值 平均值
2. 配制HAc系列标准溶液,依次测定不同浓度乙酸溶液的pH值,并填入下表。 HAc标准溶液的浓度mol·L-1 实验温度t= ℃
编号
V (HAc)
/mL
V(H20)/mL
c (HAc)/mol·L-1
溶液pH
c (H+)/mol·L-1
解离度
θ解离常数Ka
α
θ (平均) = K
3.缓冲溶液的配制
缓冲溶液缓冲对
10
各组分体积(mL)实测值)
专业: 班级: 学号: 姓名: 日期:
4.缓冲溶液的性质
溶液1pH=4的缓冲溶液
用量/mL
加入酸(碱、蒸馏水)的量2
ΔpH
10滴0.1mol.L-110滴0.1mol.L-1 NaOH 25毫升蒸馏水
pH=9的缓冲溶液 10滴0.1mol.L-110滴0.1mol.L-1 NaOH 25毫升蒸馏水
68毫升0.1mol.L
1
-
10滴0.1mol.L-110滴0.1mol.L-1 NaOH
HAC溶液和12毫升
蒸馏水
12毫升0.1mol.L
1
-
10滴0.1mol.L-110滴0.1mol.L-1 NaOH
NaAc和68毫升蒸馏
水混合
讨论:1、缓冲溶液有何重要性质?
2、单一HAc或NaAc溶液有无缓冲能力?HAc-NaAc混合液有无缓冲能力?为什么?
11
专业: 班级: 学号: 姓名: 日期:
12
专业: 班级: 学号: 姓名: 日期:
实验六 沉淀溶解平衡
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 沉淀生成的条件是什么?
2. 沉淀转化的原理是什么?
3. 试述利用沉淀反应进行离子分离的原理?
4. 试管实验中,如何正确使用滴管?离心时能否使用试管?离心管能否直接放在火上加
热?
5. 如何进行沉淀的洗涤?
6. 试管实验中的“滴加”与“加入”操作的区别是什么?在分步沉淀实验中,若不“逐滴
加入(滴加)”而是“加入”沉淀剂,实验现象会如何?
13
专业: 班级: 学号: 姓名: 日期: 实验报告
1. 沉淀的生成
沉淀的颜色:PbI2;;Ag2CrO4;
(1)沉淀的生成①
实验现象:
反应式:
解释或结论:
(1)沉淀的生成②
实验现象:
反应式:
解释或结论:
(2)分步沉淀
实验现象:
反应式:
解释或结论:
2. 沉淀的溶解
沉淀的颜色:CaC2O4;;
CuC2O4;Ag2
(1)酸度对沉淀─溶解平衡的影响
实验现象:
反应式:
解释或结论:
(2)配位反应对沉淀─溶解平衡的影响①
实验现象:
反应式:
14
专业: 班级: 学号: 姓名: 日期: 解释或结论:
(2)配位反应对沉淀─溶解平衡的影响②
实验现象:
反应式:
解释或结论:
(3)氧化还原反应对沉淀─溶解平衡的影响
实验现象:
反应式:
解释或结论:
(4)沉淀的转化
实验现象:
反应式:
解释或结论:
3.利用溶度积原理分离Mn2和Cu2离子 ++
写出分离与鉴别过程的方案,并用溶度积与平衡移动原理说明分离Mn2和Cu2离子的实验++
原理
15
专业: 班级: 学号: 姓名: 日期: 在阅读“无机化学实验”(武大)P188实验内容之后,向实验员领取可能含有Mg2、Ca2和++Ba2的未知液进行分离鉴定。 +
写出以上Mg2、Ca2和Ba2的分离和检出操作过程示意图:
+++
未知液实验报告
______号未知液含_______________________________离子
16
专业: 班级: 学号: 姓名: 日期:
实验七 配位反应和配位平衡
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 配离子与简单离子有何区别?如何证明?
2. 向NiSO4溶液中逐滴加入NH3·H2O,为什么会发生颜色变化?如加入丁二酮肟又有何变
化,说明了什么?(试用螯合效应说明现象)
实验报告
1. 配合物的生成
(1)简单离子与配离子的区别
实验现象与反应式:NiSO4 + BaCl2 = 沉淀的颜色 NiSO4 + NaOH = 沉淀的颜色
NiSO4 + NH3·H2O = 沉淀的颜色
溶于6 mol·L-1 NH3·H2O后得到溶于浓NH3·H2O后得到颜色溶液,然后分别加入BaCl2出现 ;加入NaOH出现 解释或结论:
(2)有色配离子的生成
2[Cu(NH3)FeF3 配离子的颜色:Fe(SCN)3 4] +
[Ag(NH3)2] K2 Na[Co(NO2)6] ;Fe(C2O4)33 ;+-
2. 配位平衡与介质的酸碱性
(1) pH值升高对配位平衡的影响
实验现象:
反应式:
解释或结论:
(2)pH值降低对配位平衡的影响
17
专业: 班级: 学号: 姓名: 日期: 实验现象:
反应式:
解释或结论:
实验现象:
反应式:
解释或结论:
3. 配位平衡与沉淀反应
实验现象:
反应式:
解释或结论:
写出以下一系列变化的反应方程式,并用化学平衡移动原理解释原因,比较Ag(NH3)2与Ag(S2O3)23稳定性的大小。 -+
AgCl →Ag(NH3)2 → AgBr → Ag(S2O3)23 →AgI +-
反应式:
解释或结论:
4. 配位平衡与氧化还原反应
实验现象:
反应式:
解释或结论:
5. 配合物的转化
实验现象:
反应式:
解释或结论:
6. 鳌合物的生成
实验现象:
反应式:
解释或结论:
18
专业: 班级: 学号: 姓名: 日期:
实验八 三草酸根合铁(III)酸钾的制备及组成的测定 在阅读实验内容之后,进入实验室之前,请完成以下习题。
4. 在三草酸根合铁(III)酸钾制备的实验中:
① 加入过氧化氢溶液的速度过慢或过快各有何缺点?用过氧化氢做氧化剂有何优越
之处?
② 最后一步能否用蒸干溶液的办法来提高产率?
③ 能否直接由Fe3制备K3[Fe(C2O4)3]?查阅资料后回答。 +
5. 影响配合物稳定性的因素有哪些?
6. 根据三草酸根合铁(III)酸钾的性质,该化合物应如何保存?
19
专业: 班级: 学号: 姓名: 日期: 实验报告
1. 三草酸合铁(III)酸钾的制备
简要写出制备步骤及反应方程式。
2.产品的光敏试验
实验现象:
反应式:
解释或结论:
3.配合物的性质
(1)确定配合物的内外界
实验现象:
反应式:
哪种离子在外界: 。综合实验现象,确定所制得的配合物中哪种离子在内界: ,
(2)酸度对配位平衡的影响
实验现象:
反应式:
解释或结论:
实验现象:
反应式:
解释或结论:
(3)沉淀反应对配位平衡的影响
实验现象:
反应式:
解释或结论:
(4)配合物相互转化及稳定性比较
实验现象:
反应式:
实验现象:
反应式:
综合以上实验现象,定性判断配位体SCN、F、C2O42、CN与Fe3配位能力的强弱。 ----+
20
专业: 班级: 学号: 姓名: 日期:
实验九 氧化还原反应和原电池
在阅读实验内容之后,进入实验室之前,请完成以下习题。
1. 如何判断氧化还原反应进行的方向?一定温度下,影响氧化还原反应方向的因素有哪
些?
2. 从KMnO4、H2O2、K2Cr2O7 、Cl2中选一个最佳试剂,实现PbS→PbSO4转化,并说明理
由。(选做)
3. 介质酸度对KMnO4的氧化还原产物有何影响?如何用实验证明?
4. Cu-Zn原电池由哪几部分组成?写出两电极反应及电池反应。
21
专业: 班级: 学号: 姓名: 日期: 实验报告 1.原电池电动势的测定
电极
负极( 电极) 原电池电动势/V 加入试剂
正极( 电极)
比较以上三次测量的结果,说明浓度对电极电势的影响。
2.电极电势与氧化还原反应的自发方向
根据(1)、(2)和(3)的实验现象以及三个电对的标准电极电势,说明电极电势与氧化还原反应自发进行方向的关系。
3.影响氧化还原反应的因素
(1)介质酸度对氧化还原反应方向的影响
实验现象:
反应式:
解释或结论:
(2)介质酸度对氧化还原反应产物的影响
实验现象:
反应式:
解释或结论:
22电动势变化
专业: 班级: 学号: 姓名: 日期:
(3)沉淀反应对氧化还原反应的影响
实验现象:
反应式:
解释或结论:
(4)配位反应对氧化还原反应的影响
实验现象:
反应式:
解释或结论:
与实验2(1)的结果比较,并加以解释。
4.常见氧化剂、还原剂的反应
(1)H2O2的氧化、还原性
实验现象:
反应式:
实验现象:
反应式:
(2)KI的还原性
实验现象:
反应式:
(3)过二硫酸铵的氧化性
实验现象:
反应式:
(4)K2Cr2O7的氧化性
实验现象:
反应式:
(5) Fe(III)的氧化性
实验现象:
反应式:
实验现象:
反应式:
23
专业: 班级: 学号: 姓名: 日期:
24
专业: 班级: 学号: 姓名: 日期:
实验十 常见P区元素反应及未知液分析
在阅读“无机化学实验”(武大)P193实验29~实验32内容之后,进入实验室之前,请完成以下习题。
1. 向未知液中加AgNO3,如果没有沉淀产生,能否认为溶液中不存在卤素离子?
2. H2S 、Na2S 、Na2SO3的溶液放置久了,会发生什么变化?如何判断变化情况?
3. 在氧化还原反应中为什么一般不用硝酸、盐酸作为反应的酸性介质?在哪种情况下可以
用它们作酸性介质?
25
专业: 班级: 学号: 姓名: 日期: 阅读“普通化学实验”(农大)P77实验14~实验15内容(“无机化学实验”(武大)P242实验39)之后,向实验员领取可能含有SO42、Cl和CO32等阴离子的未知液进行分离鉴定。 ---
实验报告
1.初步试验 试液号;试液的颜色: 试验项目 现象
肯定存在
溶液酸碱性试验
BaCl2的试验
AgNO3试验
氧化性阴离子
试验
还原性阴离子
试验
初步试验结果
肯定存在的离子: 否定离子: 待检离子:
----离子存在情况 肯定不存在 可能存在 注:初步试验不能否定CO32,NO3,所以待检离子应包括CO32,NO3。
2.阴离子的个别鉴定
3.阴离子未知液实验报告
______号未知液含_______________________________离子
26
专业: 班级: 学号: 姓名: 日期:
实验十一 常见D区元素反应及未知液分析
在阅读“无机化学实验”(武大)P228实验36~实验38、实验40~实验41内容之后,进入实验室之前,请完成以下习题。
1. 试分析Cu(Ⅰ)和Cu(Ⅱ),Hg(Ⅰ)和Hg(Ⅱ)各自稳定存在和相互转化的条件。
2. 哪几种氧化剂可以将Mn2+氧化成MnO4?实验中为什么Mn2+不能过量?写出各自反应-
式。
3. 设计方案:用简便方法分离溶液中Fe3+、Co2+、Ni2+ 离子。
27
专业: 班级: 学号: 姓名: 日期: 阅读“普通化学实验”(农大)P84实验16~实验17内容之后,向实验员领取可能含有Fe3+、Mn2+、Cu2+等阳离子的未知液进行分离鉴定。
实验报告
1. 初步试验 试液号 试验项目 现象
肯定存在
试液pH
水解试验:
盐酸试验:
氨水试验:
(NH4)2SO4试验:
CdS试验:
初步试验结果
肯定存在的离子: 否定离子: 待检离子:
++离子存在情况 肯定不存在 可能存在 注:初步试验不能鉴定NH4,所以待检离子应包括NH4离子。
2.阳离子个别检定
3.阳离子未知液实验报告
______号未知液含_______________________________离子
28
-
预习报告与实验报告要求
预习报告与实验报告要求预习要求1.课前必须认真预习将要做的实验。认真看理论课讲义与实验指导教材,了解实验要点(包括实验原理、实验方…
-
实验预习报告格式
验证性实验预习报告格式手写电子科学与工程系实验预习报告课程名称实验教师预习成绩专业班级实验地点实验日期学生姓名学号同组者姓名实验项…
-
预习报告格式
预习报告格式学生在进实验室之前必须仔细阅读实验书中有关的实验及基础知识明确本次实验中测定什么量最终求算什么量用什么实验方法使用什么…
-
实验预习报告
盐酸氯化铵混合溶液各组分含量的测定1引言目前国内外测定盐酸氯化铵混合溶液中各组分含量的方法有三种第一种方案是蒸汽法即取一份混合溶液…
-
金属材料实验预习报告
材料成分和热处理工艺对钢组织与性能的影响实验预习报告材科1104张明康一实验目的1了解热处理设备和几种热处理工艺的实际操作2了解材…
-
预习报告与实验报告要求
预习报告与实验报告要求预习要求1.课前必须认真预习将要做的实验。认真看理论课讲义与实验指导教材,了解实验要点(包括实验原理、实验方…
-
实验报告范本
学生实验报告书实验课程名称开课学院指导教师姓名学生姓名学生专业班级200200学年第学期实验教学管理基本规范实验是培养学生动手能力…
-
实验报告范本
华侨大学工学院实验报告课程名称实验项目名称学院专业班级姓名学号指导教师年月日预习报告一实验目的二实验仪器三实验原理预习报告四实验内…
-
大学物理实验报告模板.
学院物理系大学物理学生实验报告实验项目实验地点班级姓名座号实验时间月物理系编制实验预习部分一实验目的二实验仪器设备三实验原理2实验…
-
实验报告模板
体育测量与评价实验报告模板课程名称体育测量与评价实验名称ISAK全套人体测量指标共39项测试一预习报告1实验目的通过实验强化体格及…
-
有机化学实验预习报告模板
有机化学专业实验预习报告模板带气体吸收的回流装置分液蒸馏装置及操作四主要仪器及装置如回流装置加热套100mL圆底单口烧瓶球形冷凝管…