循环伏安法实验报告
直流循环伏安法
一、实验目的
1.掌握用循环伏安法判断电极过程的可逆性。
2.学会使用电化学工作站测定循环伏安曲线。
3.学会测量峰电流和峰电位。
二、实验原理
循环伏安法是在工作电极上施加一个线性变化的循环电压来记录电流随电位的变化曲线,施加的电压为等边三角波或等边阶梯波,电位可向阳极方向扫描,也可向阴极方向扫描。 它能在很宽的电位范围内迅速观察研究对象的氧化还原行为。
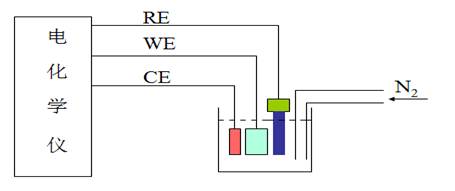
图为电化学实验装置图
RE﹑WE﹑CE分别为参比电极、工作电极和对电极
采用三电极体系,分别为参比电极、工作电极和对电极。仪器输出的电信号加到工作电极和对电极上,被研究的物质在工作电极上发生电化学反应。辅助电极与工作电极连成通路, 反应的电流通过工作电极和对电极。参比电极用于稳定工作电极的电位并确定电流-电势曲线中的峰电位、半波电位等。
若溶液中存在氧化态O,电极上将发生还原反应: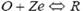
反向回扫时,电极上生成的还原态R将发生氧化反应: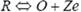
峰电流表示为:
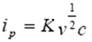
其峰电流与被测物质的浓度c、扫描速度v等因素有关。
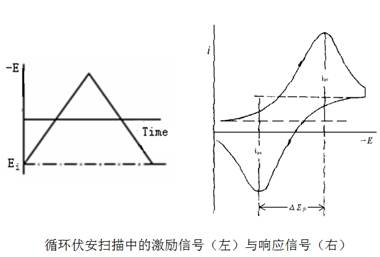
从循环伏安图可以确定氧化峰电流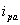 和还原峰峰电流
和还原峰峰电流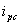 ,氧化峰电位φpa和还原峰电位φpc的值。
,氧化峰电位φpa和还原峰电位φpc的值。
对于可逆体系,氧化峰峰电流与还原峰峰电流比: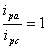
氧化峰峰电位与还原峰峰电位差: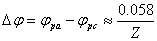 (V)
(V)
条件电位: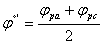 由此可判断电极过程的可逆性。
由此可判断电极过程的可逆性。
三、仪器与试剂
仪器:CHI电化学工作站440;玻碳工作电极,铂丝对电极和饱和甘汞电极。
试剂:
四、实验步骤
1.玻碳电极(金圆盘电极或铂圆盘电极)的预处理
用Al2O3粉将电极表面抛光,然后用蒸馏水清洗,用超声处理,待用。
2.K3Fe(CN)6溶液的循环伏安图
在电解池中放入配制好的K3Fe(CN)6溶液,插入玻碳工作电极、铂丝辅助电极和Ag/AgCl参比电极;以扫描速率20 mV/s,从+0.80~-0.20 V扫描,记录循环伏安图;以不同扫描速率:40、60、80、100和150 mV/s,分别记录从+0.80~-0.20 V扫描的循环伏安图。
五、实验结果与处理
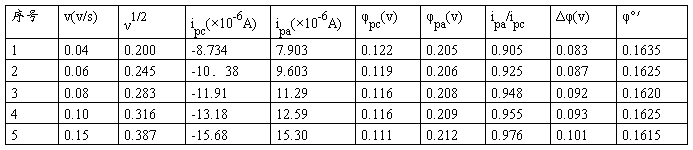
1. K3Fe(CN)6溶液的循环伏安图测定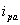 、
、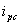 和φpa、φpc、ipa/ipc、Δφ、φ°′值下表
和φpa、φpc、ipa/ipc、Δφ、φ°′值下表
2、分别以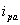 、
、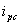 对
对 作图。
作图。
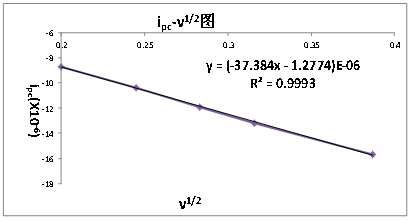

由实验结果可知,扫描速度从20, 40, 60, 80, 100, 150 mV/S增大过程其氧化还原峰电流也相应增大,选择合适的峰电流影响实验结果的准确性。对于可逆体系,氧化峰峰电流与还原峰峰电流比ipa/ipc=1:实验结果表明K3Fe(CN)6溶液中ipa/ipc≈1,所以可认为K3Fe(CN)6在KNO3溶液中电极过程可逆。
六、思考题
1.解释K3Fe(CN)6溶液的循环伏安图的形状。
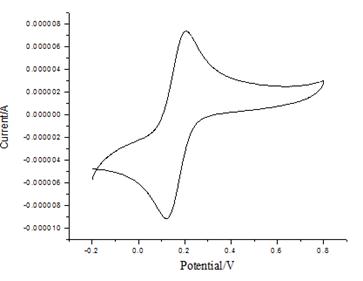
此图为扫描速度为20 mv/s时K3Fe(CN)6溶液的循环伏安图。从起始电位0.8V正向扫描到转折电位期间,溶液中Red被氧化生成Ox,产生氧化电流;当负向扫描从转折电位变到原起始电位期间,在指示电极表面生成的Ox 被还原生成Red ,产生还原电流。氧化峰和还原峰对称,氧化峰峰电流与还原峰峰电流比近似等于1,所以可认为K3Fe(CN)6在KNO3溶液中电极过程可逆。
2.如何用循环伏安法来判断极谱电极过程的可逆性。
从循环伏安图可确定氧化峰电流ipa和还原峰电流ipc,氧化峰电位φpa和还原峰电位φpc值。
对于一个体系,若氧化峰电流与还原峰峰电流比ipa/ipc的值趋1,ipa、ipc∝V1/2 ,且氧化峰电位与还原峰电位差: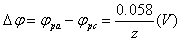 ,那么,即可认为电极过程是可逆的。
,那么,即可认为电极过程是可逆的。
第二篇:循环伏安法标定电极实验报告
循环伏安法
【实验目的】
学习和掌握循环伏安法的原理和实验技术。
了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。
【实验原理】
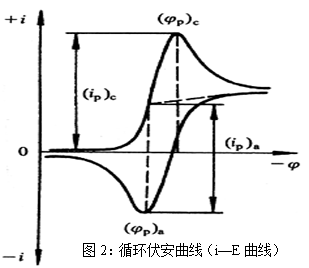 循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。一般对这类问题要根据固体电极材料不同而采取适当的方法。
对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。抛光后先洗去表面污物,再移入超声水浴中清洗,每次2?3分钟,重复三次,直至清洗干净。最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。将处理好的碳电极放入含一定浓度的K3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。如得到如图2所示的曲线,其阴、阳极峰对称,两峰的电流值相等(ipc / ipa=1),峰峰电位差ΔEp约为70 mV(理论值约59/n mV),即说明电极表面已处理好,否则需重新抛光,直到达到要求。
有关电极有效表面积的计算,可根据Randles-Sevcik公式:
在25°C时,ip=(2.69×105)n3/2ADo1/2ν1/2Co
其中A为电极的有效面积(cm2),Do为反应物的扩散系数(cm2/s),n为电极反应的电子转移数,ν为扫速(V/s),Co为反应物的浓度(mol/cm3),ip为峰电流(A)。
【仪器和试剂】
1. CHI 660D 电化学系统,玻碳电极(d = 4mm) 为工作电极,银/氯化银电极为参比电极,铂片电极为辅助电极;
2. 固体铁氰化钾、H2SO4 溶液、高纯水;
3. 100 mL 容量瓶、50 mL 烧杯、玻棒。
【实验内容】
1. 配制5 mM K3Fe(CN)6 溶液(含0.5 M H2SO4),倒适量溶液至电解杯中;
2. 将玻碳电极在麂皮上用抛光粉抛光后,再用蒸馏水清洗干净;
3. 依次接上工作电极(绿)、参比电极(白)和辅助电极(红);
4. 开启电化学系统及计算机电源开关,启动电化学程序,在菜单中依次选择Setup、Technique、CV、Parameter ,输入以下参数:

5. 点击Run 开始扫描,将实验图存盘后,记录氧化还原峰电位Epc、Epa 及峰电流Ipc、Ipa;
6. 改变扫速为0.05、0.1 和0.2 V/s,分别作循环伏安图;
7. 将4个循环伏安图叠加比较;
【数据处理】
1. 从以上所作的循环伏安图上分别求出Epc, Epa, ΔEp,ipc,ipa,ipc/ipa等参数,并列表表示。
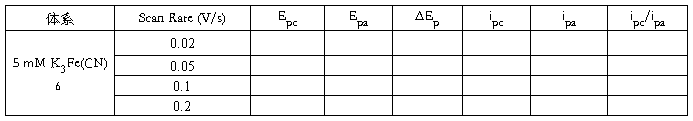
2. 在软件Origin下以氧化还原峰电流Ipc、Ipa 分别与扫速的平方根ν1/2 作图,求算线性相关系数R。
3. 根据Ipc与扫速的平方根ν1/2 作图得到的线性回归方程,计算所使用的玻碳电极的有效面积。(所用参数:电子转移数n=1,K3Fe(CN)6的扩散系数Do=1×10-5 cm2/s)
【思考题】
1. 从循环伏安图可以测定那些电极反应的参数?从这些参数如何判断电极反应的可逆性?
2. 如何判断碳电极表面处理的程度?
【小结】
1. 掌握循环伏安法的基本原理。
2. 了解如何根据峰电流、峰电位及峰电位差和扫描速度之间的函数关系来判断电极反应可逆性。
-
循环伏安法实验报告
直流循环伏安法一实验目的1掌握用循环伏安法判断电极过程的可逆性2学会使用电化学工作站测定循环伏安曲线3学会测量峰电流和峰电位二实验…
-
实验报告-循环伏安法测定亚铁氰化钾
循环伏安法测定亚铁氰化钾实验目的1学习固体电极表面的处理方法2掌握循环伏安仪的使用技术3了解扫描速率和浓度对循环伏安图的影响实验原…
-
循环伏安法实验报告
循环伏安法实验报告实验目的1了解电化学分析的工作原理发展过程掌握用循环伏安法判断电极是否可逆2学会测定循环伏安曲线3掌握循环伏安法…
-
循环伏安法实验报告
实验七循环伏安法观察FeCN6电极反应过程一实验目的1学习并理解可逆电极反应的发生条件34及抗坏血酸的2学习循环伏安法测定电极反应…
- 循环伏安法物化实验报告
-
实验报告-循环伏安法测定亚铁氰化钾
循环伏安法测定亚铁氰化钾实验目的1学习固体电极表面的处理方法2掌握循环伏安仪的使用技术3了解扫描速率和浓度对循环伏安图的影响实验原…
-
循环伏安法实验报告
循环伏安法实验报告实验目的1了解电化学分析的工作原理发展过程掌握用循环伏安法判断电极是否可逆2学会测定循环伏安曲线3掌握循环伏安法…
-
循环伏安法实验报告
实验七循环伏安法观察FeCN6电极反应过程一实验目的1学习并理解可逆电极反应的发生条件34及抗坏血酸的2学习循环伏安法测定电极反应…
- 循环伏安法物化实验报告
-
循环伏安法标定电极实验报告
循环伏安法实验目的学习和掌握循环伏安法的原理和实验技术了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法实验原理循环伏安…