无机化学读书报告

无机化学读书报告
----非金属元素小结
学 院:生化学院
班 级:化学 122班
姓 名:周慧敏
(学号12240223)
指导老师:李良超
联系方式:676601
QQ:834685726
20## 年6月 12日
非金属元素小结
姓名周慧敏(学号12240223) 化学122
[摘要]元素根据单质的性质,元素分为非金属元素和金属元素。非金属元素具有特殊的非金属性,且构成的物质数量庞大(特别是C、H、N等元素),在社会生产与教育学习中占据了重要的位置。故进行非金属元素的小结是十分必要的。本文通过非金属元素,非金属单质,非金属元素的含氧酸,非金属元素的含氧酸盐,非金属元素的碱等方面并结合元素的自身结构特征与元素之间的成建方式来解释和总结非金属元素的特性与通性。
[关键字] 元素 单质 含氧酸 含氧酸盐
[正文]
一、非金属元素的性质
1、非金属性:某种元素的原子的得电子能力。
在元素周期表中,从下到上(电子层数减小),从左到右(有效荷电荷增加),原子半径减小,得电子能力增强,非金属性增强。
2、非金属性强弱的判断
一般说来,元素的金属性越强,它的单质与水或酸反应越剧烈,对应碱的碱性也越强。元素的非金属性越强,它的单质与H?反应越剧烈,得到的气态氢化物的稳定性越强,元素的最高价氧化物所对应的水化物的酸也越强。另外根据金属或非金属单质之间的相互置换反应也可以判断元素的金属性和非金属性的强弱,进行金属性和非金属性强弱的判断。一种非金属单质能把另一种非金属单质从它的盐溶液或酸溶液中置换出来,表明前一种元素的非金属性较强。
二、非金属单质
非金属单质的化学反应
1、非金属单质与水作用
一般情况下,只有少数非金属单质与水反应
2F2+2H2O=O2+4HF
X2+H2O=HX+HXO (X2除F2外)
C+H2O(灼热)=CO+H2
2、歧化作用与逆歧化作用
由 △Gθm /F图可判断歧化与逆歧化作用的自发性:峰顶物种自发歧化;谷底物种两端自发逆歧化归中。
歧化作用
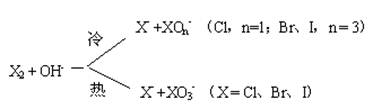
3XO-=2X-+XO3-
2ClO2+2OH-=ClO2-+ClO3-+H2O
3S+ 6NaOH=2Na2S+ Na2SO3+3H2O
逆歧化作用
(1) HXO+HX=X2+H2O
HXO3+5HX=3X2+3H2O
(2)置换出H2
对于处于金属元素与非金属元素分割线附近的不活泼非金属,如B、Si、As等能从碱中置换出H2。
Si+2NaOH+H2O=Na2SiO3+2H2
2B+2NaOH+ 2H2O=2NaBO2+3H2
2、非金属单质与酸的作用
非金属一般不与稀酸反应,C、P、S、I等能被浓H2SO4或HNO3氧化,生成相应的产物。
3、单质的制备
KF-nHF电解制F2:
负极 2F- - 2e = F2
正极 2HF2- + 2e = H2 + 4F-
NaCl溶液电解制取Cl2:
负极 2Cl- - 2e = Cl2
正极 O2 + 2H2O + 4e = 4OH-
海水制Br2: Cl2 + 2Br- = 2Cl- +Br2
3Br2 + 3CO32- = 5Br- + BrO3- +3 CO2↑
5Br- + BrO3- + 6H+ = 3 Br2 + 3H2O
海藻灰制I2: NaI + 3 H2SO4 + MnO2 = 2NaHSO4 + MnSO4 + I2 + 2H2O
自然界NaIO3中提I2:
2IO3- + 3HSO3- = I- + 3SO42- + 3H+
5I- + IO3- + 6H+ = 3I2 + 3H2O
粗I2的提纯: 3I2 + 6OH- = 5I- + IO3- + 3H2O
5I- + IO3- + 6H+ = 3I2 + 3H2O
三、非金属氧化物
非金属性强的元素大多数属于酸性氧化物。它们都是共价型的,其固体是分子晶体,具有低熔点,高沸点。一些非金属氧化物(如B2O3、SiO2)其晶体有三维网状结构,具有高熔点、高沸点,属于金属原子晶体。一些金属的高氧化数氧化物(如CrO3及Mn2O7)都是酸性氧化物。酸性氧化物除少数外(如SiO2),都可与水作用,生成相应的含氧酸。不成盐氧化物是不能与酸和碱反应生成盐和水的氧化物,一氧化碳、一氧化二氮、一氧化氮等氧化物与酸碱都不能作用生成相应的盐,故又称为不成盐氧化物(惰性氧化物)。
①同一周期最高氧化态氧化物自左至右碱性依次减弱,酸性逐渐增加。
②同一主族元素同氧化态氧化物碱性自上而下依次增强。
③ 同一元素,酸性依氧化态升高而增强。
四、非金属元素的酸
1.最高氧化态的氢氧化物的酸碱性
以R—O—H表示脱水后的氢氧化物,则在这个分子中存在着R—O及O—H两种极性键,ROH在水中有两种离解方式:
R-O-H → R+ + OH- 碱式离解
R-O-H → RO- + H+ 酸式离解
ROH按碱式还是酸式离解,与阳离子的极化作用有关,阳离子的电荷越高,半径越小,则该阳离子的极化作用越大。用Φ表示阳离子的离子势:
Φ=Z/r=阳离子电荷/阳离子半径
① Rn+的Φ值越大,即其极化作用越强,氢原子的电子云将偏离Rn+,从而使R-O键增强,RO-H 中O-H越容易离解。
② 如果Rn+ 的Φ值越小,R-O键较弱,R-OH倾向于碱式离解。
③ Φ判断酸碱性的强弱公式:
当Φ>10(或Φ>3.2)时,ROH呈酸性;
当7<Φ<10(或2.2<Φ<3.2)时,ROH呈两性;
当Φ<7(或Φ<2.2)时,ROH呈碱性。
注意:应用R-OH规则解释过渡金属阳离子的含氧酸的酸性变化规律时,以上判别就不符合实际情况了。由于离子电子层构型的不同,考虑到轨道的屏蔽作用,应采用有效离子势比较。
2.含氧酸的结构与其酸度
(1)含氧酸的结构分类
① 只有σ键的酸:具有这种结构的含氧酸HnROm,其中O原子数与H原子数相等,如HClO、HBrO等。
② 含有(p-d)π键的含氧酸:R与非羟基O原子之间是σ键和(p-d)π键。其中R原子为第三周期及以后的元素。
③ 含有多重键的酸:R一般为第二周期的元素
含有大π键的酸:第二周期的H2BO3、H2CO3、HNO3,每个R都有一个π46大π键。
(2)含氧酸中的多重键
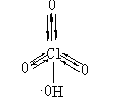 如图为HClO4的结构式:由于中心原子杂化轨道中的孤电子对与氧原子的空轨道(空出一个p轨道)形成σ键,但实验得出这些σ键的键长和键能介于单键与正常双键之间。因此,很可能在形成这种σ键的同时,氧原子上的孤电子对与中心原子上的d轨道形成d—pπ键(反馈键),即
如图为HClO4的结构式:由于中心原子杂化轨道中的孤电子对与氧原子的空轨道(空出一个p轨道)形成σ键,但实验得出这些σ键的键长和键能介于单键与正常双键之间。因此,很可能在形成这种σ键的同时,氧原子上的孤电子对与中心原子上的d轨道形成d—pπ键(反馈键),即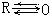 多重键(其中有两个π配键)。p-dπ反馈π键的形成是在中心原子X配出一对原子给氧原子后,由于氧原子半径较小,电荷密度增大,电子间排斥力增大,而中心原子X由于电子的配出显正氧化态,且本身有空的d轨道,在对称性匹配的条件下,可接受由氧原子p轨道反馈的电子,形成反馈的p-dπ键,使氧原子上的电子密度减少,化合物更稳定。
多重键(其中有两个π配键)。p-dπ反馈π键的形成是在中心原子X配出一对原子给氧原子后,由于氧原子半径较小,电荷密度增大,电子间排斥力增大,而中心原子X由于电子的配出显正氧化态,且本身有空的d轨道,在对称性匹配的条件下,可接受由氧原子p轨道反馈的电子,形成反馈的p-dπ键,使氧原子上的电子密度减少,化合物更稳定。
(2)含氧酸的酸度
含氧酸在水溶液中的强度取决于酸分子的电离程度,可用pKa来衡量
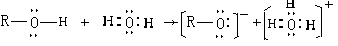
Pauling规则
①(m-n)的值越大(即非羟基氧的数目),酸性越强。
H+ 转移到H2O分子上能力取决于元素R吸引羟基氧原子的电子的能力,如果R的电负性大,R周围的非羟基原子数多(配键电子对偏向这种氧原子使R的有效电负性增强),则R原子吸引羟基氧原子的电子的能力强,从而使O—H键的极性增强,有利于H+的转移,所以,这种酸的酸性就强。含氧酸分子内脱水或分子间缩合脱水后,由于非羟基氧原子数目的增加,含氧酸酸性将增加,也是这个道理。
②多元含氧酸的分步离解常数之比为10-5即 K1∶K2∶K3……≈1∶10-5∶10-10……或pKa的差值为5。
由于每电离一个氢离子后,余下的O-H键都会由于氧上电子密度的增大而增强,更难以电离出下一个H+
契劳尼斯建议按K值将酸的强度分为四类,其中常用三类为:
强 酸: Ka ≥1,pKa ≤0
弱 酸: Ka = 10-7 ~ 1,PKa =0 ~ 7
很弱酸: Ka = 10-14 ~ 10-7,pKa = 7 ~ 14
(3)含氧酸与相应盐的稳定性的比较
含氧酸比相应盐的稳定性差,原因如下:
①H+的反极化作用,X-O键易断裂
②成盐后晶格能的稳定化作用
3、由X的含氧酸的氧化性看氧化性的强弱影响因素
㈠ H+浓度越大,氧化性越大
①XOn-+ 2ne+2nH+=X-+nH2O H+浓度越大,反应正向进行
②反应放热,有利于反应正向进行
③H+反极化作用,使X-O键易于断裂
㈡ ① HClO > HBrO > HIO
② HClO3≈ HBrO3 > HIO3
③ HClO4 < HBrO4 > H5IO6
①是由于Cl原子的电负性较大,得e更容易;②③使由于第四周期的次周期性,3d层电子云发散,有效电子势增强,吸引4S2层上的电子,4S2钻穿效应,易得电子。同样具有次周期性的还有第六周期,其中心原子的6S2 (惰性电子对)特别稳定,这些元素倾向保留6S2 电子对而处于低氧化态。
㈢ 对于Cl HClO>HClO3>HClO4
由于其氧化性的实质是X-O的断裂,X-O键越多,越难断裂,氧化性越弱。
总结:
①氧化性规律:
a. 同一周期中各元素最高氧化态含氧酸的氧化性,从左至右递增。
b. 同一主族中元素的最高氧化态含氧酸的氧化性,多数随原子序数呈锯齿形升高,第三周期元素含氧酸的氧化性有下降的趋势,第四周期元素含氧酸的氧化性又有上升趋势,有些在同族元素中居于最强地位,第六周期元素含氧酸的氧化性又比第五周期的强得多.
c.对于同种元素的不同氧化态含氧酸,低氧化态的氧化性比高氧化态的强。
②影响含氧酸及其盐的氧化能力的因素:
a. 中心原子结合电子的能力。凡电负性大、原子半径小、氧化态高的中心原子,其获得电子的能力强,表现为强的氧化性;同一周期的元素,从左至右,电负性增大,r减小,所以它们的最高氧化态含氧酸的氧化性依次递增。
b.分子的稳定性。稳定的多变价元素的含氧酸其氧化性弱
c. 其它外在因素,如溶液的酸碱性、浓度以及伴随氧化还原反应同时进行的其它非氧化还原过程(如水的生成,溶剂化和反溶剂化作用,沉淀生成,缔合等)对含氧酸的氧化性均有影响。
五、非金属元素的含氧酸盐
1.溶解性
离子化合物溶解过程:可以认为首先是克服离子间的引力。从晶格中解离下来成为气态离子,然后进入水中并与极性水分子结合成为水合离子。U越大,则溶解时被破坏晶格所需要的能量也大。电荷高,半径小,即Z/r值大的离子所形成的盐的U大;但必须同时考虑的是,这样的离子与极性水分了之间的引力也大,当Z/r增大时,究竟是U增加得多一些,还是△H增加的多一些?
一般规律是:
①阴阳离子半径相差悬殊,即 r-》r+ 时,离子水合作用在溶解过程占优势。
②阴阳离子的半径相差不大,则U的大小在溶解过程中有较大的影响,离子电荷高,半径小,离子势(Z/r)大的离子所组成的盐较难溶解。
以上是从晶格能和水合能看离子化合物的溶解性,是基于离子电荷和离子半径对离子化合物溶解性的影响,或表现为离子势(Z/r)、离子极化能力的影响,但这只考虑子影响溶解性的一个重要方面。另一主要方面为溶解熵,在溶解过程总的熵效应
△sS = △LS +△hS(△LS离子的升华熵变,△hS离子水合熵变 ) 一般说来:
①离子的电荷低,半径大,其△LS 占优势,△sS 表现为正值,△sS为正值有利于溶解。
②电荷高、半径小的离子的 △hS 占优势,大都较大负值,比较难溶。
2、热稳定性
影响含氧酸盐的热稳定性的因素很复杂,与含氧酸盐的结构、金属离子的性质都有关系。归纳起来,含氧酸盐的热稳定性有如下规律:
(1)相同金属离子与相同成氧酸元素所组成的含氧酸盐,其热稳定性相对大小为:正盐 > 酸式盐 ;不同金属离子与相同成氧酸元素所组成的含氧酸盐,其热稳定性相对大小为:碱金属盐 > 碱土金属盐 > 过渡金属盐 > 铵盐;相同金属离子与不同成氧酸元素所组成的含氧酸盐,其热稳定性取决于对应酸的稳定性,酸较为稳定,其盐也比较稳定。
(2)ⅡA族元素元素阳离子所形成的含氧酸盐,阳离子半径越大,含氧酸盐一般越稳定。
3、水解性
①水解的类型及原理
亲电水解:中心原子显正电性且有空的价轨道,可作Lewis酸,接受 H2O的O2-的进攻
亲核水解:中心原子有孤对电子,可作Lewis碱,接受H2O的H+的 进攻
亲核水解+亲电水解:中心原子既有孤对电子,又有空轨道.既可作 Lewis酸,接受H2O的O2-的进攻;又可作Lewis 碱,接受H2O的H+的进攻
②卤素与非金属元素形成的化合物的水解
a 卤素与非金属元素形成的卤化物除CCl4,CF4,NF3,SF6不水 解之外,其他的都水解。
b 多卤化物的水解(电负性大的为Y) XY+H2O=HOX+HY
六、非金属元素的氢化物
除稀有气体外,非金属元素的单质都能与氢形成氢化物,氢化物为分子晶体,通常情况下呈气态或易挥发的液态。
非金属元素氢化物规律:

注意:
① 分子型氢化物的稳定性,与组成氢化物的非金属元素的电负性(XA)有关:非金属与氢的电负性相差越大,所生成的氢化物越稳定;反之,越不稳定。
② 其还原性与氢化物的稳定性规律正好相反,稳定性大的,还原性小。如果用A表示非金属元素,n表示该元素的氧化态(最低氧化态的绝对值),氢化物的还原性来自于An-,而An-失电子的能力与其半径和电负性的大小有关。从右向左,从上而下,元素A的半径增大,电负性减小,An-失电子的能力依上述方向递增,所以氢化物的还原性也按此方向增强。
③ 从质子理论看,物质之所以为酸和碱,同它在溶剂中能否给出H+或接受H+ 有关,电负性较大的非金属其对H+的一般吸引力大,溶液中的H+的浓度小。
④ 共价氢化物的熔点沸点,除由于F,O,N的电负性比较大,使HF,H2O,NH3易产生氢键而造成它们的熔沸点异常偏高外,
七、P区元素周期性变化的某些特殊性
1、第二周期p区元素的特殊性
①第二周期元素的某些单键键能比同族第三周期元素的反常地小。原因是它们的原子半径小,排斥作用大。
②最高配位数——它们的最高配位数为4,而第3周期和以后几个周期的元素的配位数可以超过4;
③形成π键和氢键的能力——B、C、N、O原子可以形成π键,N、O、F的含氢化合物易生成氢键,离子性较强;
④单键和多重键的键能。元素有自相成链的能力,以碳元素最强;多数有生成重键的特性;
第四周期P区元素的不规则性
2、第四周期p区元素,经过d区长周期中的元素,此外成增加了10个d电子,次外层结构是3s23p63d10,由于d电子屏蔽核电荷能力比同层的s、p电子的要小,这就使从Ga→Br,最外层电子感受到有效核电荷Z*比不插入10个d电子时要大,导致这些元素的原子半径和第三周期同族元素相比,增加幅度不大。由原子半径引起的这些元素的金属性(非金属性)、电负性、氢氧化物酸碱性、最高氧化态含氧酸(盐)的氧化性等性质都出现反常现象,即所谓“不规则性”。
最突出反常性质是这些元素最高氧化态化合物(如氯化物、含氧酸及其盐)的稳定性小,而氧化性则很强。如ⅦA高溴酸(盐)氧化性比高氯酸(盐)、高碘酸(盐)强得多。导致第四周期p区元素性质不规则性的本质因素是因为第三周期过渡到第四周期,次外层电子从2s22p6变为3s23p63d10,第一次出现了d电子,导致有效核电荷Z*增加得多,使最外层的4s电子能级变低,比较稳定。
3、惰性电子对效应
周期表中P区下方的金属元素,即第六周期的Tl;Pb;Bi;Po在化合物中的特征氧化态应依次为+Ⅲ;+Ⅳ;+Ⅴ和+Ⅵ,但这四种元素的氧化态表现反常,它们的低氧化态化合物,即Tl(Ⅰ);Pb(Ⅱ);Bi(Ⅲ);Po(Ⅳ)的化合物最稳定.长期以来,学者们认为这是由于这四种元素存在6S2惰性电子对之故,这种现象为西奇威克最先注意到,并称之为”惰性电子对效应”.
产生惰性电子对效应,原因是多方面的,仅从结构上考虑主要有:①从第四周期过渡到第五周期,原子的次外层结构相同,所以同族元素相应的化合物性质改变较有规律。②从第五到第六周期,次外电子层虽相同,但倒数第三层电子结构发生改变,第一次出现了4f电子,由于f电子对核电荷的屏蔽作用比d电子更小,以使有效电荷Z*也增加得多,6s2也变得稳定,所以第六周期p区元素和第五周期元素相比,又表现出一些特殊性。
[参考文献]
[1]蔡少华 黄坤耀 张玉容,元素无机化学[M].广州中山大学出版社,1998: 11-12 18 26-29 52--53
[2] 袁亚丽 周德凤,无机化学[M].武汉:华中科技大学出版社,2007: 269-271
-
绿色化学读书报告
绿色化学读书报告绿色化学与可持续发展学院环境与土木工程学院学号20xx03040516姓名郭凯彬指导老师王瑞麟摘要绿色化学是一门从…
-
化学读书报告
教材241大气污染和环境化学的拓展读书报告参考书目中国碳捕集利用与封存技术发展路线图研究环境问题是当前世界面临的重大问题之一酸雨全…
-
无机化学读书报告
无机化学读书报告非金属元素小结学院生化学院班级化学122班姓名周慧敏学号12240223指导老师李良超联系方式676601QQ83…
-
化学读书报告
化学简史读书报告这个暑假我阅读了英柏廷顿所著的化学简史这本书分为十六章第一章应用化学的起源第二章化学的初期第三章炼金术的传布第四章…
-
胶体化学读书报告
胶体化学读书报告化学生物与材料科学学院化学工程与工艺胶体化学读书报告不经意间一年的物理化学课程的学习即将结束这门课对我来说意义深大…
-
齐齐哈尔大学化工学院化学系专业实验无机化学实验报告三草酸和铁
齐齐哈尔大学实验报告题目:三草酸和铁(Ⅲ)的制备和组成的测定学院:化学与化学工程学院专业班级:化学091学生姓名:张淑贤同组者姓名…
- 无机化学实验报告模板新
- 无机化学实验报告-part1
-
无机化学实验报告格式
无机化学实验报告格式无机化学实验一般都被设置成大学一年级的课程对于新入大学的学生要想完成一份满意的实验报告真是有一定的难度另外由于…
-
无机化学实验报告
湖北工程学院化学与材料科学学院无机化学实验报告20xx实验3p区非金属元素II氮族硅硼何艳仅修改版面格式未修改内容学号012301…
- 化学研究性学习报告