实验九 EDTA标准溶液的配制与标定
实验七 EDTA标准溶液的配制与标定
一、实验目的
1、掌握EDTA标准溶液的配制与标定
2、掌握使用铬黑T指示剂的条件和正确判断终点的方法
二、实验原理
EDTA是常用的螯合滴定剂,常用Zn,ZnO,CaCO3等基准物来标定其准确浓度。为了减少测定误差提高分析结果的准确度,尽可能使标定条件与测定条件一致。如测定Ca2+、Mg2+,可用CaCO3为基准物标定,指示剂用铬黑T,在pH为10的氨性缓冲液中进行标定。为提高滴定终点变色的敏锐性,在氨性缓冲液中加入一定量的MgY2-。滴定过程如下:
滴 定 前:Ca2+ + MgY2- = CaY2- + Mg2+
Mg2+ + EBT = Mg-EBT (酒红色)
滴 定 中:Ca2+ + H2Y2- + 2OH- = CaY2- + 2H2O
滴定终点:Mg-EBT + H2Y2- + 2OH- = MgY2- + 2H2O + EBT (纯蓝色)
当溶液颜色由酒红色恰好变为纯蓝色时,表示滴定终点到达。加入的MgY2-,最后还是生成等量的MgY2-,对滴定的结果无影响。
三、试剂
Na2H2Y?2H2O;CaCO3(A.R)120℃干燥2h,置干燥器备用;EBT指示剂:0.5g铬黑T加75 ml三乙醇胺,25ml乙醇溶解而成;1﹕1HCl溶液;氨性缓冲液(pH≈10):54g的NH4Cl溶于少量水中,加394ml浓氨水,加入按下法配好的MgY溶液,加水稀释至1升。
MgY盐的配制:称0.25g的MgCl2?6H2O于烧杯中,用少量水溶解后转移入100ml容量瓶,加水至刻度,摇匀。准确吸取50.00ml于锥瓶,加5ml NH3-NH4Cl缓冲液,4~5d EBT指示剂,用0.02mol/L的EDTA溶液滴定至溶液由酒红色变为纯蓝色,记下所消耗的EDTA体积V。取Vml EDTA加入容量瓶剩余的镁溶液中,摇匀,即MgY溶液。将此溶液全部倒入上述缓冲液中。
四、实验步骤
1、0.01 mol/L EDTA溶液的配制 称取2g的EDTA于小烧杯中,加入少量水,加热溶解后,稀释至500ml,贮于塑料瓶中。
2、EDTA溶液的标定 准确称取CaCO3约0.25~0.30g一份,于250ml烧杯中,用少量水润湿,盖上表面皿,从烧杯嘴慢慢滴入10ml 1﹕1的HCl溶液,轻摇,待完全溶解后,小心加热至沸1min,置冷,用少量水清洗表面皿底部和烧杯内壁。完全移入250ml容量瓶中,定容,摇匀,备用。
用移液管准确吸取20.00ml Ca2+溶液三份,各于250ml的锥瓶中,一一加20ml水,10ml氨性缓冲液,4~5d EBT,用EDTA溶液滴定之,终点颜色:酒红色恰好变为纯蓝色。记下消耗的EDTA体积V,按下式求出其浓度。
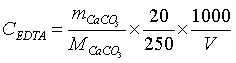
三次测定结果相对平均偏差应小于0.2%。
五、思考题
1、本次实验为什么要加入氨性缓冲液?NH3-NH4Cl起什么作用?MgY盐起什么作用?能否用HAc-NaAc代替NH3-NH4Cl?
2、用1﹕1的HCl溶液溶解固体CaCO3时,为什么要盖上表面皿?之后为什么要用水清洗表面皿底部和烧杯内壁?
实验八 水样的总硬度测定
一、实验目的
1、学习Ca2+、Mg2+共存时分别测定Ca2+、Mg2+含量的方法。
2、学习利用配位滴定原理测定水样的总硬度的方法。
3、进一步熟悉配位滴定的过程和指示剂的应用条件及终点变化。
二、实验原理
水中Ca2+、Mg2+含量是计算水硬度的主要指标。测定水样的总硬度,就是测定水样中Ca2+、Mg2+的总含量。一般先用盐酸酸化并加热,使水样中的HCO3-分解,防止在后面加入碱时生成碳酸盐沉淀而使测量结果偏低。然后再在pH=10的氨性缓冲液中,以铬黑T(EBT)为指示剂,用EDTA标准溶液滴定至终点。
滴 定 前:Mg2+ + EBT(纯蓝色)→ Mg-EBT (酒红色)
滴定过程:Ca2+ +H2Y2- + 2OH-→ CaY2- + 2H2O
Mg2+ + H2Y2- + 2OH-→ MgY2- + 2H2O
滴定终点:Mg-EBT(酒红色)+ H2Y2- + 2OH- = MgY2- + 2H2O + EBT(纯蓝色)
其中稳定性关系:CaY2- > MgY2- > Mg-EBT > Ca-EBT
水的总硬度常以“度(°)”或“ppm”表示。1度(1°)表示在每升水中含有的Ca2+、Mg2+的总量相当于10mg CaO;1ppm 表示在每升水中含有Ca2+、Mg2+的总含量相当于1mgCaCO3。
滴定时水中微量Al3+、Fe3+的干扰可加三乙醇胺掩蔽;Cu2+、Zn2+等重金属离子的干扰可加Na2S或KCN掩蔽。
Ca2+、Mg2+共存时分别测定Ca2+、Mg2+的含量,先将水样用NaOH溶液调节pH>12(pH=12~14),此时Mg2+完全转为Mg(OH)2沉淀,但Ca2+不沉淀,加钙指示剂(NN)用EDTA标准溶液滴定至终点。
滴 定 前:Ca2+ + NN(蓝色) → Ca-NN(红色)
滴定过程:Ca2+ + H2Y2- + 2OH-→ CaY2- + 2H2O
滴定终点:Ca-NN(红色)+ H2Y2- + 2OH-→ CaY2- + 2H2O + NN(蓝色)
从EDTA标准溶液的浓度和用量计算Ca2+、Mg2+的总含量和Ca2+含量,从而求出Mg2+的含量
三、试剂
1:1HCl溶液;0.01 mol/L EDTA标准液;20%三乙醇胺水溶液;2%Na2S溶液;NH3-NH4C l缓冲液(pH=10):20g的NH4Cl溶于少量水,加100ml浓氨水(15mol/L),加水稀释至1升;0.5%铬黑T指示剂:0.5g铬黑T加75ml三乙醇胺,再加25ml无水乙醇;钙指示剂(NN):与无水Na2SO4以1﹕100比例或与NaCl以1﹕100比例混合,研磨均匀混合,贮于棕色瓶中,置干燥器。
四、实验步骤
1、水样的总硬度:水中Ca2+、Mg2+的总量测定
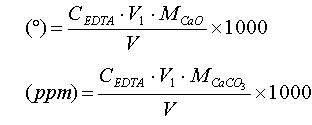 用50ml移液管吸取水样100.00ml两份于两只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化(用刚果红试纸试验,由红变蓝),微沸2min,冷却后加20%三乙醇胺溶液5ml和NH3-NH4Cl缓冲液10ml及2%Na2S溶液1ml,再加4~5d铬黑T指示剂,在相同的条件下以EDTA标准溶液滴定至溶液由酒红色恰好变为纯蓝色,即为滴定终点。记录用去的EDTA体积V1,水的总硬度按下面的式子计算:
用50ml移液管吸取水样100.00ml两份于两只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化(用刚果红试纸试验,由红变蓝),微沸2min,冷却后加20%三乙醇胺溶液5ml和NH3-NH4Cl缓冲液10ml及2%Na2S溶液1ml,再加4~5d铬黑T指示剂,在相同的条件下以EDTA标准溶液滴定至溶液由酒红色恰好变为纯蓝色,即为滴定终点。记录用去的EDTA体积V1,水的总硬度按下面的式子计算:
2、水样中Ca2+、Mg2+的分别测定
另取100.00ml水样二份于二只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化,微沸2min,冷却后加20%三乙醇胺溶液5ml和10% NaOH溶液10ml,使溶液pH值达到12~14,再加约30mg钙指示剂(小心不要加得太多,先加少量,颜色不够红再加),在相同条件下以EDTA标准溶液滴定至溶液由红色恰好变为蓝色,即为滴定终点,记录用去的EDTA体积V2,每升水样中含有的Ca2+或Mg2+的毫克数按下式计算:
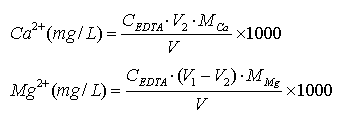
五、注释
1、一般水样的测定因干扰离子浓度很低可以不加掩蔽剂,亦可不必在滴定前酸化处理,直接加缓冲液即可滴定。
2、Mg2+的含量很低时,终点变色不敏锐,可以预先在NH3-NH4Cl缓冲液中加入适量的MgY。
3、三乙醇胺作掩蔽剂掩蔽Fe3+、Al3+,必需在酸性溶液中加入,然后再以碱调节pH值至碱性,否则达不到掩蔽效果。
4、若用KCN掩蔽Cu2+、Zn2+等离子,必须在碱性溶液中使用,若在酸性溶液中使用,则易产生挥发性的HCN剧毒气体,造成空气污染。
5、测定Ca2+时,加NaOH生成Mg(OH)2沉淀,若沉淀量多则可能吸附Ca2+,使Ca2+的测定结果偏低,此时需加入糊精或阿拉伯树胶,以消除吸附现象。糊精浓度为5%,加入约10ml,再以EDTA滴定至指示剂变蓝色。
六、思考题
1、什么叫水的硬度?水的硬度有哪几种表示方法?
2、水样滴定前为何需先用HCl酸化?
第二篇:溶液的配制与分析教案
溶液的配制与分析
(苏教版必修一)
江苏省华罗庚中学 吴风琴
一、教学设计指导思想
化学学科观念不是具体的化学知识,也不是化学知识的简单组合,而是学生通过化学学习后在头脑中建立起来的概括性认识,也就是在深入理解化学学科特征的基础上所获得的对化学的总括性认识。基于学科观念的教学有利于促进学生化学学科素养的全面发展。化学基本观念的形成既是认知性的,也是体验性的。教师全面把握化学课程中的学科观念体系,并进行基于观念建构的学科教学,能够使学生亲身体验化学知识的发现过程和应用价值,感悟化学知识中蕴含的思想、观点和方法,从而实现化学学科素养的全面提升。本节课我在设计的时候也是力争从学生已有的知识储备,设计出不同的有价值的且有梯度的问题,使学生主动参与、互相合作、积极探究,在讨论、评价、实验等方式中促进学生在课堂中构建自己的知识体系,发展探究思维能力。
二、教学设计方案
1、课题:苏教版必修一第一专题第二单元溶液的配制与分析、吴风琴
2、课程标准、教材以及学生分析:课程标准中对本节内容有这样具体要求,认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。配制一定物质的量浓度溶液是学生掌握的第一个定量研究实验,为培养学生用数学思想解决化学问题的能力有重要作用。同时,在内容上承前启后,既是对初中溶液知识的继续与延伸,又是对新学物质的量等化学基本概念的巩固和应用,还可为整个高中化学计算奠定基础。学生在初中已学习了溶液、溶质、溶剂、饱和溶液、不饱和溶液、溶解度和溶质质量分数的概念,了解溶液组成,会进行简单计算;在能力方面。学生思维活跃,求知欲强,具备一定的观察能力、动手能力、理解能力和逻辑思维能力,有一定的实验操作能力和探究能力,会配制一定溶质质量分数的溶液,但探究问题的能力不够均衡,探究问题方法单一,有待在学习中逐渐培养。
3、教学目标:
(1)理解物质的量浓度的概念,使学生掌握配制一定物质的量浓度溶液的方法,认识一种新的仪器容量瓶。
(2)通过教学培养学生的观察能力、实验设计能力以及动手操作能力。
(3)通过学习培养学生独立思考、细致严谨的科学态度以及合作精神。
4、教学重难点:
重点:物质的量浓度概念的建立和理解;一定物质的量浓度溶液的配制方法。
难点:一定物质的量浓度溶液的配制方法。通过类比初中一定质量分数溶液配制的方法逐步突破配制中需要解决的问题,并加深对溶液浓度概念的理解。
5、教学流程图





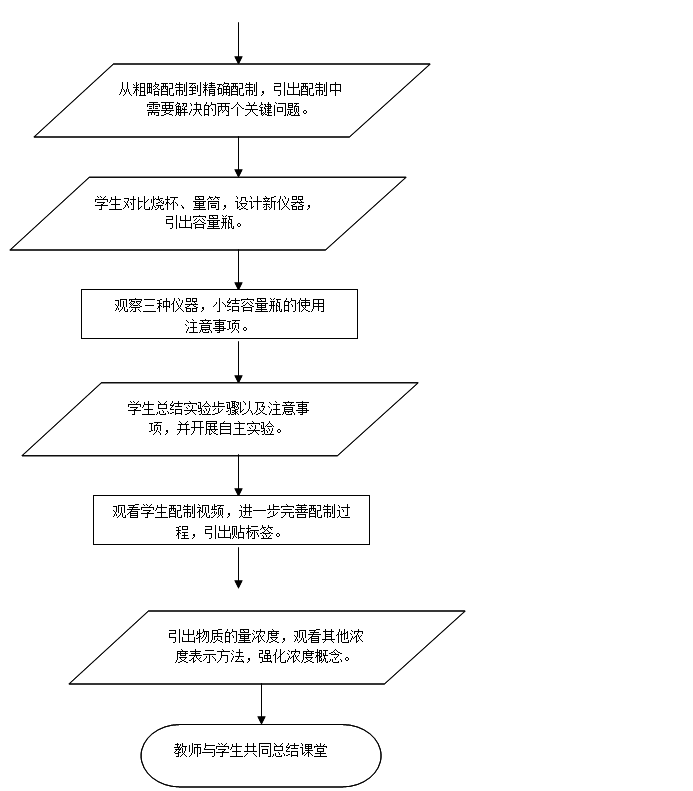
6、教学过程

7、教学设计反思
采用的方式尽量符合探究性学习的教学方式,对于新的化学概念讲授,不是以自己的讲授为主,而是采取层层引入问题情境,使学生处于不断的思考中,在学生的思考讨论中,引出本堂课的核心知识,通过学生的讨论解决教学的重点和难点。使学生在一种轻松的氛围中掌握了物质的量浓度的概念、意义,以及配制一定物质的量浓度的溶液的实验方法,从而完成了本堂课的三维教学目标。设计的问题情境应当更巧妙,从粗略配制100ml含氯化钠0.02mol的溶液,到标签的书写,不仅仅要在形式上起一种过渡作用,更是将学生的思考引入新的方向,解决教学重难点。在学生讨论实验方案和在实验过程中,应当能够敏锐的抓住学生暴露的问题,从学生暴露的问题入手,以讨论的形式和同学一起分析,解决了实验的总体设计思路问题,并且也解决了哪些因素影响溶液精确性等问题。比以往这些问题教师进行集中讲授学生更加容易理解,更容易感受到注意实验细节的必要性。
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验:EDTA标准溶液的配制与标定
配位滴定法EDTA005molL标准溶液的配制与标定一实验目的1了解EDTA标准溶液的配制和标定原理2掌握常用的标定EDTA的方法…
-
实验六 EDTA标准溶液的配制与标定(上课)
实验六EDTA标准溶液的配制与标定一实验目的1掌握配位滴定的原理了解配位滴定的特点2学会EDTA标准溶液的配制标定及稀释3学会铬黑…
-
下周实验 EDTA标准溶液的配制与标定
EDTA标准溶液的配制与标定实验目的1掌握EDTA标准溶液的配制与标定方法2学会判断配位络合滴定的终点3了解缓冲溶液的应用4进一步…
-
粗盐的提纯与溶液配制实验报告
粗盐的提纯实验报告班级姓名实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理3体会过滤的原理在生活生等社会…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…