6.9.4.1医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度
为加强医院医疗器械不良反应监测管理工作,依据国家《医疗器械监督管理 条例》、《医疗器械不良反应事件监测和再评价管理办法(试行)》结合我院印发《九师医院医疗安全(不良)事件报告制度》制定本制度。
一、 建立健全组织机构,明确岗位职责
(一)、成立医疗器械不良反应监测管理小组 ,协助医院医疗安全(不良)事件报告领导小组负责全院医疗器械不良事件监测管理相关工作,规范医院医疗器械不良事件的管理与监控工作。
组长:赵雪峰 职务:设备科长
联络员成员:郭玉 设备科维修员
管理小组在医院医疗安全(不良)事件报告领导小组领导下履行职责:
(1) 负责医院医疗器械不良事件监测管理工作的规划和相关制度的制定、 修改、监督和落实:
(2) 负责医院医疗器械不良事件监测管理的宣教工作及培训,
(3) 研究分析医疗器械不良事件监测管理工作的动态和存在的问题,负责定期组织召开日常监测工作总结会议,传达及记录会议内容,讨论并提出改进意见和建议。
(4) 制定和完善高风险医疗器械使用的操作规程,组织培训员工在使用高风险医疗器械时规范操作。
(5) 制定突发、群发的医疗器械不良反应事件,尤其导致死亡或者严重伤害不良事件的应急预案。
(6) 对于上报的不良事件,于一周内协同领导小组组织讨论,制定应对措施。
(7) 通报传达上级医疗器械不良反应检测技术机构的反馈信息。
(二)、明晰职能部门分工
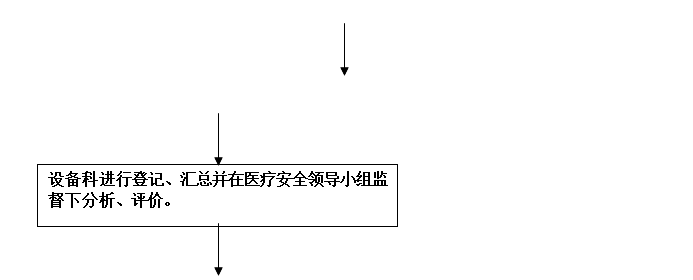
(1)、设备科负责医疗器械不良事件的日常监测工作。负责临床科室对上报的医疗器械不良事件的日常监测信息的汇总分析及评价工作。
(2)、设备科定期总结。每年1月5日前将上一年度的医疗器械不良事件监测工作的总结报告提交给九师医院医疗安全(不良)事件报告。并保存监测的原始资料备查。
(3)、相关科室设立医疗器械不良事件兼职联络员,了解本科室医疗器械使用情况,指导临床使用科室完成填写《医疗器械不良事件报告单》。按规定时间内上报。并在医院医疗安全(不良)事件报告领导小组的领导下开展工作。
二、建立医疗器械使用不良事件报告制度
1、临床使用科室发现或可疑发生医疗器械不良事件,立即填写《可疑医疗器械不良事件报告表》,报设备科。
2、设备科经调查核实后,将上报表转达医疗安全(不良)事件报告领导小组,经过分析、评价后,由设备科上报医疗器械不良事件监测部门。
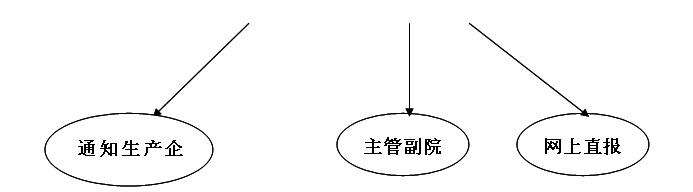
3、设备科在科室上报发生医疗器械不良事件后,对导致死亡的事件于发现或者知悉之日起5个工作日内,导致严重伤害、可能导致严重伤害或死亡的事件于15个工作日内向上级医疗器械不良事件监测技术机构报告,对突发、群发的医疗器械不良事件,立即向上级医疗器械不良事件监测技术机构报告,并在24小时内报送《可疑医疗器械不良事件报告表》
4、设备科联系告知相关生产企业。保存医疗器械不良事件监测记录,对于引起不良事件的医疗器械的监测记录保存至医疗器械上标明的使用期限后2年,并且记录保存期不少于5年。
三、制定医院医疗器械(疑是)不良事件报告流程
医院医疗器械不良事件报告流程



附件:使用科室《可疑医疗器械不良事件报告表》
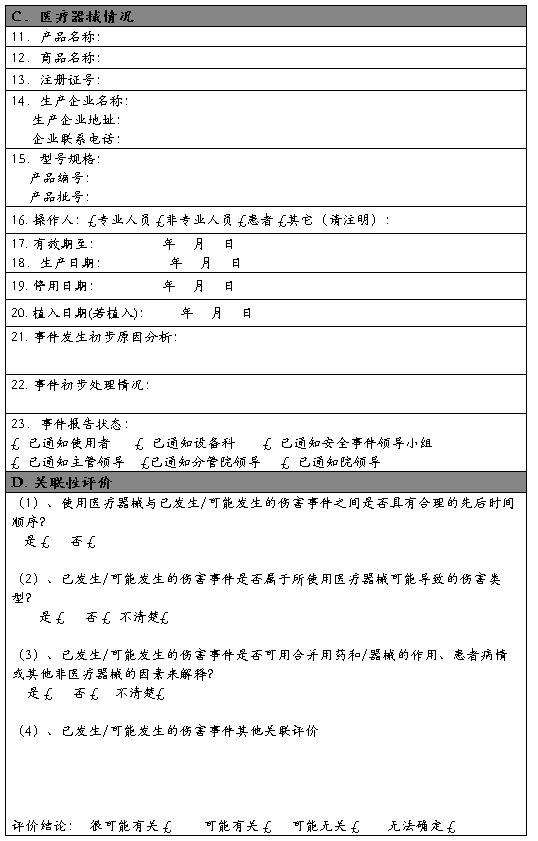
附件1:
可疑医疗器械不良事件报告表
报告日期: 年 月 日 编 码:
报告来源:奈曼旗人民医院 科室名称:
报告人签名:

第二篇:8医疗器械不良事件管理制度
文件编号:GFK ZD 008 A R00 1/4
甘肃扶康医药器械有限公司
医疗器械质量管理文件
(一)目的 为保证医疗器械安全、有效,提高医疗器械质量,特制定本质度。
(二)依据 《医疗器械监督管理条例》
(三)职责 质量管理部为企业医疗器械不良反应监测管理小组,负责收集、分析、整理,上报企业医疗不良反应信息。 (四)主要内容
1.各企业部门就注意收集正在经营的医疗器械不良反应信息,填报“不良反应报告表”,上报给质量管理小组。
2.发生医疗器械不良反应隐情不报者,根据情节轻重,查实后给予相应处罚。
-
医疗(安全)不良事件报告制度与流程
医疗安全不良事件报告制度与流程为了更好地保障医疗安全减少医疗安全不良事件确保患者安全根据卫生部二级综合医院评审标准20xx版实施细…
-
医疗安全不良事件报告制度_流程
医疗安全不良事件报告制度及流程为了更好地保障医疗安全减少医疗安全不良事件确保病人安全根据卫生部以病人为中心以提高医疗服务质量为主题…
-
医疗安全(不良)事件报告制度
医疗安全不良事件报告制度医疗安全不良事件报告是发现医疗过程中存在的安全隐患防范医疗事故提高医疗质量保障患者安全促进医学发展和保护患…
-
医疗安全不良事件主动报告制度及流程
医院医疗安全不良事件主动报告制度医疗安全不良事件报告是发现医疗过程中存在的安全隐患防范医疗事故提高医疗质量保障患者安全促进医学发展…
-
医疗不良事件报告制度与流程
医疗安全不良事件报告制度与流程为了更好地保障医疗安全减少医疗安全不良事件确保患者安全根据卫生部二级综合医院评审标准20xx版实施细…
-
20xx年医疗器械不良事件工作总结范文
20xx年度医疗器械不良事件监测工作总结——XX科20xx年,XX科在医院大力指导和器材科的重视支持下,认真总结工作经验,充分发挥…
- 医疗器械不良事件年度汇总报告表
-
上海市医疗器械不良事件年度汇总报告表
附件3上海市医疗器械不良事件年度汇总报告表报告时间年月日编码1报告人省级监测技术机构接收日期国家监测技术机构接收日期生产企业签章弗…
-
医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度为加强医院医疗器械不良反应监测管理工作依据国家医疗器械监督管理条例医疗器械不良反应事件监测和再…
-
6.9.4.1医疗器械临床使用安全事件监测管理制度、报告制度及报告表
医疗器械临床使用安全事件监测管理制度为加强医院医疗器械不良反应监测管理工作依据国家医疗器械监督管理条例医疗器械不良反应事件监测和再…
-
药品不良反应和医疗器械不良事件监测与报告制度
药品不良反应和医疗器械不良事件监测与报告制度一药品不良反应定义上市药品在正常用法用量情况下出现的与用药目的无关的或意外的有害反应包…