电化学基础实验报告 4.23
华 南 师 范 大 学 实 验 报 告
学 号 20130010011
专 业 课程名称实验项目循环伏安法测定电极反应参数
√综合 实验时间月日 实验类型 □验证 □设计 □
实验指导老师 吕 东 生 实验评分
一、实验目的
1.了解循环伏安法的基本原理及应用
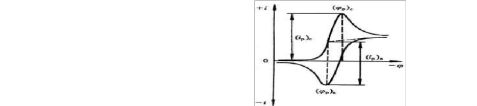
2. 掌握循环伏安法的实验技术和有关参数的测定方法。 二、实验原理 循环伏安法(CV)是最重要的电化学分析研究方法之一。在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。 CV方法是循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。如图1.
当工作电极被施加的扫描电压激发时,其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。如图2:0.1mol/LKNO3电解质溶液中,0.006mol/LK3Fe(CN)6在Pt电极上的反应所得到的结果。
图1.循环伏安法加电压的方式 图2.循环伏安法测得的氧化还原曲线 其电极反应为:选择施加在a点的起始电位Ei为0.8V,然后沿负的电位即正向扫描,当电位负到能够将VO2+还原时,在工作电极上发生还原反应:VO2++2H++e= VO2++H2O,阴极电流迅速增加(b-d),电流在d点达到最高峰,此后由于电极附
+2+
近溶液中的VO2转变为VO而耗尽,电流迅速衰减(d-e);在f点电压沿正的方
2+
向扫描,当电位正到能够将VO氧化时,在工作电极表面聚集的将发生氧化反应:VO2++H2O = VO2++e+2H+阳极电流迅速增加(i-j),电流在j点达到最高峰,此后由于电极附近溶液中的VO2+转变为VO2+而耗尽,电流迅速衰减(j-k);当电压达到a点的起始电位Ei时便完成了一个循环。
循环伏安图的几个重要参数为:阳极峰电流(ipa)、阴极峰电流(ipc)、阳极峰电位(Epa)、阴极峰电位(Epc)。对可逆氧化还原反应E= (Epa+Epc)/2。对于可逆
反应,阴阳极峰电位的值,△E=Epa-Epc≈0.056/n (1)峰电位与扫描速度无关。而峰电流ip=2.69×105n3/2AD1/2V1/2C,ip为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),V为扫描速度(V/s),C为浓度(mol/L)。由此可见,ip与V1/2和C都是直线关系。对于可逆的电极反应: ipa/ ipc ≈

1 .
(2) 对一个简单的电极反应过程,式(1)、(2)是判断电极反应是否可逆体系依据。
三、实验器材
CHI电化学工作站;玻碳电极;铂电极;Hg/Hg2SO4电极;0.1 mol/L VO2+ + 0.1 mol/L VO2+ +3 mol/L H2SO4溶液
四、实验步骤
1. 预处理电极。其中玻碳电极用砂纸打磨,铂电极与Hg/Hg2SO4电极用去离子水
清洗。
3. 连接好电极,打开CHI电化学工作站,选择“循环伏安”方法。
4. 设置实验参数。初始电位为开路电位,阴极终止电位-1.5V,阳极终止电位+2V,扫描速率为10mV/s,循环次数2次。保存实验数据。
5. 换电解液,处理电极后,将扫速设置为5mV/s,阴极终止电位0.3V,阳极终止电位1.3V,循环次数为2次。保存实验数据。
6. 在扫描速度分别为50mV/s ,20mV/s ,15mV/s, 10mV/s下按照步骤5的实验条件测量循环伏安曲线。保存实验数据。
7.清洗电极和电解槽,关闭仪器和电脑。
五.实验数据处理与分析
1.作出玻碳电极在-1.5V~2.0V范围内测出的循环伏安曲线图 (选第2次扫描的曲线)。指出玻碳电极上的析氢电位、析氧电位以及另外一对氧化峰和还原峰的电位及其对应的电化学反应。
图3. 玻碳电极在-1.5V~2.0V范围内,扫速10mV/s时测出的循环伏安曲线图
析氢电位:由于扫描的电位范围比较小,还没出现析氢电位
析氢电位对应的电化学反应:2H++2e=H2 ;
析氧电位:1.555V
析氧电位对应的电化学反应:2H2O-4e=O2+4H+ ;
另一氧化峰电位:0.477V
其电化学反应为:VO2++H2O = VO2++e+2H+;
另一还原峰电位:-0.657V
其电化学反应为:VO2++2H++e= VO2++H2O.
2. 在同一张图中做出-0.3V~1.1V范围内不同扫速下的循环伏安曲线。列表总结不同扫速下的测量结果。根据ΔEp和ipa/ipc随扫描速度的变化趋势,说明扫速对
VO2+/ VO2+ 电对的可逆性的影响。
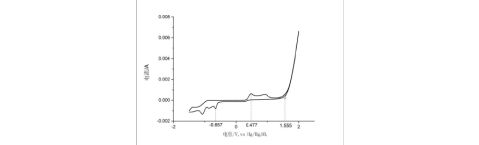
图4. 玻碳电极在-0.3V~1.1V范围内不同扫速下的循环伏安曲线
不同扫速下的测量结果数据表:
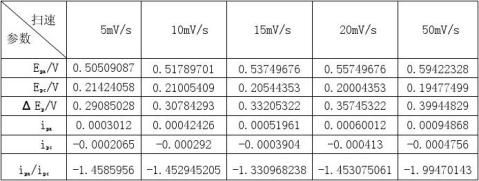
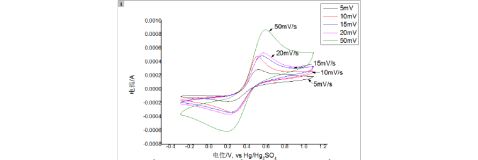

随着扫描速度的增加,ΔEp不断增大,ipa/ipc的比值也越来越偏离1,电池的可逆性随着扫描速度的增加越来越差。
3. 在同一张图中作出ipa和ipc对v1/2的曲线,并指出这两条曲线是否都是通过原点的直线。
图5. ipa和ipc对v的曲线
这两条直线都没有通过原点。
1/2
第二篇:电化学基础实验报告 4.28
华 南 师 范 大 学 实 验 报 告
学 号 20130010011 专 业 课程名称实验项目线性极化法测量金属Zn腐蚀的极化电阻
√综合 实验时间月日 实验类型 □验证 □设计 □
实验指导老师 吕 东 生 实验评分
一、实验目的
1. 了解极化电阻Rp的含义;
2. 掌握线性极化法测量金属腐蚀的极化电阻。
二、实验原理
金属Zn是中性锌锰电池、碱性锌锰电池和锌-空气电池等的负极材料,由于金属Zn具有较负的电极电位,当它与电解质溶液接触时,将会发生电化学腐蚀。在酸性或中性溶液中,金属Zn的电化学腐蚀反应为:
Zn?2e?Zn2?
2H?2e?H2?
而在碱性溶液中,金属Zn的电化学腐蚀反应为:
Zn?2OH??2e?Zn(OH)2
2H2O?2e?H2?2OH?
在金属Zn上进行电化学腐蚀的过程中,如果外电路无电流流过时,金属Zn的阳极溶解速率与其表面析氢速率相等,该速率就是Zn的腐蚀速率,用电流密度i腐,此时金属Zn的电位即是腐蚀电位φ腐。在实际应用中,不容易测得比较准确的i
通常根据极化电阻Rp的测量值来判断腐蚀体系的腐蚀速率的大小。腐蚀金腐值,
属电极的极化曲线在腐蚀电位φ腐处切线的斜率称为该腐蚀金属电极的 “极化电阻”。本实验采用线性极化法来测定Rp的值。
图1. 某腐蚀电极在1M H2SO4溶液中线性电位
扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
线性极化的含义即是指在腐蚀电位附近,当Δφ≤10mV时,极化电流i与极化电位Δφ之间存在着线性规律。通过线性部分的拟合可以求得:
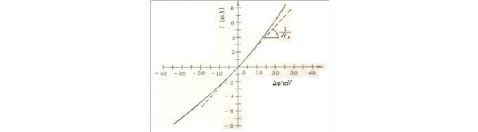
Rp??? i
也即是说极化电阻Rp为该直线的斜率的倒数,其单位是Ω?cm2。Δφ的单位是V,
2而i的单位是A/cm。Rp的值可以用来衡量腐蚀速率的大小,它的值越大,表明
腐蚀电流i腐值越小,即是腐蚀速率越小。
三、实验器材
CHI电化学工作站;甘汞电极;Hg/HgO电极;铂电极;金属Zn电极;0.2M ZnCl2溶液;0.2M KOH溶液;1200目细砂纸;高压氮气;电解池
四、实验步骤
1.打开CHI电化学工作站及测试用的电脑,预处理电极。其中,金属Zn电极要用1200目细砂纸打磨至金属面光亮。
2. 将铂电极和甘汞电极放入电解池中,向溶液中通入N2气约5min,除去其中的
氧气;
3.放入金属Zn电极,待开路电位稳定后,记录其值;
4. 选择“线性扫描伏安”功能,从φ开路-30mV的电位开始扫描,终止电位是φ开路+30mV,扫描速率是0.3mV/s。
5. 更换电解液,预处理电极,测量金属Zn的线性极化曲线。
五、数据处理与分析
1. 将测得的金属Zn电极在0.2M ZnCl2溶液和0.2M KOH溶液中的开路电位转换
成氢标电极后进行比较。
经查表得:饱和甘汞电极电位为0.244V,Hg/HgO电极电位为0.114V。而金属Zn电极在0.2M ZnCl2溶液中的开路电位为-1.114V,在0.2M KOH溶液中的开路电
位为-1.287V。
则:
金属Zn电极在0.2M ZnCl2溶液中的开路电位转换成氢标电极后为
E=0.244V-1.114V=-0.87V;
金属Zn电极在0.2M KOH溶液中的开路电位转换成氢标电极后为E=0.114V--1.287V=-1.173V.
因此,可看出:金属Zn电极在0.2M ZnCl2溶液中的开路电位比在0.2M KOH溶
液中的开路电位要小。
2. 在两张图中分别作出金属Zn电极在两种溶液中的线性极化曲线,并进行线性拟合,求出极化电阻Rp的值。说明金属Zn在哪一个溶液中更容易发生腐蚀。
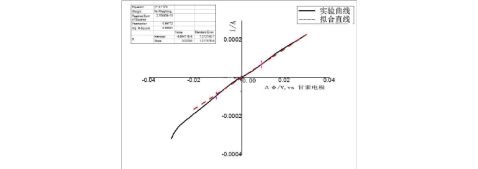
图2. 金属Zn电极在0.2M ZnCl2溶液中线性电位
扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
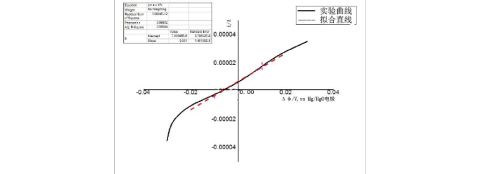
图3. 金属Zn电极在0.2M KOH溶液中线性电位 扫描曲线(虚线为线性拟合线),扫速0.3mV/s.
由图及相关数据得:
1 当溶液为0.2M ZnCl2时,?=0.00785, 则??=127.389Ω?cm2;
当溶液为0.2M KOH时,?,则??=1000Ω?cm2. 由此可知,金属Zn在0.2M ZnCl2溶液中更容易发生腐蚀。
? 1?
- 大学化学基础实验报告
-
基础化学实验报告
基础化学实验报告实验名称班组姓名同组人实验日期一实验目的1有助于提高学生的综合实验能力而且可以提高学生对于化学实验的兴趣2掌握制备…
-
基础化学实验报告格式
院系年级专业姓名学号课程名称基础化学实验实验日期年月日实验地点指导老师测定实验例二氧化碳相对分子质量的测定实验报告院系年级专业姓名…
-
基础化学实验II实验报告模板
浙江大学基础化学实验II实验报告姓名班级实验台号实验名称实验时间一实验目的二实验原理三主要试剂及主副产物的物理常数四主要试剂用量及…
-
化学实验报告 实验__化学实验基本操作
实验报告姓名:班级:同组人:自评成绩:项目:化学实验基本操作课程:学号:一、实验目的1.熟悉实验室规则,安全守则及意外事故处理。2…
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
电化学分析实验报告
电化学分析实验报告姓名:XXX专业:有机化学学号:时间:20XX.12.12一、实验目的1、了解电化学工作站的结构并熟悉其操作流程…
-
湖南大学材料化学电化学实验报告
实验一线性极化法测定金属Fe在稀H2SO4中的腐蚀速度一基本要求1掌握动电位扫描法测定电极极化曲线的原理和实验技术通过测定Fe在0…
-
氧化还原与电化学实验报告
氧化还原与电化学实验报告一实验目的二实验原理三预习思考题1为什么KMnO4能氧化盐酸中的Cl而不能氧化氯化钠溶液中的Cl2为什么H…
-
实验九 氧化还原与电化学
氧化还原与电化学三(一)、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(Sn4+/Sn…
-
大学有机化学实验基本知识
实验一有机化学实验基本知识课时数3学时教学目标通过学习使学生了解做有机化学实验时要达到的目的和实验要求掌握有机化学实验室规则和实验…