EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定
(四川农业大学生命科学与理学院(625014)应用化学09-2 王雨20096824 )
【摘 要】本实验利用络合滴定法分别标定了EDTA标准溶液、测定了自来水的硬度。 首先,以CaCO3为基准物质、钙指示剂指示滴定终点标定了EDTA标准溶液的浓度, 得到其平均浓度为0.01592 mol?L-1。再以铬黑T为指示剂、用标定后的EDTA测定了 水的总硬为12.61±0.01(°),以钙指示剂为指示剂测得水的钙硬为9.46±0.01(°), 则有镁硬为3.15±0.01(°)。
【关键词 】EDTA ;标定 ;水 ;硬度
1 引言
EDTA是乙二胺四乙酸或其二钠盐的简称(缩写为H4Y或Na2H2Y?2H2O),由于前者的溶解度小,通常用其二钠盐配制标准溶液。尽管EDTA可制得纯品,但EDTA具有与金属离子配位反应普遍性的特点,即使是水和试剂中的微量金属离子或器壁上溶出的金属离子也会与EDTA反应,故通常仍用间接法配制标准溶液。一般先配成浓度约为0.01mol?L-1的溶液,再用基准物质来标定,常用的基准物质是Zn、ZnO、CaCO3、Bi、Cu、MgSO4?7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
首先,所加钙指示剂与少量Ca2+反应,形成具有“足够”稳定性的酒红色配合物,滴定过程中滴加的EDTA与游离的Ca2+配位形成更稳定的(与指示剂配合物比较)配合物,最后EDTA再夺取指示剂配合物中的Ca2+而指示剂游离出来,溶液呈现出指示剂自身(在一定pH范围)的纯蓝色而显示终点。其相关反应:
HIn2- (纯蓝色)+ Ca2+?
CaIn-(酒红色)+H2Y2-+OH-?CaIn-(酒红色) +H+ CaY2+(无色)+ HIn2-(纯蓝色)+H2O
水中的钙、镁离子总量,可用EDTA配位滴定法测定。钙硬测定原理与以CaCO3为基 准物质标定EDTA标准溶液浓度相同。总硬则以铬黑T为指示剂,控制溶液的酸度为pH≈10,以EDTA标准溶液滴定之。由EDTA溶液的浓度和用量,可算出水的总硬,由总硬减去钙硬即镁硬。根据《中华人民共和国国家标准GB5750—50. 生活饮用水标准检验法》,生活饮用水的总硬不超过450 mg/L,即 。
水的硬表示方法:以度(°)计,1硬度单位表示十万份水含1份CaO,即1°=10-5 mg?L-1
CaO。硬度????cEDTA?VEDTA?
VH2OMCaO1000?105。
2 实验部分
2.1 试剂与仪器
乙二胺四乙酸二钠(固体,AR);CaCO3(固体,GR或AR);1+1NH3?H2O;镁溶液(溶解1 g MgSO4?7H2O于水中,稀释至200 mL);100 g?L-1NaOH溶液;钙指示剂(固体指示剂);NH3—NH4Cl缓冲溶液(pH≈10);铬黑T指示剂
酸式滴定管;烧杯;称量瓶;锥形瓶;移液管;量筒
2.2 实验方法
2.2.1
2.2.1.1 EDTA标准溶液的配制与标定 0.015 mol?L-1EDTA标准溶液的配制:在台秤上称取乙二胺四乙酸二钠2.8 g,溶 解于300~400 mL温水中,稀释至500 mL,如浑浊,应过滤。转移至500 mL细口瓶中,摇匀。
2.2.1.2 0.01 mol?L-1标准钙溶液的配制:准确称取CaCO3基准物质0.25~0.3 g(称准至小 数点后第4位)于小烧杯中,盖以表面皿,加水润湿,再从烧杯嘴边逐滴加入数毫升1+1HCl至完全溶解,用水把可能见到表面皿上的溶液淋入烧杯中,加热近沸,待冷却后移入250 mL容量瓶中,稀释至刻度,摇匀。
2.2.1.3 标定:用移液管移取25 mL标准钙溶液,置于锥形瓶中,加入约25 mL水、2 mL 镁溶液、5 mL 100 g?L-1NaOH溶液及约10 mg(绿豆大小)钙指示剂,摇匀,用EDTA溶液滴定至由酒红色变至纯蓝色,即为终点。
2.2.2
2.2.2.1 水的硬度测定 总硬的测定:用移液管量取澄清的水样100 mL放入250 mL锥形瓶中,加入5 mL NH3—NH4Cl缓冲溶液,摇匀。再加入约0.01 g铬黑T固体指示剂,再摇匀,此时溶液呈酒红色,以0.015 mol?L-1EDTA标准溶液滴定至纯蓝色,即为终点。
2.2.2.2 钙硬的测定:量取澄清水样100 mL,放入250 mL锥形瓶中,加4 mL100 g?L-1
-1NaOH溶液,摇匀,再加入约0.01 g钙指示剂,再摇匀。此时溶液呈淡红色。用0.015mol?L
EDTA标准溶液滴定至呈纯蓝色,即为终点。
2.2.2.3 镁硬的测定:由总硬减去钙硬即得镁硬。
3 结果与讨论
3.1 在标定EDTA标准溶液的浓度的实验中,用分析天平称取了EDTA固体2.8316 g、
CaCO3固体0.3059 g。用1+1HCl将CaCO3完全溶解,配制得到钙标准溶液的浓度为0.01222mol?L。标定EDTA过程中消耗EDTA的量如表1。从实验结果可以看出,18.91严重偏离平均值,
表1 标定EDTA的实验数据
平行测定
VEDTA/mL cEDTA/(mol?L) cEDTA/(mol?L)
?1?1
-1
Ⅰ
19.20 0.01591
Ⅱ
19.13 0.01597
Ⅲ
19.25 0.01587
Ⅳ
19.10 0.01599
Ⅴ
19.21 0.01590
Ⅵ
19.20 0.01591
Ⅶ
19.20 0.01591
0.01592 4.2×10-5 0.26%
s
sr
3.2 以铬黑T为指示剂、标定好的EDTA为滴定剂,测定自来水的总硬度。如表一。
表一:测定水的的总硬度
平行测定
VEDTA/mL
14.13
14.15
14.12
14.10
14.14
14.10
14.11
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ
水的硬度(°) 水的平均硬度(°)
s
sr
12.62 12.63 12.61 12.59 12.61 0.016 0.13%
12.62 12.59 12.60
由络合滴定的原理和EDTA与Ca2+、Mg2+的络合滴定的条件稳定常数(lgKCaY=10.24,
'
lgKMgY=8.25)可知,滴定前,应该用NH3—NH4Cl缓冲溶液把试液的pH控制在10左右。
'
3.3 以钙指示剂为指示剂、标定好的EDTA为滴定剂,测定自来水的钙硬及镁硬,结果如
表二。
表二:测定钙的硬度 平行测定
VEDTA/mL
Ⅰ
10.60 9.46
Ⅱ
10.61 9.47
Ⅲ
10.59 9.45
Ⅳ
10.62 9.48 9.46 0.012 0.12% 3.15±0.01
Ⅴ
10.59 9.45
Ⅵ
10.60 9.46
Ⅶ
10.61 9.47
钙硬(°) 平均钙硬(°)
s
sr
镁硬(°)
用EDTA法测定自来水的硬度时,可能有铜、锌等离子干扰结果。铜离子存在使滴定 终点不明显;锌离子参加反应,使结果偏高。遇此情况,可用20 g?L-1 Na2S溶液将铜离子沉淀。 3.4 实验结果
自来水的总硬度为12.61±0.01(°);钙硬为9.46±0.01(°);镁硬为3.15±0.01(°)。 此自来水为中硬水。
[参考文献]
[1]、《分析化学实验》第三版 四川大学化工系、浙江大学化学系 [2]、《无机及分析化学实验》 王仁国
[3]、《中华人民共和国国家标准GB5750—50. 生活饮用水标准检验法》
第二篇:实验五:EDTA标准溶液的配置和滴定及水总硬度的测定

EDTA的配制、标定及水的硬度分析
指导老师 吴明君
化学生物学一班 刘淑岚 20123003
摘要 本实验先用CaCO3为基准物质,加入钙指示剂,标定EDTA标准溶液,得到其浓度为0.01526±0.00004。然后以铬黑T为指示剂,并用已标定过的EDTA标准溶液测定水的总硬度,得到水的总硬度为12.38±0.16。再以Ca指示剂为指示剂测定水的钙硬为12.13±0.17,最后由总硬减去钙硬得镁硬为0.26。数据分析时运用Q检验法对数据经行了分析处理。
关键词 EDTA标准溶液,标定,水的硬度,铵态氮测定
Determination of standard solution of NaOH in the titration and ammonium salts total alkalinity of industrial soda
Adviser Mingjun Wu
chemicobiology class 1 Shulan Liu 20123003
Abstract The experiment first using CaCO3 as a reference substance , add calcium indicator , calibration standard EDTA solution to give a concentration of 0.01526±0.00004 . Then chrome black T as indicator , and the determination of total hardness of water has been calibrated with EDTA standard solution , the resulting total water hardness 12.38±0.16 . Ca indicator then measured as an indicator of water calcium hardness is 12.13±0.17 . Finally, subtract hard by the total calcium magnesium hard to get hard 0.26 . Data analysis using Q -test analysis of the data processed by the line .
Keywords EDTA standard solution , calibration, water hardness, ammonium determination
综述 在环境监测分析中,总硬度为常规分析项目。测定地下水和地表水中的总硬度,一般常用EDTA滴定法。该法虽具仪器价廉、步骤简单、操作方便、准确可靠的优点,但就其某些具体操作而言,尚有待进一步完善。乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,常温下其溶解度为0.2g/L(约0.0007mol/L),在分析中通常使用其二钠盐配置标准溶液。乙二胺四乙酸二钠盐的溶解度为120g/L,,可配成0.3mol/L以上的溶液,其水溶液的pH≈4.8,通常采用间接法配制标准溶液。本实验以CaCO3为基准物,Ca指示剂为指示剂标定EDTA标准溶液的浓度。
一般含有钙、镁盐类的水叫硬水(硬水和软水尚无明确的界限,硬度小于5°的,一般可称软水)。硬度有暂时硬度和永久硬度之分。
暂硬和永硬的总和称为“总硬”。由镁离子形成的硬度称为“镁硬”。由钙离子形成的硬度成为“钙硬”。
水中钙、镁离子含量,可用EDTA配位滴定法测定。钙硬测定原理与以CaCO3为基准物标定EDTA标准溶液浓度相同。总硬则以铬黑T为指示剂,控制溶液的酸度为pH≈10,以EDTA标准溶液滴定之。由EDTA溶液的浓度和用量,可算出水的总硬,由总硬减去钙硬即为镁硬。
水的硬度的表示方法有多种,随各国的习惯而有所不同。有将水中的盐类都折算成CaCO3而以CaCO3的量作为硬度标准的。也有将盐类合算成CaO而以CaO的量来表示的。本实验采用我国目前常用的表示方法:以度(°)计,1硬度单位表示十万份水中含一份CaO,即1°=10-5mg/LCaO。
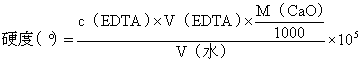
1 实验部分
1.1 主要仪器与试剂
细口试剂瓶,称量瓶,烧杯,表面皿,250mL容量瓶,25mL移液管,锥形瓶
乙二胺四乙酸二钠(固体,AR),CaCO3(固体,GR或AR),1+1NH3·H2O,镁溶液(溶解1gMgSO4·7H2O)于水中,稀释至200mL),100g/LNaOH溶液,钙指示剂(固体指示剂),NH3-NH4Cl缓冲溶液(pH≈10),铬黑T指示剂
1.2 实验方法及步骤
1.2.1 EDTA标准溶液的配制 欲配制浓度为0.015mol/LEDTA溶液,在台秤上称取乙二胺四乙酸二钠2.85g,溶解于300-400mL温水中,稀释至500mL,如混浊,应过滤。转移至500mL细口瓶中,摇匀。
1.2.2标准钙溶液的配制 置碳酸钙基准物于称量瓶中,在110℃干燥2h,置干燥器中冷却后,准确称取0.5-0.6g于小烧杯中,盖以表面皿,加水润湿,再从杯嘴边缘逐滴加入数毫升1+1HCl至完全溶解,用水把可能溅到表面皿上的溶液淋洗入杯中,加热近沸,待冷却后移如250mL容量瓶中,稀释至刻度,摇匀。
1.2.3 EDTA标准溶液的标定 用移液管一区25mL标准钙溶液,置于锥形瓶中,加入约25mL水、2mL镁溶液、5mL100g/LNaOH溶液及约10mg钙指示剂,摇匀后,用EDTA溶液滴定至由红色变至蓝色即为终点。平行滴定5-6次,计算出EDTA的浓度。
1.2.4 总硬度的测定 量取澄清的水样100mL放入250mL或500mL锥形瓶中,加入5mL NH3-NH4Cl缓冲溶液,摇匀,再加入约0.01g铬黑T固体指示剂,再摇匀,此时溶液呈酒红,以0.02mol/LEDTA标准溶液滴定至纯蓝色,即为终点。
1.2.5 钙硬的测定 量取澄清水样100mL,放入250mL锥形瓶内,加4mL100g/LNaOH溶液,摇匀,再加入约0.01g钙指示剂,再摇匀。此时溶液呈淡红色。用0.02mol/LEDTA标准溶液滴定至呈纯蓝色,即为终点。
1.2.6 镁硬的测定 有总硬度减去钙硬及时镁硬。
2 实验数据记录与处理
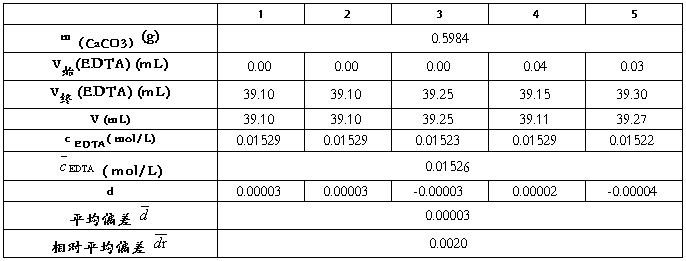
2.1 EDTA标准溶液的标定
2.1.1数据记录
表一 EDTA标准溶液的标定
Table1-1 Calibration standard solution of EDTA
2.1.2数据取舍
将五个数据按从小到大的顺序排列为:
0.01522 0.01523 0.01529 0.01529 0.01529
可疑值为0.01522
用Q检验法进行检验:Q=(0.01523—0.01522)/(0.01529—0.01522)=0.14
由Q值表可知当置信度为96%时,Q表=0.73,Q小于Q表
所以0.01522应保留。
2.1.3数据处理
极差:R=cmax - cmin=0.00007(ml)
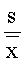

s= =3.4×10-5 =0.22%≤0.3%
取置信度为95%,tα,f=2.78,则μ=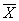 ±t
±t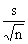 =0.01526±0.00004
=0.01526±0.00004
2.2水硬度的测定
2.2.1数据记录
表二 水硬度的测定
Table1-2 Determination of water hardness

2.2.2数据取舍
Ⅰ将五个数据按从小到大的顺序排列为:
12.24 12.32 12.32 12.49 12.54
可疑值为12.54
用Q检验法进行检验:Q=(12.54—12.49)/(12.54—12.24)=0.17
由Q值表可知当置信度为96%时,Q表=0.73,Q小于Q表
所以12.54应予以保留
Ⅱ将五个数据按从小到大的顺序排列为:
11.98 12.15 12.24 12.24 12.32
可疑值为11.98
用Q检验法进行检验:Q=(12.15—11.98)/(12.32—11.98)=0.50
由Q值表可知当置信度为96%时,Q表=0.73,Q小于Q表
所以12.15应予以保留
2.2.3数据处理
 Ⅰ极差:R=Xmax -Xmin=0.22
Ⅰ极差:R=Xmax -Xmin=0.22
s= =0.13 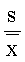 =1.0%≥0.3%
=1.0%≥0.3%
取置信度为95%,则总硬度μ=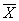 ±t
±t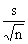 =12.38±0.16
=12.38±0.16
 Ⅱ极差:R=Xmax -Xmin=0.34
Ⅱ极差:R=Xmax -Xmin=0.34
s= =0.14 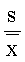 =1.2%≥0.4%
=1.2%≥0.4%
取置信度为95%,则钙硬μ=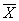 ±t
±t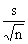 =12.13±0.17
=12.13±0.17
镁硬=总硬-钙硬=0.26
4 结果与讨论
4.1副反应系数
KˊCa2+=KCaY-lgαCa-lgαY=10.69-1.12=9.57
KˊMg2+=KMgY-lgαMg-lgαY=8.7-2.04=6.66
4.2进行反应的时间 由于络合反应进行的较慢,故滴入EDTA的速度不能过快,应该缓慢滴定并充分混匀,使反应完全。
4.3加入指示剂的量及颜色的观察
4.3.1指示剂用量 实验过程中指示剂加入是溶液呈现明显可见的酒红色即可,加多或加少都会影响重点变色的观察。
4.3.2设置终点颜色对照 在做过初始试验和之前几次的实验不要立刻清洗锥形瓶,用其作为之后实验的颜色,因为滴定终点的颜色为缓慢连续变色,有了颜色的对照更易观察到终点。
4.3.3变色敏锐的关键 为使滴定终点变色敏锐,实验中会加入适量Mg(OH)2,这是滴定终点能否出现明显的亮蓝色的关键。
参考文献
[1] 四川大学化工学院,浙江大学化学系,分析化学实验,北京:高等教育出版社,2003.6
[2] 武汉大学,分析化学,北京:高等教育出版社,2006.7
[3] 王仁国,无机及分析化学实验,北京:中国农业出版社,2007.9
[4] 王仁国,无机及分析化学,北京中国农业出版社,2006.8
[5] 多兰·哈布德力 阿力亚,EDTA滴定法测定水中总硬度的几点体会
致谢
感谢学校为我提供实验的平台,感谢吴明君老师的悉心指导
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
分析化学实验 水硬度的测定(配位滴定法)
实验二水总硬度的测定配位滴定法实验日期实验目的学习EDTA标准溶液的配制方法及滴定终点的判断掌握钙镁测定的原理方法和计算一水硬度的…
-
浙江远程实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
氢氧化钠溶液浓度的标定 实验报告
实验报告姓名班级同组人项目氢氧化钠溶液浓度的标定课程分析化学学号一实验目的1学会称量瓶电子天平滴定管等常用滴定仪器的准备和使用方法…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…