ELISA实验步骤
血清中食物过敏原IgG的测定
方法:ELISA间接法
试剂:八种食物抗原、血清样品、Goat anti-human IgG-HRP(santa cruz biotechnology/ Thermo Fisher Scientific)、包被液(碳酸盐缓冲液/CBS)、封闭液(5%BSA+PBST)、洗涤液(PBST),稀释液(1%BSA+PBST),底物(TMB),中止液(2M H2SO4)。
实验步骤:
1. 血清收集保存:收集不抗凝血液3-5ml,保存4℃冰箱中,在恒温离心机中以4℃,3500r离心10min,收集上层血清,以200ul/管分管编号冻存-80℃冰箱中。
2. 包被:用包被液(CBS)稀释八种抗原至5ug/ml,以100ul/孔加入酶标板中,空白孔加100ul/孔3%BSA+PBS.,4℃放 置过夜12h上。
3. 同一酶标板加入同一种抗原
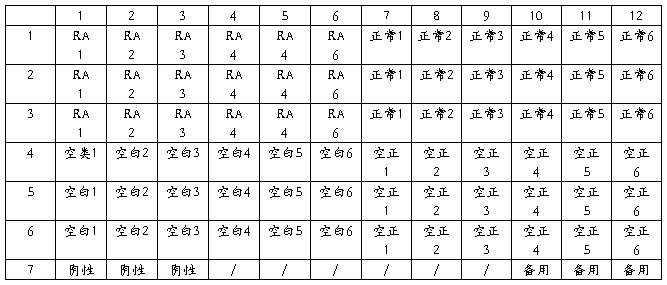
4. 封闭:弃上清液,加封闭液(5%BSA+PBST)200ul/孔,37℃放置2h。
5. 洗涤:以洗涤液洗涤5次,5min/次。
6. 加血清样品:将冻存血清逐级解冻至室温,将待测血清(1:30稀释于1%BSA+PBST)中,以100ul/孔加入酶标本中,37℃放置2h,阴性对照孔加100ul/孔稀释液(1%BSA+PBST).
6. 洗涤:用洗涤液洗涤5次,5min/次。
7. 加酶标二抗:人抗IgG抗体-HRP,用1%BSA+PBST 液1:10000稀释,100ul/孔,37℃恒温箱温育2h。
8. 洗涤:洗涤液洗涤5次,5min/次。
9. 显色:加新鲜配制的底物(TMB:A液和B液等体积混合)100ul/孔。
10. 中止反应、比色:加50ul/孔中止液(2M H2SO4),用酶标仪测定吸收值(450nm),根据P/N确定阳性值。
1 血清特异性IgE检测
小鼠检测完AHR后24h内处死动物,摘眼球取血,室温下静置30min,4℃4000rmp/min离心10min,小心吸取上层血清,分装-80℃保存备用。采用间接ELISA法测定血清特异性血清特异性IgE水平。具体步骤为:包被100μl 1μg/ml Der f 1蛋白,4℃孵育过夜;200μl 3% BSA-PBS封闭,37℃孵育2h,PBST洗板5次;用1%BSA-PBST将小鼠血清按1:5稀释,100μl/孔,37℃孵育1h,PBST洗板5次;用1%BSA-PBST将生物素标记的羊抗鼠IgE按1:2000稀释,100μl/孔,37℃孵育2h,PBST洗板5次;用1%BSA-PBST将HRP标记的链霉亲和素按1:5000稀释,100μl/孔,37℃孵育2h,PBST洗板5次;TMB显色,37℃避光孵育5-10min;50μl 2mol/L的硫酸终止反应,450nm比色。
2 血清特异性IgG2a、IgG1检测
从-80℃冰箱取出保存的血清,置于4℃缓慢解冻。包被100μl 1μg/ml Der f 1蛋白,4℃孵育过夜;200μl 3% BSA-PBS封闭,37℃孵育2h,PBST洗板5次;用1%BSA-PBST将小鼠血清按1:1000稀释,100μl/孔,37℃孵育2h,PBST洗板5次;用1%BSA-PBST将HRP标记的羊抗鼠IgG2a和IgG1按1:2000稀释,100μl/孔,37℃孵育1h,PBST洗板5次; TMB显色,37℃避光孵育5-10min;50μl 2mol/L的硫酸终止反应,450nm比色。
Western blot
一、 SDS-聚丙烯凝胶电泳
二、 转膜
- 准备好转膜用的物品:转膜夹、剪刀、镊子、纤维素膜、滤纸,盘子,转膜液(不加SDS,有气泡)
- 将滤纸侵泡于盘中的转膜液,赶走气泡,将膜剪去一角做标记,侵泡于甲醇中,根据黑胶白膜原则叠好,保证无气泡后夹紧放入电泳槽中,黑对黑原则放入电泳槽,槽内放入冰袋,盖好电泳槽盖。
- 于冰上或者冰箱中低温转膜,恒流300mA,40min
三、 封闭(正面朝上)TBS洗5min配3%BSA-TBS摇几分钟4℃过夜,(100mlTBS中加入3gBSA胎牛血清,0.21g7ml)
四、 加一抗,倒去封闭液,用TBS冲洗一次,TBST 5min×3次(大概10ml),加入用1%BSA-TBST稀释的一抗室温摇2h(1:5)
五、 加二抗:倒去一抗或回收(TBST,5min×3次)用1%BSA-TBST按2000:1稀释二抗(鼠抗人IgE抗体),室温摇2h(有的已经与HRP结合的,如若没有,后面加HRP)
六、 加HRP(链霉亲和素):TBST洗5min×3次用1%BA年 SA-TBST按5000:1稀释HRP,室温摇1.5h
七、 DAB显色:TBST洗5min×3次,然后TBS洗5min×3
A1滴+B2滴+C1滴+1ml纯水
,至条带显色
自来水冲洗至无背景即可
八、 拍照:用保鲜膜装去离子水,保存于4℃冰箱
背景高的原因:1.延长封闭时间
2.用去脂牛奶5%封闭
3.Ⅰ抗Ⅱ抗用封闭液稀释
4.降低二抗浓度,缩短孵育时间
第二篇:ELISA实验方法合集
第- 1 -页(共44页) 1. ELISA[酶联免疫吸附试验]原理与分类——1 2. 酶联免疫吸附技术(ELISA)的操作要点——4 3. 蛋白质分析技术(WesternBlot、ELISA、免疫荧光与免疫组化技术)——8 4. 细胞ELISA操作步骤(ENGLISH)——14 5. 如何正确的进行ELISA测定操作——15 6. ELISA法测定单克隆抗体的效价——19 7. 免疫组化基本原理——20 8. 免疫组化技术优点——20 9. 免疫组化实验步骤——21 10.免疫组化技术之免疫荧光法——23 11.免疫组化技术之免疫酶法——24 12.免疫组化技术之免疫金银法——26 13.免疫组化操作要点及技巧——27 14.免疫组化技术的关键问题——28 15.免疫组化染色注意事项——30 16.免疫组织化学工作流程——33 17.免疫细胞化学常用试剂-封固剂——33 18.免疫细胞化学常用试剂-酶消化液——34 19.免疫细胞化学常用试剂-其它——35 20.ELISA试验中所用物品及试剂详解——37 21.ELISA常用试剂的配置——43 第- 2 -页(共44页) ELISA[酶联免疫吸附试验酶联免疫吸附试验酶联免疫吸附试验酶联免疫吸附试验]原理与分类原理与分类原理与分类原理与分类 基本原理基本原理基本原理基本原理 19xx年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)用于IgG定量测定的文章,使得19xx年开始用于抗原定位的酶标抗体技术发展成液体标本中微量物质的测定方法。这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。 方法类型和操作步骤方法类型和操作步骤方法类型和操作步骤方法类型和操作步骤 ELISA可用于测定抗原,也可用于测定抗体。在这种测定方法中有三个必要的试剂:(1)固相的抗菌素原或抗体,即"免疫吸附剂"(immunosorbent);(2)酶标记的抗原或抗体,称为"结合物"(conjugate);(3)酶反应的底物。根据试剂的来源和标本的情况以及检测的具体条件,可设计出各种不同类型的检测方法。用于临床检验的
ELISA主要有以下几种类型: 2.2.1 双抗体夹心法测抗原双抗体夹心法测抗原双抗体夹心法测抗原双抗体夹心法测抗原 双抗体夹心法双抗体夹心法双抗体夹心法双抗体夹心法是检测抗原最常用的方法,操作步骤如下: 1) 将特异性抗体与固相载体联结,形成固相抗体。洗涤除去未结合的抗体及杂质。 2) 加受检标本,保温反应。标本中的抗原与固相抗体结合,形成固相抗原抗体复合物。洗涤除去其他未结合物质。 3) 加酶标抗体,保温反应。固相免疫复合物上的抗原与酶标抗体结合。彻底洗涤未结合的酶标抗体。此时固相载体上带有的酶量与标本中受检抗原的量相关。 4) 加底物显色。固相上的酶催化底物成为有色产物。通过比色,测知标本中抗原的量。在临床检验中,此法适用于检验各种蛋白质等大分子抗原,例如HBsAg、HBeAg、AFP、hCG等。只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。如抗体的来源为抗血清,包被和酶标用的抗体最好分别取自不同种属的动物。如应用单克隆抗体,一般选择两个针对抗原上不同决定簇的单抗,分别用于包被固相载体和制备酶结合物。这种双位点夹心法具有很高的特异性,而且可以将受检标本和酶标抗体一起保温反应,作一步检测。 在一步法测定中,当标本中受检抗原的含量很高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成"夹心复合物"。类同于沉淀反应中抗原过剩的后带现象,此时反应后显色的吸光值(位于抗原过剩带上)与标准曲线(位于抗体过剩带上)某一抗原浓度的吸光值相同(参见1.3.2,图1-4),如按常法测读,所得结果将低于实际的含量,这种现象被称为钩状效应(hook effect),因为标准曲线到达高峰后呈钩状弯落。钩状效应严重时,反应甚至可不显色而出现假阴性结果。因此在使用一步法试剂测定标本中含量可异常增高的物质(例如血清中HBsAg、AFP和尿液hCG等)时,应注意可测范围的最高值。用高亲和力的单克隆抗体制备此类试剂可削弱钩状效应。 假使在被测分子的不同位点上含有多个相同的决定簇,例如HBsAg的a决定簇,也可用针对此决定的同一单抗分别包被固相和制备酶结合物。但在HBsAg的检测中应注意亚型问题,HBsAg有adr、adw、ayr、ayw4个亚型,虽然每种亚型均有相同的a决定簇的反应性,这也是用单抗作夹心法应注意的问题。 双抗体夹心法测抗原的另一注意点是类风湿因子(RF)的干扰。RF是一种自身抗体,多为IgM型,能和多种动物IgG的Fc段结合。用作双抗体夹心法检测的血清标本中如含有RF,它可充当抗原成份,同时与固相抗
体和酶标抗体结合,表现出假阳性反应。采用F(ab')或Fab片段作酶结合物的试剂,由于第- 3 -页(共44页) 去除了Fc段,从而消除RF的干扰。双抗体夹心法ELISA试剂是否受RF的影响,已被列为这类试剂的一项考核指标(参见6.2)。 双抗体夹心法适用于测定二价或二价以上的大分子抗原,但不适用于测定半抗原及小分子单价抗原,因其不能形成两位点夹心。 2.2.2 双抗原夹心法测抗体双抗原夹心法测抗体双抗原夹心法测抗体双抗原夹心法测抗体 反应模式与双抗体夹心法类似。用特异性抗原进行包被和制备酶结合物,以检测相应的抗体。与间接法测抗体的不同之处为以酶标抗原代替酶标抗抗体。此法中受检标本不需稀释,可直接用于测定,因此其敏感度相对高于间接法。乙肝标志物中抗HBs的检测常采用本法。本法关键在于酶标抗原的制备,应根据抗原结构的不同,寻找合适的标记方法。 2.2.3 间接法测抗体间接法测抗体间接法测抗体间接法测抗体 间接法是检测抗体常用的方法。其原理为利用酶标记的抗抗体(抗人免疫球蛋白抗体)以检测与固相抗原结合的受检抗体,故称为间接法(见图2-3)。操作步骤如下: 1)将特异性抗原与固相载体联结,形成固相抗原。洗涤除去未结合的抗原及杂质。 2)加稀释的受检血清,保温反应。血清中的特异抗体与固相抗原结合,形成固相抗原抗体复合物。经洗涤后,固相载体上只留下特异性抗体,血清中的其他成份在洗涤过程中被洗去。 3)加酶标抗抗体。可用酶标抗人Ig以检测总抗体,但一般多用酶标抗人IgG检测IgG抗体。固相免疫复合物中的抗体与酶标抗体抗体结合,从而间接地标记上酶。洗涤后,固相载体上的酶量与标本中受检抗体的量正相关。 4)加底物显色 本法主要用于对病原体抗体的检测而进行传染病的诊断。间接法的优点是只要变换包被抗原就可利用同一酶标抗抗体建立检测相应抗体的方法。 间接法成功的关键在于抗原的纯度。虽然有时用粗提抗原包被也能取得实际有效的结果,但应尽可能予以纯化,以提高试验的特异性。特别应注意除去能与一般健康人血清发生反应的杂质,例如以E.Coli为工程酶的重组抗原,如其中含有E.Coli成份,很可能与受过E.Coli感染者血甭中的抗E.Coli抗体发生反应。抗原中也不能含有与酶标抗人Ig反应的物质,例如来自人血浆或人体组织的抗原,如不将其中的Ig去除,试验中也发生假阳性反应。另外如抗原中含有无关蛋白,也会因竟争吸附而影响包被效果。 间接法中另一种干扰因素为正常血清中所含的高浓度的非特异性。病人血清中受检的特异性IgG只占总IgG中的一小部
分。IgG的吸附性很强,非特异IgG可直接吸附到固相载体上,有时也可吸附到包被抗原的表面。因此在间接法中,抗原包被后一般用无关蛋白质(例如牛血清蛋白)再包被一次,以封闭(blocking)固相上的空余间隙。另外,在检测过程中标本须先行稀释(1:40~1:200),以避免过高的阴性本底影响结果的判断。 2.2.4 竞争法测抗体竞争法测抗体竞争法测抗体竞争法测抗体 当抗原材料中的干扰物质不易除去,或不易得到足够的纯化抗原时,可用此法检测特异性抗体。其原理为标本中的抗体和一定量的酶标抗体竞争与固相抗原结合。标本中抗体量越多,结合在固相上的酶标抗体愈少,因此阳性反应呈色浅于阴性反应。如抗原为高纯度的,可直接包被固相。如抗原中会有干扰物质,直接包被不易成功,可采用捕获包被法,即先包被与固相抗原相应的抗体,然后加入抗原,形成固相抗原。洗涤除去抗原中的杂质,然后再加标本和酶标抗体进行竞争结合反应。竞争法测抗体有多种模式,可将标本和酶标抗体与固相抗原竞争结合,抗HBc ELISA一般采用此法。另一种模式为将标本与抗原一起加入到固相抗体中进行竞争结合,洗涤后再加入酶标抗体,与结合在固相上的抗原反应。抗HBe的检测一般采用此法。 2.2.5 竞争法测抗原竞争法测抗原竞争法测抗原竞争法测抗原 小分子抗原或半抗原因缺乏可作夹心法的两个以上的位点,因此不能用双抗体夹心法进行测定,可以采用竞争法模式。其原理是标本中的抗原和一定量的酶标抗原竞争与固相抗体结合。标本中抗原量含量愈多,结合在固相上的酶标抗原愈少,最后的显色也愈浅。小分子激素、药物等ELISA测定多用此法。 2.2.6 捕获包被法测抗体 IgM抗体的检测用于传染病的早期诊断中。间接法ELISA一般仅适用于检测总抗体或IgG抗体。如用抗原包被的间接法直接测定IgM抗体,因标本中一般同时存在较高浓度的IgG抗体,后者将竞争结合固相第- 4 -页(共44页) 抗原而使一部份IgM抗体不能结合到固相上。因此如用抗人IgM作为二抗,间接测定IgM抗体,必须先将标本用A蛋白或抗IgG抗体处理,以除去IgG的干扰。在临床检验中测定抗体IgM时多采用捕获包被法。先用抗人IgM抗体包被固相,以捕获血清标本中的IgM(其中包括针对抗原的特异性IgM抗体和非特异性的IgM)。然后加入抗原,此抗原仅与特异性IgM相结合。继而加酶标记针对抗原的特异性抗体。再与底物作用,呈色即与标本中的IgM成正相关。此法常用于病毒性感染的早期诊断。甲型肝炎病毒(HAV)抗体的检测模式见图2-7。 类风湿因子(RF)同样能干扰捕获包被法测定IgM抗体,导致
假阳性反应。因此中和IgG的间接法近来颇受青睐,用这类试剂检测抗CMV IgGM和抗弓形虫IgM抗体已获成功。 2.2.7 ABS-ELISA法法法法 ABS为亲和素(avidin)生物素(biotin)系统(system)的略语。亲和素是一种糖蛋白,分子量60000,每个分子由4个能和生物素结合的亚基组成。生物素为小分子化合物,分子量244。用化学方法制成的衍生物素-羟基琥珀酰亚胺酯可与蛋白质和糖等多种类型的大小分子形成生物素标记产物,标记方法颇为简便。生物素与亲和素的结合具有很强的特异性,其亲和力较抗原抗体反应大得多,两者一经结合就极为稳定。由于一个亲和素可与4个生物素分子结合,因此如把ABS与ELISA法可分为酶标记亲和素-生物素(LAB)法和桥联亲和素-生物素(ABC)法两种类型。两者均以生物素标记的抗体(或抗原)代替原ELISA系统中的酶标抗体(抗原)。在LAB中,固相生物素先与不标记的亲和素反应,然后再加酶标记的生物素以进一步提高敏感度。在早期,亲和素从蛋清中提取,这种卵亲和素为碱性糖蛋白,与聚苯乙烯载体的吸附性很强,用于ELISA中可使本底增高。从链霉菌中提取的链霉亲和素则无此缺点,在ELISA应用中有替代前者的趋势。由于ABS-ELISA较普通ELISA多用了两种试剂,增加了操作步骤,在临床检验中ABS-ELISA应用不多。 补充补充补充补充:::: (五)捕获法测IgM抗体 血清中针对某些抗原的特异性IgM常和特异性IgG同时存在,后者会干扰IgM抗体的测定。因此测定IgM抗本多用捕获法,先将所有血清IgM(包括异性IgM和非特异性IgM)固定在固相上,在去除IgG后再测定特异性IgM。操作步骤如下: (1)将抗人IgM抗体连接在固相载体上,形成固相抗人IgM。洗涤。 (2)加入稀释的血清标本:保温反应后血清中的IgM抗体被固相抗体捕获。洗涤除去其他免疫球蛋白和血清中的杂质成分。 (3)加入特异性抗原试剂:它只与固相上的特异性IgM结合。洗涤。 (4)加入针对特异性的酶标抗体:使之与结合在固相上的抗原反应结合。洗涤。 (5)加底物显色:如有颜色显示,则表示血清标本中的特异性IgM抗体存在,是为阳性反应。 (六)应用亲和素和生物素的ELISA 亲和素是一种糖蛋白,可由蛋清中提取。分子量60kD,每个分子由4个亚基组成,可以和4个生物素分子亲密结合。现在使用更多的是从链霉菌中提取的链霉和素(strepavidin)。生物素(biotin)又称维生素H,分子量244.31,存在于蛋黄中。用化学方法制成的衍生物,生物素-羟基琥珀亚胺酯(biotin-hydroxysuccinimide,BNHS)可与蛋白质、糖类和酶等多种类型的大小分子形成生物素化的产物。亲和素与生物
素的结合,虽不属免疫反应,但特异性强,亲和力大,两者一经结合就极为稳定。由于1个亲和素分子有4个生物素分子的结合位置,可以连接更多的生物素化的分子,形成一种类似晶格的复合体。因此把亲和素和生物素与ELIS偶联起来,就可大提高ELISA的敏感度。 亲和素-生物素系统在ELISA中的应用有多种形式,可用于间接包被,亦可用于终反应放大。可以在固相上先预包被亲和素,原用吸附法包被固相的抗体或抗原与生物素结合,通过亲和素-生物素反应而使生物素化的抗体或抗在相化。这种包被法不仅可增加吸附的抗体或抗原量,而且使其结合点充分暴露。另外,在常规ELISA中的酶标抗体也可用生物素化的抗体替代,然后连接亲和素-酶结合物,以放大反应信号。 第- 5 -页(共44页) ELISA 普遍用作非放射性同位素的成键化验. 在这种方法中, 通常标准配体是固定的, 通过加入溶液相受体或蛋白质来使之成键. 通过加入与受体特异性反应的抗体来定量成键的受体, 而且最初抗体的量以加入第二种能显色的抗体测量. 第二种抗体能识别抗体的末端, 在其末端的碱性磷酸酯或过氧化物酶等与酶发生反应, 从而使溶液显色. 酶联免疫吸附技术酶联免疫吸附技术酶联免疫吸附技术酶联免疫吸附技术((((ELISA))))的操作要点的操作要点的操作要点的操作要点 优质的试剂,良好的仪器和正确的操作是保证ELISA 检测结果准确可靠的必要条件。ELISA 的操作因固相载体的形成不同而有所差异,国内医学检验一般均用板式点。本文将叙述板式ELISA 各个操作步骤的注意要点,珠式、管式及磁性球ELSIA ,国外试剂均与特殊仪器配合应用,两者均有详细的使用说明,严格遵照规定操作,必能得出准确的结果。 1 标本的采取和保存标本的采取和保存标本的采取和保存标本的采取和保存 可用作 ELISA 测定的标本十分广泛,体液(如血清)、分泌物(唾液)和排泄物(如尿液、粪便)等均可作标本以测定其中某种抗体或抗原成份。有些标本可直接进行测定(如血清、尿液),有些则需经预处理(如粪便和某些分泌物)。大部分ELISA 检测均以血清为标本。血浆中除尚含有纤维蛋白原和抗凝剂外,其他成份均同等于血清。制备血浆标本需借助于抗凝剂,而血清标本只要待血清自然凝固、血块收缩后即可取得。除特殊情况外,在医学检验中均以血清作为检测标本。在ELISA 中血浆和血清可同等应用。 血清标本可按常规方法采集,应注意避免溶血,红细胞溶解时会释放出具有过氧化物酶活性的物质,以HRP 为标记的ELISA 测定中,溶血标本可能会增加非特异性显色。 2 试剂
的准备试剂的准备试剂的准备试剂的准备 按试剂盒说明书的要求准备实验中需用的试剂。 ELISA 中用的蒸馏水或去离子水,包括用于洗涤的,应为新鲜的和高质量的。自配的缓冲液应用pH 计测量较正。从冰箱中取出的试验用试剂应待温度与室温平衡后使用。试剂盒中本次试验不需用的部分应及时放回冰箱保存。 3 加样加样加样加样 在 ELISA 中一般有3 次加样步聚,即加标本,加酶结合物,加底物。加样时应将所加物加在LEISA 板孔的底部,避免加在孔壁上部,并注意不可溅出,不可产生气泡。 加标本一般用微量加样器,按规定的量加入板孔中。每次加标本应更换吸嘴,以免发生交叉污染,也可用一次性的定量塑料管加样。有此测定(如间接法 ELISA )需用稀释的血清,可在试管中按规定的稀释度稀释后再加样。也可在板孔中加入稀释液,再在其中加入血清标本,然后在微型震荡器上震荡1 分钟以保证混和。加酶结合物应用液和底物应用液时可用定量多道加液器,使加液过程迅速完成。 4 保温保温保温保温 在 ELISA 中一般有两次抗原抗体反应,即加标本和加酶结合物后。抗原抗体反应的完成需要有一定的温度和时间,这一保温过程称为温育(incubation) ,有人称之为孵育,在ELISA 中似不恰当。 ELISA 属固相免疫测定,抗原、抗体的结合只在固相表面上发生。以抗体包被的夹心法为例,加入板孔中的标本,其中的抗原并不是都有均等的和固相抗结合的机会,只有最贴近孔壁的一层溶液中的抗原直接与抗体接触。这是一个逐步平衡的过程,因此需经扩散才能达到反应的终点。在其后加入的酶标记抗体与固相抗原的结合也同样如此。这就是为什么ELISA 反应总是需要一定时间的温育。温育常采用的温度有 43℃、37℃、室温和4℃(冰箱温度)等。37℃是实验室中常用的保温温度,也是大多数抗原抗体结合的合适温度。在建立ELI SA 方法作反应动力学研究时,实验表明,两次抗原抗体反应一般在37℃经1-2 小时,产物的生成可达顶峰。为加速反应,可提高反应的温度,有些试验在43℃进行,但不宜采用更高的温度。抗原抗体反应4℃更为彻底,在放射免疫测定中多使反应在冰箱中过夜,以形成最多的沉淀。但因所需时间太长,在ELISA 中一般不予采用。 保温的方式除有的 ELISA 仪器附有特制的电热块外,一般均采用水浴,可将ELISA 板置于水浴箱中,ELISA 板底应贴着水面,使温度迅速平衡。为避免蒸发,板上应加盖,也可用塑料贴封纸或保鲜膜覆盖板孔,此时可让反应板漂浮在水面上。若用保温箱,ELISA 板应放在湿盒内,湿盒要选用传热性第- 6 -页(共44页
) 良好的材料如金属等,在盒底垫湿的纱布,最后将ELISA 板放在湿纱布上。湿盒应先放在保温箱中预温至规定的温度,特别是在气温较低的时候更应如此。无论是水浴还是湿盒温育,反应板均不宜叠放,以保证各板的温度都能迅速平衡。室温温育的反应,操作时的室温应严格限制在规定的范围内,标准室温温度是指20-25 ℃,但具体操作时可根据说明书的要求控制温育。室温温育时,ELISA 板只要平置于操作台上即可。应注意温育的温度和时间应按规定力求准确。为保证这一点,一个人操作时,一次不宜多于两块板同时测定。 5 洗涤洗涤洗涤洗涤 洗涤在 ELISA 过程中虽不是一个反应步骤,但却也决定着实验的成败。ELSIA 就是靠洗涤来达到分离游离的和结合的酶标记物的目的。通过洗涤以清除残留在板孔中没能与固相抗原或抗体结合的物质,以及在反应过程中非特异性地吸附于固相载体的干扰物质。聚苯乙烯等塑料对蛋白质的吸附是普遍性的,而在洗涤时又应把这种非特异性吸附的干扰物质洗涤下来。可以说在ELISA 操作中,洗涤是最主要的关键技术,应引起操作者的高度重视,操作者应严格按要求洗涤,不得马虎。 洗涤的方式除某些ELISA 仪器配有特殊的自动洗涤仪外,手工操作有浸泡式和流水冲洗式两种,过程如下: (1)浸泡式 a.吸干或甩干孔内反应液;b.用洗涤液过洗一遍(将洗涤液注满板孔后,即甩去);c.浸泡,即将洗涤液注满板孔,放置1-2 分钟,间歇摇动,浸泡时间不可随意缩短;d.吸干孔内液体。吸干应彻底,可用水泵或真空泵抽吸,也可甩去液体后在清洁毛巾或吸水纸上拍干;e.重复操作c 和d,洗涤3-4 次(或按说明规定)。在间接法中如本底较高,可增加洗涤次数或延长浸泡时间。微量滴定板多采用浸泡式洗涤法。洗涤液多为含非离子型洗涤剂的中性缓冲液。聚苯乙烯载体与蛋白质的结合是疏水性的,非离子型洗涤剂既含疏水基团,也含亲水基团,其疏水基团与蛋白质的疏水基团借疏水键结合,从而削弱蛋白质与固相载体的结合,并借助于亲水基团和水分子的结合作用,使蛋白质回复到水溶液状态,从而脱离固相载体。洗涤液中的非离子型洗涤剂一般是吐温 20,其浓度可在0.05%-0.2% 之间,高于0.2%时,可使包被在固相上的抗原或抗体解吸附而减低试验的灵敏度。 (2)流水冲洗式 流水冲洗法最初用于小珠载体的洗涤,洗涤液仅为蒸馏水甚至可用自来水。洗涤时附接一特殊装置,使小珠在流水冲击下不断地滚动淋洗,持续冲洗 2 分钟后,吸干液体,再用蒸馏水浸泡2 分钟,吸干即可。浸泡式犹如盆浴,流水冲洗式则好比淋浴
,其洗涤效果更为彻底,且也简便、快速。 已有实验表明,流水冲洗式同样也适用于微量滴定板的洗涤。洗涤时设法加大水流量或加大水压,让水流冲击板孔表面,洗涤效果更佳。 6 显色和比色显色和比色显色和比色显色和比色 6.1 显色显色显色显色 显色是 ELISA 中的最后一步温育反应,此时酶催化无色的底物生成有色的产物。反应的温度和时间仍是影响显色的因素。在一定时间内,阴性孔可保持无色,而阳性孔则随时间的延长而呈色加强。适当提高温度有助于加速显色进行。在定量测定中,加入底物后的反应温度和时间应按规定力求准确。定性测定的显色可在室温进行,时间一般不需要严格控制,有时可根据阳性对照孔和阴性对照孔的显色情况适当缩短或延长反应时间,及时判断。 OPD 底物显色一般在室外温或37℃反应20-30 分钟后即不再加深,再延长反应时间,可使本底值增高。OPD 底物液受光照会自行变色,显色反应应避光进行,显色反应结束时加入终止液终止反应。OPD 产物用硫酸终止后,显色由橙黄色转向棕黄色。 TMB 受光照的影响不大,可在室温中置于操作台上,边反应观察结果。但为保证实验结果的稳定性,宜在规定的适当时间阅读结果。T MB 经HRP 作用后,约40 分钟显色达顶峰,随即逐渐减弱,至2 小时后即可完全消退至无色。TMB 的终止液有多种,叠氮钠和十二烷基硫酸钠(SDS)等酶抑制剂均可使反应终止。这类终止剂尚能使蓝色维持较长时间(12-24 小时)不褪,是目视判断的良好终止剂。此外,各类酸性终止液则会使蓝色转变成黄色,此时可用特定的波长(450nm)测读吸光值。 6.2 比色比色比色比色 比色前应先用洁净的吸水纸拭干板底附着的液体,然后将板正确放入酶标比色仪的比色架中。以软板为第- 7 -页(共44页) 载体的试验,需先将板置于标准96 孔的座架中,才可进行比色。最好在加底物液显色前,先将软板边缘剪净,这样,此板就可完全平妥坐入座架中。 比色时应先以蒸馏水校零点,测读底物孔(未经任何反应仅加底物液的孔)和空白孔(以生理盐水或稀释液代替标本作全过程的孔),以记录本次试验的试剂状况。其后可用空白孔以蒸馏水校零点,以上各孔的吸光度需减去空白孔的吸光度,然后进行计算。 比色结果的表达以往通用光密度(oplical density,OD),现按规定用吸光度(absorbence,A),两者含义相同。通常的表示方法是,将吸收波长写于A 字母的右下角,如OPD 的吸收波长为492nm,表示方法为"A492nm"或"OD492nm" 。 6.3 酶标比色仪酶标比色仪酶标比色仪酶标比色仪 酶标比色仪简称酶标仪,通常指专用
于测读 ELISA 结果吸光度的光度计。针对固相载体形式的不同,各有特制的适用于板、珠和小试管的设计。许多试剂公司配套供应酶标仪。酶标仪的主要性能指标有:测读速度、读数的准确性、重复性、精确度和可测范围、线性等等。优良的酶标仪的读数一般可精确到0.0 01, 准确性为±1%,重复性达0.5%。举例说,若某孔测得的A 值为1.083,则该孔相对于空气的真实A 值应为1.083± 0.01(1.073~1.093 ),重复测定数次,其A 值均应1.083±0.05(1.078~1.088 )在之间。酶标仪的可测范围视各酶标仪的性能而不同。普通的酶标仪在0.000~2.000,新型号的酶标仪上限拓宽达2.900,甚至更高。超出可测上限的A 值常以"*"或"over"或其它符号表示。应注意可测范围与线性范围的不同,线性范围常小于可测范围,比如某一酶标仪的可测范围为0.000~2.900,而其线性范围仅0.000~2.000,这在定量ELISA 中制作标准曲线时应予注意。 酶标仪不应安置在阳光或强光照射下,操作时室温宜在15~30℃,使用前先预热仪器15-30 分钟,测读结果更稳定。测读 A 值时,要选用产物的敏感吸收峰,如OPD 用492nm 波长。有的酶标仪可用双波长式测读,即每孔先后测读两次,第一次在最适波长(W1),第二次在不敏感波长(W2),两次测定间不移动ELISA 板的位置。例如OPD 用492nm 为W1,630nm 为W 2,最终测得的A 值为两者之差(W1-W2)。双波长式测读可减少由容器上的划痕或指印等造成的光干扰。各种酶标仪性能有所不同,使用中应详细新闻记者说明书。 7 结果判断结果判断结果判断结果判断 7.1 定性测定定性测定定性测定定性测定 定性测定的结果判断是对受检标本中是否含有待测抗原或抗体作出 "有"或"无"的简单回答,分别用" 阳性"、"阴性"表示。"阳性"表示该标本在该测定系统中有反应。"阴性"则为无反应。用定性判断法也可得到半定量结果,即用滴度来表示反应的强度,其实质仍是一个定性试验。在这种半定量测定中,将标本作一系列稀释后进行试验,呈阳性反应的最高稀释度即为滴度。根据滴度的高低,可以判断标本反应性的强弱,这比观察不稀释标本呈色的深浅判断为强阳性、弱阳性更具定量意义。 在间接法和夹心法 ELSIA 中,阳性孔呈色深于阴性孔。在竞争法ELISA 中则相反,阴性孔呈色深于阳性孔。两类反应的结果判断方法不同,分述于下。 (1) 间接法和夹心法 这类反应的定性结果可以用肉眼判断。目视标本也无色或近于无色者判为阴性,显色清晰者为阳性。但在 ELSIA 中,正常人血清反应后常可出现呈色的本底,此本底的深浅因试剂的组成和实验的条件不同而异,因此实验中必须加测阴性
对照。阴性对照的组成应为不含受检物的正常血清或类似物。在用肉眼判断结果时,更宜用显色深于阴性对照作为标本阳性的指标。 目视法简捷明了,但颇具主观性。在条件许可下,应该用比色计测定吸光值,这样可以得到客观的数据。先读出标本( sample,S)、阳性对照(P)、和阴性对照(N)的吸光值,然后进行计算。计算方法有多种,大致可分为阳性判定值法和标本与阴性对照比值法两类。 a.... 阳性判定值阳性判定值阳性判定值阳性判定值 阳性判定值(cut-off value )一般为阴性对照A 值加上一个特定的常数,以此作为判断结果阳性或阴性的标准。用此法判断结果要求实验条件十分恒定,试剂的制备必须标准化,阳性和阴性的对照品应符合一定的规格,须配用精密的仪器,并严格按规定操作。阳性判定值公式中的常数是在这特定的系统中通过对大量标本的实验检测而得到的。现举某种检测 HBsAg 的试剂盒为例。试剂盒中的阴性对照品为不第- 8 -页(共44页) 含HBsAg 的复钙人血浆,阳性对照品HBsAg 的含量标明为P=9±2ng /ml。每次试验设2 个阳性对照和3 个阴性对照。 测得A 值后,先计算阴性对照A 值的平均数(NC X )和阳性对照A 值的平均数(PCX),两个平均数的差(P-N)必须大于一个特定的数值(例0.400),试验才有效。3 个阴性对照A 值均应≥0.5×NCX,并≤1.5 ×NCX,如其中之一超出此范围,则弃去,而已另两个阴性对照重新计算NCX;如有两个阴性对照A 值超出以上范围,则该次实验无效。阳性判定值按下式计算:阳性判定值=NCX 0.05 标本 A 值>阳性判定值的为阳性,小于阳性判定值的为阴性。应注意的是,式中0.05 为该试剂盒的常数,只适合于该特定条件下,而不是对各种试剂均可通用。 根据以上叙述可以看出,在这种方法中阴性对照和阳性对照也起到试验的质控作用,试剂变质和操作不当均会产生"试验无效"的后果。 b.标本标本标本标本/阴性对照比值阴性对照比值阴性对照比值阴性对照比值 在实验条件(包括试剂)较难保证恒定的情况下,这种判断法较为合适。在得出标本( S)和阴性对照(N)的A 值后,计算S/N 值。也有写作P/N 的,这里的P 不代表阳性(positive),而是病人(pati ent) 的缩写,不应误解。为避免混淆,更宜用S/N 表示。在早期的间接法ELISA 中,有些作者定出S/N 为阳性标准,现多为各种测定所沿用。实际上每一测定系统应该用实验求出各自的S/N 的阈值。更应注意的是,N 所代表的阴性对照是不含受检物质的人血清。有的试剂盒中所设阴性对照为不含蛋白质或蛋白质含量较底的缓冲液,以致反应后产生的本底可
能较正常人血清的本底低得多。因此,这类试剂盒规,如N<0.05 (或其他数值),则按0.05 计算,否则将出现假阳性结果。 (2)竞争法 在竞争法 ELISA 中,阴性孔呈色深于阳性孔。阴性呈色的强度取决于反应中酶结合物的浓度和加入竞争抑制物的量,一般调节阴性对照的吸光度在1.0-1.5 之间,此时反应最为敏感。竞争法 ELISA 不易用自视判断结果,因肉眼很难辨别弱阳性反应与阴性对照的显色差异,一般均用比色计测定,读出S、P 和N 的吸光值。计算方法主要也有两种,即阳性判定值法和抑制率法。 a. 阳性判定值法 与间接法和夹心法中的阳性判定值法基本相同,但在计算公式中引入阳性对照 A 值,现举某种检测抗HBc 的试剂盒为例。试剂盒中的阴性对照为不含抗HBc 的复钙人血浆,阳性对照中抗HBc 含量为125±1 00u/ml。每次试验设2 个阳性对照和3 个阴性对照。测得A 值后,先计算阴性对照A 值的平均值(NC X ) 和阳性对照A 值的平均数(PCX),两个平均数的差(N-P)必须大于一个特定的数值(例如0.300),试验才有效。3 个阴性对照A 值均应小于2.000,而且应≥0.5×NCX 并≤1.5×NCX,如其中之一超出此范围,则 弃去,而以另2 个阴性对照重新计算×NCX;如有2 个阴性对照A 超出以上范围,则该次实验无效。阳性判定值按下式计算: 阴性判定值=0.4×NCX 0.6×PCX 标本A 值≤阳性判定值的反应为阳性,A>阳性判定值的反应为阴性。 b. 抑制率法 抑制率表示标本在竞争结合中标本对阴性反应显色的抑制程度,按下式计算: 抑制率(%)= (阴性对照A 值-标本A 值)×100%/阴性对照A 值 一般规定抑制率≥50%为阳性,<50%为阴性。 7.2 定量测定定量测定定量测定定量测定 ELSIA 操作步骤复杂,影响反应因素较多,特别是固相载体的包被难达到各个体之间的一致,因此在定量测定中,每批测试均须用一系列不同浓度的参考标准品在相同的条件下制作标准曲线。测定大分子量物质的夹心法ELISA ,标准曲线的范围一般较宽,曲线最高点的吸光度可接近2.0 ,绘制时常用半对数纸,以检测物的浓度为横坐标,以吸光度为纵坐标,将各浓度的值逐点连接,所得曲线一般呈S 形,其头、尾部曲线趋于平坦,中央较呈直线的部分是最理想的检测区域。 测定小分子量物质常用竞争法(参见 2.2 ),其标准曲线中吸光度与受检物质的浓度呈负相 关。标准曲线的形状因试剂盒所用模式的差别而略有不同。 第- 9 -页(共44页) 蛋白质分析技术蛋白质分析技术蛋白质分析技术蛋白质分析技术(WesternBlot、、、、ELISA、、、、免免免免疫荧光与疫荧光与疫荧光与疫荧光与免疫组化技术免疫
组化技术免疫组化技术免疫组化技术) 1 原理: 将通过聚丙烯酰胺凝胶电泳分离的蛋白质转移到硝酸纤维素或PVDF膜上,然后与能特异性识别待检蛋白的抗体进行反应,洗涤去除没有结合的特异性抗体后,加入标记的、能识别特异性抗体的种属特异性抗体,反应一段时间后再次洗涤去除非特异性结合的标记抗体,加入适合标记物的检测试剂进行显色或发光等,观察有无特异性蛋白条带的出现,也可通过条带的密度大小来进行特异性蛋白的半定量。 2 操作过程 SDS-PAGE电泳→转膜(PVDF或硝酸纤维素膜) 封闭→一抗→洗涤→酶标二抗反应 洗涤→显色或化学发光显影 Western blot analysis of the cleavage of Caspase-3. IM9/Bcl-2 Cells were treated with 20mM of gossypol for 4, 8 and 16 h. After treatment, cells were harvested and lysed in lysis buffer. 50ug of protein was loaded in each lane and the expression of actin was detected as a loading control. Cytochrome c release from mitochondria to cytosol in gossypol-treated IM-9/Bcl-2 cells. Cells were treated with 10?M gossypol for different times, cytosol and mitochondrial protein were subject to SDS-PAGE followed by immunoblot with cytochrome c specific antibody. 3 注意的问题 (1) 蛋白质电泳 常用SDS-PAGE:单一亚基组成的蛋白质 非变性PAGE:多个不同亚基组成的蛋白质 Tris-Tricine胶中电泳:用于分子量小于10kDa的多肽和蛋白的电泳,能够获得较好的分离效果。 (2)转膜 戴手套,避免用手接触滤纸、凝胶和膜,因为手上的油脂会阻断转印。滤纸和膜的尺寸与凝胶大小一致 以适量的转移Buffer室温平衡滤纸、凝胶和膜15-30min,如果是PVDF膜,必须先用甲醇激活后浸泡。 方向正确:凝胶在阴极,膜在阳极 排去滤纸、胶和膜间的气泡。 电转时间:100V 1-2h,可根据蛋白分子量的大小灵活 选择转移结束后,凝胶用考马氏亮兰染色以确定转移效率膜用丽春红染色观察蛋白分子量标准的位置 (3)封闭 用5%脱脂奶粉或3%BSA (含0.1%Tween20 TBS或PBS配制) 时间:室温2h或4?C过夜 (4)显色或显影 显色 辣根过氧化物酶:底物为DAB 碱性磷酸酶:底物为BCIP/NBT 化学发光显影 最常用。辣根过氧化物酶和碱性磷酸酶有不同的发光底物(商品化产品) 注意:化学发光前将膜用不含Tween20的TBS或PBS洗涤一次曝光的时间和显影的时间根据实际情况而定 (5)膜的再利用 化学发光后的硝酸纤维素膜用Stripping -2ME )βBuffer洗涤后(洗涤Buffer: 62.5mm pH6.7 的Tris-HCI含2%SDS和100mm的 用不同的一抗进行杂交,检测其它蛋白的表达情况。一张膜可以重复第- 10 -页(共44页) 使用3-4次。碱性磷酸酶显色的膜不能再进行杂交 二二二二、、、、ELISA 1 原理原理原理原理:::
: ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。在测定时,受检标本与固相载体表面的抗原或抗体起反应。再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。此时固相上的酶量与标本中受检物质的量呈一定的比例。加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。测定方法具有很高的敏感度(pg-ng/ml水平),并且重复性好。 ELISA 常用的酶和底物常用的酶和底物常用的酶和底物常用的酶和底物 辣根过氧化物酶,底物为OPD, 深桔黄色 ,检测波长492nm TMB, 蓝绿色,检测波长450nm 碱性磷酸酶,底物为PNPP(对-消基苯磷酸酯), 黄色 检测波长405nm ELISA各步骤的反应时间 包被:24-36h,蛋白浓度为1-5ug/ml 封闭:37?C 2h 或4?C过夜(3%BSA) 样本反应时间:37?C 45min-1h 酶标抗体反应时间: 37?C 45min-1h 显色时间:15min(避光) 设对照 可以一次包被多块板,冻存备用 2 类型 (1)间接法测抗体 间接法是检测抗体常用的方法。其原理为利用酶标记的抗抗体,检测与固相抗原结合的受检抗体,故称为间接法。 常用于临床血清中自身抗体的检测,以及杂交瘤上清特异性抗体的筛选。如血清中PDCD5自身抗体的检测。 (2) 双抗体夹心法测抗原 是检测抗原最常用的方法。 只要获得针对受检抗原的特异性抗体,就可用于包被固相载体和制备酶结合物。 常用的组合:单克隆抗体+多克隆抗体 单克隆抗体+单克隆抗体 后一组合是两种单克隆抗体针对抗原上不同的相距较远的两个抗原决定簇,分别用于包被固相载体和制备酶结合物。 用途:测定二价或二价以上的大分子抗原,但不适用于测定半抗原及小分子单价抗原,因其不能形成两位点夹心。例如各种细胞因子的检测。 双抗体夹心法测抗原的方法双抗体夹心法测抗原的方法双抗体夹心法测抗原的方法双抗体夹心法测抗原的方法:::: 捕获抗体包被→封闭(3%BSA)→待测抗原→洗涤(含0.1%Tween的PBS)→酶标单抗或多抗→洗涤→显色→检测 (3)竞争法测抗原 1)抗体固相测抗原 小分子抗原或半抗原因缺乏可作夹心法的两个以上的位点,因此不能用双抗体夹心法进行测定,可以采用竞争法模式。 其原理是标本中的抗原和一定量的酶标抗原竞争与固相抗体结合。标本中抗原量含量愈多,结合在固相上的酶标抗原愈少,最后的显色也愈浅。 方法:抗体包被→封闭→同时加入待测抗原和酶标
抗原→洗涤→酶底物→显色→ELISA reader检测 第- 11 -页(共44页) 2)抗原固相测抗原 其原理是标本中的抗原和固相抗原与一定量的抗体竞争结合。标本中抗原含量愈多,结合在固相上的抗体愈少,最后的显色也愈浅。 方法: a: 抗原包被96孔板; b:封闭; c: 待测抗原与抗体反应一定时间; d: 加入96孔板 e: 洗涤 f:加入酶标二抗 g:洗涤 h:显色和检测 (4)IgM抗体的检测 1)间接法: 间接法ELISA一般仅适用于检测总抗体或IgG抗体。如用抗原包被的间接法直接测定血清中的IgM抗体,因标本中一般同时存在较高浓度的IgG抗体,后者将竞争结合固相抗原而使一部分IgM抗体不能结合到固相上,将出现假阴性结果。 因此,如果用抗IgM作为二抗,间接测定IgM抗体,必须先将标本用A蛋白或抗IgG抗体处理,以除去IgG的干扰。 方法: a: 抗原包被96孔酶标板; b:封闭; c: 待测血清与A蛋白反应一定时间后离心 d: 吸取上清液加入96孔酶标板 e: 洗涤 f:加入酶标抗IgM的抗体 g:洗涤 h:显色和检测 2)捕获包被法(夹心法) 先用抗人IgM抗体包被ELISA板,以捕获血清标本中的IgM(包括针对抗原特异性的IgM和非特异性的IgM)。然后加入相应抗原,继而加入针对抗原特异的酶标抗体,再与底物作用,颜色的深浅即与标本中的IgM含量成正相关。 方法: a: 抗人IgM抗体包被96孔酶标板; b:封闭; c: 加入待测血清; d: 洗涤96孔酶标板 e: 加入相应抗原 f:加入抗原特异的酶标抗体 g:洗涤 h:显色和检测 (5) ABS-ELISA技术 (Avidin Biotin system-ELISA 原理 亲和素是一种分子量是60,000的碱性蛋白,由四个相同亚基组成,每个亚基有一个生物素分子结合点。两者均可与抗体等大分子生物活性物质相偶联,又可被酶类等多种材料所标记,成为一种生物反应放大系统。生物素化抗体可捕获多个亲和素,后者再与酶结合,加入底物后,产生颜色反应。这一系统可以大大提高ELISA的灵敏度。 操作过程: 抗原包被→封闭→待检标本→生物素化抗体→洗涤→ 酶标记亲和素→洗涤→加底物显色和检测 三 免疫荧光技术 利用某些荧光素,如FITC、R-PE等通过化学反应与抗体或其它蛋白结合制备成荧光探针,然后与被测抗原或配体发生特异性结合,形成的荧光复合物在一定波长光的激发下可产生荧光,因此利用荧光显微镜或流式细胞仪可检测未知抗原或相应配体。 (一)细胞膜蛋白分子的检测 原理: 细胞膜表面的抗原或受体可特异地与相应的抗体或配体结合,将针对细胞表面抗原的抗体或配体用不同的荧光素标记,根据不同荧光物质的最大激发和发射波长的不同,即可准确定量每种荧光物质
的强度,第- 12 -页(共44页) 从而推出相应细胞表面抗原表达量 1 直接法:细胞+荧光素标记的抗CD分子的抗体→4?C反应30-60min→荧光显微镜观察或流式细胞计分析。 2 间接法:细胞+抗CD分子的抗体→4?C 反应30-60min 荧光素标记的二抗 4?C 反应30-60min→荧光显微镜观察或流式细胞计分析 悬浮细胞:用PBS洗二次后再做染色 贴壁细胞:先用胰酶消化成悬浮细胞再染色 2 Annexin V检测技术 (检测细胞凋亡的一个常规指标) 磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种分子量为35~36KD的Ca2 依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。 样本处理和染色方法样本处理和染色方法样本处理和染色方法样本处理和染色方法 1 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10ul,室温避光30min,再加入PI(50ug/ml)5ul,避光反应5min后,加入400ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1h), 同时以不加AnnexinV-FITC及PI的一管作为阴性对照。 2 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。 3 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。 ((((二二二二))))细胞内蛋白分子的检测细胞内蛋白分子的检测细胞内蛋白分子的检测细胞内蛋白分子的检测 细胞内细胞因子的检测、凋亡相关蛋白TFAR19的检测等。 操作过程: (1)直接法: 细胞→3%多聚甲醛固定和 渗透化→封闭→荧光素标记的抗体→ 洗涤→荧光显微镜观察或流式细胞计分析 (2)间接法: 细胞→3%多聚甲醛固定和渗透化→封闭→针对蛋白的特异抗体→洗涤→荧光素标记的二抗→洗涤 → 荧光显微镜观察或流式细胞计分析微镜观察或流式细胞计分析微镜观察或流式细胞计分析微镜观察或流式细胞计分析 凋亡相关蛋白TFAR19蛋白的表达和细胞定位分析 TFAR19(PDCD5)是由本研究室在国际上首先报导的一个拥有自己知识产权的人类新基因,前期的功能研究表明,它是促进细胞凋亡的增强剂。利用荧光素(FITC)标记的TFAR19单克隆抗体为探针,对细胞凋亡过程中TFAR19蛋白的表达水平及定位研究发现,凋亡早期TFAR19表达水平增高并出现快速核转位现象。同时我们发现,凋亡早期TFAR19蛋白的核转
位早于磷脂酰丝氨酸(PS)外翻和细胞核DNA的片段化,提示TFAR19蛋白的核转位是细胞凋亡更早期发生的事件之一。进一步的研究证明,凋亡早期TFAR19的核转位具有普遍意义,不同细胞凋亡早期均出现TFAR19高表达和核转位。这为研究细胞凋亡早期所发生的事件,提供了一种新的技术和指标。 1 悬浮细胞的染色: (1)收获正常和诱导凋亡的细胞(0.5~1×106),PBS洗2次, (2)3%多聚甲醛冰浴10min,PBS洗2次,1000rpm′10min。 (3)加入PBS-T溶液,37°C孵育15min,PBS洗2次, (4)加入200ml胎牛血清,室温反应30min。 (5)加入 FITC标记的TFAR19单抗,4°C反应30min (6)荧光细胞洗液洗2次,荧光显微镜及共聚焦激光显微镜下观察TFAR19在细胞中的定位。同时用流式细胞计定量检测TFAR19蛋白的平均荧光强度。 第- 13 -页(共44页) 2:贴壁细胞的原位染色 (1) 贴壁生长的对数期细胞铺在24孔或6孔板中(内有洁净盖玻片),让其爬片生长,待长到50%~80%满时,凋亡诱导剂处理细胞。 (2) 将不同时间点处理的细胞进行免疫荧光染色,染色步骤同上。 (3) 将染色的爬片细胞放于一张滴有少量甘油(5ul)的载玻片上,荧光显微镜或共聚焦激光扫描显微镜观察TFAR19在细胞中的定位。 四免疫组织化学技术 原理: 是指酶标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的成色反应,对相应的抗原进行定性、定位和定量测定的一项技术。它把免疫反应的特异性、组织化学的可见性巧妙的结合起来,借助显微镜(包括荧光显微镜、电子显微镜等)的显像和放大作用,在细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以及受体等),并可在原位显示相应的基因和基因表达产物。 免疫组化染色技术的分类 免疫荧光法(Immunofluorescence technique) 免疫酶法(Immunoperoxidase technique) 免疫金银法((Immunogold technique) ABC法( Avidin-Biotin Complex) 五 蛋白质与蛋白质相互作用的研究技术 1 GST融合蛋白进行Pulldow实验 (1)原理 细菌表达的谷胱甘肽s-转移酶(GST)融合蛋白主要用于蛋白的亲和纯化,也可以将GST融合蛋白作为探针,与溶液中的特异性搭档蛋白结合,然后根据谷胱甘肽琼脂糖球珠能够沉淀GST融合蛋白的能力来确定相互作用的蛋白。一般在得到目标蛋白的抗体前,或发现抗体干扰蛋白质-蛋白质之间的相互作用时,可以启用GST沉降技术。该方法只是用于确定体外的相互作用。 两种应用: 1)确定融合(或探针)蛋白与未知(或靶)蛋白间的新的相互作用 2)证实探针蛋白与已知蛋白质间可疑的相互作用 (2)方法: 1) GST融合蛋白先与下
列蛋白溶液之一孵育(a, 单一明确的重组蛋白;b,细胞裂解蛋白混合液;c, 体外翻译cDNA表达得到的未知蛋白) 2)混合液与谷胱甘肽琼脂糖球珠反应 4?C 2h 3)离心弃上清 4)沉淀加入2× 蛋白Loading Buffer煮沸,离心 5)取上清进行SDS-PAGE电泳, 6)考马氏亮兰染色观察特异沉降的蛋白带,进一步做质谱分析确 定沉降的蛋白;电泳后的胶也可以做Western Blot来确定沉降的蛋白中是否有目的蛋白 该实验设立GST对照,反应均在4?C进行 2 免疫共沉淀 (1)原理 当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。 如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。 第- 14 -页(共44页) 这种方法常用于测定两种目标蛋白质是否在体内结合,也可用于确定一种特定蛋白质的新的作用搭档 缺点:可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用 免疫共沉淀检测蛋白质的原理和常见问题 (2)方法 1) 收获培养的细胞(1×107-1×108)冷PBS洗涤2次 2)细胞裂解液裂解细胞,冰浴30min 3) 12000rpm 离心 30min 4)收集上清并加入适量抗体,4?C摇动1h 5)加入ProteinG-Sepharose悬液, 4?C摇动1h 6)细胞裂解液洗涤ProteinG-Sepharose混合液 7)离心弃上清 8)沉淀加2×蛋白Loading Buffer煮沸5-10min 9)离心,上清液跑SDS-PAGE 胶 10)考马氏亮兰染色、银染 Western Blot 质谱分析 (3)注意的问题 1)细胞裂解 采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质 相互作用,多采用非离子变性剂(NP40或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。 不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的cocktailer。 2)使用明确的抗体,可以将几种抗体共同使用 3)使用对照抗体: 单克隆抗体:正常小鼠的IgG或另一类单抗 兔多克隆抗体:正常兔IgG 3 酵母双杂交系统 (1)原理: 将编码某一蛋白X的DNA序列与DNA结合域BD的编码序列融合形成一个杂交体,将编码另一蛋白Y的DNA序列与DNA激活域AD的编码序列融合形成另一个杂交体,当两个杂交体共转化酵母细胞(此酵母细胞上游有DNA结合位点的报告基因),若X和Y没有相互作用,则单独不能激活报告基因的转录;若X和Y可相互作用,则使BD和AD靠近形成一个有效的转录激活子,激活报告基因的转录。因此可通过检测报告基因的转录来研究蛋白质X和Y的相互作用。 1)已知蛋白之间相互作用的检测: 2)蛋白质的功能域研究:通过对其中某一个蛋白质作缺失或定点突变,再用此系统检测是否还存在相互作用,可阐明其功能域
或关键氨基酸; 3)克隆新基因和新蛋白:将感兴趣的蛋白质基因与BD基因构建成“诱饵”表达质粒,将某一器官或组织的cDNA文库与AD基因构建成“猎物”基因库,共转化酵母细胞,可筛到与感兴趣蛋白质相互作用的蛋白质的cDNA序列,并推测其蛋白质序列。 4 蛋白质芯片 其制作原理类似于基因芯片,所不同的是,蛋白、多肽芯片所用的样品是提纯的蛋白、多肽。其检测的原理类似于抗原、抗体检测的ELISA法。如采用双抗夹心的形式,可通过机械点涂的方法,将多种不同的单克隆抗体点样固定在固相介质表面,如PVDF膜上,制备成抗体蛋白芯片,与制备的多种抗原样本杂交、结合,芯片上的抗体捕获相应的抗原,然后再与标记的多种不同的抗体杂交,由于抗原具有多价结合表位而结合标记抗体,根据杂交信号的有无、多少而进行定性、定量的分析。 第- 15 -页(共44页) 细胞细胞细胞细胞ELISA操作步骤操作步骤操作步骤操作步骤 Cellular ELISA Protocol Formalin Fixed Cell Plates 1. Trypsinize confluent flasks 2. Pool and count cells 3. Centrifuge at 1500 rpm for 10 minutes 4. Resuspend to the appropriate concentration in complete medium 4 x 105 cells/ml for epithelial cells 2 x 105 cells/ml for fibroblast cells 5. Add 100 ?l/cell to 96 well culture plates. 6. Incubate overnight at 37oC. 7. Wash plates twice with PBS 8. Add 125 ?l/well 10% Buffered Formalin 9. Fix for 15 minutes at room temperature 10. Wash three times with di-H2O. 11. Blot dry. 12. Store at 2-8oC. Reagents 1. PBS:1% BSA 2. PBS:2% BSA 3. Carbonate Buffer 1.59 g Na2CO3 2.93 g NaHCO3 Dissolve in 900 ml di-H2O. Check pH and adjust to 9.6 necessary. Qs. to 1 liter. 4. 10X Substrate Buffer, pH 6.0 36.6 g Citric Acid, monohydrate 113.5 g Potassium dibasic phosphate Dissolve in 900 ml di-H2O. Check pH and adjust to 6.0 if necessary. Qs. to 1 liter. 5. 0.3% H2O2 Dilute 30% stock Peroxide 1:100 in di-H2O. 6. OPD Stock, 4.0% 4 g OPD in 100 ml di-H2O. Aliquot and store at -20oC. Protect from light. 4.5N H2SO4 12.0 ml Concentrated Sulfuric Acid 88.0 ml di-H2O Procedure 1. Wash ELISA plates once with di-H2O. 2. Add 250 ?l/well PBS:2% BSA. 3. Incubate 1 hour at 37oC. 4. Wash 3 times with di-H2O. 5. Add 50 ?l/well supe, ascites, or controls diluted in PBS:1%BSA. 6. Incubate for 2 hr at 37oC. 7. Wash 5 times with di-H2O. 8. Add 50 ?l/well anti-mouse IgG:HRP diluted in PBS:1% BSA. 9. Incubate for 1 hr at 37oC. 10. Wash 5 times with di-H2O. Wash once with carbonate buffer. 11. Add 50 ?l/well working substrate solution 0.5 ml 4.0% OPD 5 ?l 30% H2O2 1.0 ml 10X Substrate buffer 8.5 ml di-H2O. 12. Incubate for 20 minutes at room temperature. 13. Add 25 ?l/well 4.5N Sulfuric Acid 14. Read A490 Notes 1. Test all supernatants at 1:5 dilution. Test ascites at 1:100 第- 16 -页(共44页) 如何正确的进行如何正确的进行如何
正确的进行如何正确的进行ELISA测定操作测定操作测定操作测定操作 临床ELISA测定现通常为采用手工操作的以微孔板条为固相的测定模式,测定操作非常简单,一般涉及到标本的收集保存、试剂准备、加样、温育、洗板、显色、比色、结果判断和结果报告及解释等方面,其中任一步骤的不当都会影响测定结果,且尤以加样、温育和洗板等步骤为甚。现分述如下。 一一一一、、、、临床标本的收集和保存临床标本的收集和保存临床标本的收集和保存临床标本的收集和保存 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 用于ELISA测定的临床标本最为常用的是血清(浆),有时因为特定的检测目的,也用到唾液、脑脊液、尿液、粪便等标本。目前临床上使用血清标本测定的标志物一般有传染性病原体的抗原和抗体、肿瘤标志物、激素、特种蛋白、细胞因子和治疗药物等。对用于激素和治疗药物测定的血清标本的收集,要注意收集时间甚或体位有可能会对测定结果产生影响。如可的松在早晨4~6点之间,会有一峰值出现:生长激素、促黄体激素(LH)和促卵泡激素(FSH)均以阵发性方式释放,因此,在测定此类激素时,有必要在密切相连的时间间隔内采取数份血样本,以其中间值为测定值。又如当从卧位变为站立位时,血清中肾素活性将出现明显增高。再如治疗药物的检测,应根据药代动力学选择服药后的最适时间抽血检测。用于传染性病原体的抗原和抗体、肿瘤标志物和特种蛋白等的检测的血清标本的收集则没有时间和体位方面的影响,只是在处理和保存方面要考虑以下几个方面: (1)要注意避免出现严重溶血。血红蛋白中含有血红素基团,其有类似过氧化物的活性,因此,在以HRP为标记酶的ELISA测定中,如血清标本中血红蛋白浓度较高,则其就很容易在温育过程中吸附于固相,从而与后面加入的HRP底物反应显色。 (2)样本的采集及血清分离中要注意尽量避免细菌污染,一则细菌的生长,其所分泌的一些酶可能会对抗原抗体等蛋白产生分解作用;二则一些细菌的内源性酶如大肠杆菌的β-半乳糖苷酶本身会对用相应酶作标记的测定方法产生非特异性干扰。 (3)血清标本如是以无菌操作分离,则可以在2~8℃下保存一周,如为有菌操作,则建议冰冻保存。样本的长时间保存,应在-70℃以下。 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 (4)冰冻保存的血清标本须注意避免因停电等造成的反复冻融。标本的反复冻融所产生的机械剪切力将对标本中的蛋白
等分子产生破坏作用,从而引起假阴性结果。此外,冻融标本的混匀亦应注意,不要进行剧烈振荡,反复颠倒混匀即可。 (5)标本在保存中如出现细菌污染所致的混浊或絮状物时,应离心沉淀后取上清检测。 二二二二、、、、试剂准备试剂准备试剂准备试剂准备 在临床实验室,对试剂准备一般不太注意,通常的做法是,在实验时将试剂从冰箱中拿出来即用,而忽略了这种做法有可能影响后面温育时间不够的问题,其直接的后果是对一些弱阳性标本的检测出现假阴性。因此在ELISA测定中试剂的准备最为关键的是,在实验开始前,将试剂盒先从冰箱中拿出来,在室温下放置20分钟以上后,再进行测定,以使试剂盒在使用前与室温平衡。这样做的目的,主要是为了在后面的温育反应步骤中,能使反应微孔内的温度能较快地达到所要求的高度,以满足测定要求。其次,目前的商品ELISA试剂盒中的洗板液均需在实验室使用时对所提供的浓缩液稀释配制,因此稀释时所用的蒸馏水或去离子水应保证质量。此外,当试剂盒以OPD为底物时,则底物溶液应在反应显色前临时配制。 三三三三、、、、加血清样本及反应试剂加血清样本及反应试剂加血清样本及反应试剂加血清样本及反应试剂 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 在现在的ELISA商品试剂盒中,血清样本的加入几乎是唯一的要使用微量加样器加入样本的步骤。使用微量加样器加样必须注意的关键点是:加样不可太快,要避免加在孔壁上部,不可溅出和产生气泡。加样太快,无法保证微量加样的准确性和均一性。加在孔壁上部的非包被区,易导致非特异吸附。溅出会对邻近孔产生污染。出现气泡则反应液界面有差异。试剂的加入在国产试剂盒中基本上均是从滴瓶中滴加,除了要注意滴加的角度外,滴加的速度也很重要,滴加太快,很容易出现重复滴加或加在两孔之间的现象,这样就会在孔内的非包被区出现非特异吸附,从而引起非特异显色。所以,有时候一份标本用相同的试剂盒这次测定为阳性,下次测定为阴性,往往就是上述加样及试剂的错误所致。 四四四四、、、、温育温育温育温育 温育是ELISA测定中影响测定成败最为关键的一个因素。ELISA作为一种固相免疫测定,抗原抗第- 17 -页(共44页) 体的结合反应在固相上进行,要使液相中的抗原或抗体与固相上的特异抗体或抗原完全结合,必须在一定的温度条件下反应一定的时间。温育所需时间与温度成反比,即温度越高,则所需时间相对较短。最为常用的温育温度有37℃和室
温,其次是43℃和2~8℃。 温育这一步是临床ELISA测定中最容易出现问题的步骤。通常目前国内ELISA商品试剂盒的反应温育时间为37℃ 30分钟~1小时,进口ELISA试剂盒则通常为37℃ 1~2小时才能有较完全的结合,低于1小时,可能会影响测定下限。因此,关于温育,在实际测定操作中一定要注意以下几点: (1)要保证在设定的温度下有足够的反应时间。一般来说,加完样本和/或反应试剂后,将微孔板从室温拿至水浴箱或温箱中时,孔内温度从室温升至37℃,需要一定的时间,尤其是在室温比较低以及非水浴的状态下,这段升温时间可能还比较长,而在临床实验室中,很少有人注意这个问题,通常是将微孔板一放入温箱即开始计时,这样就很容易造成实际测定中温育时间不够,弱阳性样本测不出来的问题。曾有一地处南方的血站同行提出了一个问题,就是在每一年的冬季总有那么一个多月的时间,在做HBsAg测定的室内质控中,测定由卫生部临床检验中心供应的1 ng/ml弱阳性样本时,总是测不出来,不知原因为何?这可能就与南方冬天室内温度较低有关,此时微孔板转入温箱后37℃温育时间不够,以致弱阳性样本测定为阴性。因此,为保证37℃下足够的温育时间,临床实验室可自行确定本实验室不同季节(不同室温下)微孔板从室温拿至温箱后需要多长时间孔内温度才能达到37℃,从而适当延长板条在温箱中的放置时间。具体的做法是,用一小温度计放置板孔反应溶液中测量观察即可。 (2)温育温度的选择。在有的ELISA试剂盒的说明书中,指出温育温度可有两种,例如,一种是37℃下1小时,另一种则为43℃下45分钟。从免疫测定的抗原抗体反应的本质来看,在较低的温度下反应较长的时间最为完全。如2~8℃下反应24小时。较高的反应温度,由于分子运动的加怜惜,反应时间缩短,这一点对分子含量较多的强阳性样本的测定没有问题,但对分子含量少的弱阳性样本则有漏检的可能。因此,我们建议在临床ELISA测定中尽量使用较低温育温度较长反应时间的条件。 (3)“边缘效应”的排除。以前在使用96孔板的ELISA测定中,常发现有“边缘效应”,即外周孔显色较中心孔深,产生这种“边缘效应”的原因可能为96孔板周孔与中心孔表面或热力学特征的不同。但有研究证实在温育中的热力学梯度可能是根本原因之所。聚苯乙烯本身为不良热导体,在实验室的常规ELISA测定中,将板从室温(通常在25℃左右)置于37℃温箱,板也升温时,在外周孔与中心孔之间可能存在一热力学梯度。因此使用水浴或在将反应溶液加入至板孔中时,将板和溶液均加热至
温育温度(如37℃),就可以很容易地排除“边缘效应”,并且可提高测定的重复性。 总而言之,在临床ELISA测定中,要保证好的测定效果,可采用下述简单办法来确保温育条件,即尽量采用水浴,温育中让微孔板浮于水面上,或将浸透水的沙布放入一大饭盒中成一湿盒,放于温箱中,这样就会因为板条孔底部直接与37℃水或湿布的接触,以及水浴箱或湿盒内的高温度,而使反应溶液的温度迅速与温室平衡。 五五五五、、、、洗板洗板洗板洗板 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 固相免疫测定技术是一种非均相免疫测定技术,需以洗涤操作将特异结合于固相的抗原或抗体与反应温育过程中吸附的非特异成份分离开来,以保证ELISA测定的特异性。因此,洗板对于ELISA测定来说,也是极其关键的一步。以HRP作为标记酶的ELISA试剂盒中使用的洗板液一般为含0.05%Tween20的中性PBS,Tween20为一种非离子去垢剂,既含亲水基团,也含疏水基团,其在洗涤中的作用机理是,借助其疏水基团与经疏水性相互作用被动吸附于聚苯乙烯固相上蛋白的疏水基团形成疏水键,从而削弱蛋白与固相的吸附,同时在其亲水基团与液相中水分子的结合作用下,促使蛋白质脱离固相而进入液相,这样就可达到去掉非特异吸附物的目的,但由于抗体或抗原的包被通常也是通过在碱性条件下与固相的疏水性相互作用而被动吸附于固相,因此要注意非离子去垢剂的使用浓度,洗板液中Tween20浓度高于0.2%,可使包被于固相上的抗原或抗体解吸附而影响试验的测定下限。 在临床实验室中,ELISA测定的洗板一般有两种方式,即手工和洗板机洗板。手工洗板即是在每次反应温育后,将反应液吸出或甩干,然后在板孔中加满洗液,放置2~3分钟后,将洗液吸出或甩干,再在吸水纸上拍干。重复上述洗涤步骤3~4次,最后在吸水纸上拍干,即可进行下一步测定操作。洗板机洗板则是将上述手工操作改由洗板机进行,使用洗板机洗板的一个特点是,每次洗板后不能拍干,故有较多的液体残留,液体残留量小的洗板机洗板至彻底所需的次数要少于残留量大的洗板机。在特定第- 18 -页(共44页) 临床实验室所使用的洗板机,到底洗多少次能达到要求,可进行下面这个简单的实验:选择4×8 HBsAgELISA包被板条,每2×8孔分别加入相同一份弱阳性和一份阴性样本,按试剂盒说明加入酶结合物并完成温育后,洗板孔时按第一排4孔洗1次、第二批4孔洗2次、第3排4孔洗3次——直至第8排4孔洗8次,加底物显色测定,如洗3次后,显色不再改变,即洗3次的板孔
比色测定与4次、5次洗板的板孔的吸光度等相同,阳性/阴性值保持最大不变,则可以认定该实验室所用洗板机3次洗板即可达到要求。 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 六六六六、、、、显色显色显色显色 在目前的以HRP作为标记酶的商品ELISA试剂盒中,如以TMB为底物,则提供的底物为A和B两瓶应用液;如以OPD为底物,则试剂盒提供OPD片剂或粉剂,临用前配制。一般商品试剂盒显色反应条件为37℃或室温反应15~30分钟。从理论上说,37℃30分钟才可以使HRP的底物催化反应完全,尽管在最初的10分钟内,绝大部份催化反应即可完成。因此,为使弱阳性样本孔能有充分的显色,建议在37℃下反应25~30分钟后,终止反应比色测定。 此外,在加入底物开始显色反应前,最好是先检查一下底物溶液的有效性,即可将A和B两种液各加一滴于清洁的空板孔或eppendorf管中,观察是否有显色出现,如有,则说明底物已变质。以OPD为底物,配好后应为无色,否则就不能使用。以TMB为底物,整个显色反应过程无需避光,而以OPD为底物,则需避光进行。关于TMB和OPD的显色反应特点及注意点可参考前面有关章节内容。显色反应完成后,加入酸终止反应,振荡混匀后即可进行下面的比色测定或肉眼判断结果。 七七七七、、、、比色比色比色比色 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 ELISA的比色测定由酶标仪进行,有的同行可能会认为,既然由酶标仪进行,那么此时便可以万事大吉了,其实不然,因为当代较为先进的酶标仪器仪表,均有较多的功能,使用不当,会得到令人难以理解的结果。如使用酶标仪比色测定后,有许多阴性测定孔的吸光度值为负数或测定假阳性率大大增加等等。这主要是没有正确地理解和使用酶标仪所致。至于如何正确理解和使用酶标仪详见后面有关章节。此处,只是强调下面两点: (1)比色测定时,一定要注意酶标仪的波长是否已调至合适或所用滤光片是否正确。由于有的临床实验室在进行ELISA测定时,以TMB为底物和以OPD为底物的试剂盒均有使用,而前者比色波长为450nm,后者为492nm,滤光片需根据要求随时更换。因此,容易出现滤光片错用的问题。 (2)单波长或双波长比色选择的问题。中档以上的酶标仪基本上都同时具有单波长和双波长比色功能。所谓的单波长比色即是通常的以对显色具有最大吸收的波长如450nm或492nm进行比色测定;而双波长双色则酶标仪在敏感波长如450nm和非敏感波长如630nm下各测定一次,敏感波上下的吸光度测定值
为样本测定酶反应特异显色的吸光度与板孔上指纹、刮痕、灰尘等脏物所致的吸光度之和;非敏感波长下测定即改变波长至一定值,使得样本测定酶反应特异显色的吸光度值为零,此时测得的吸光度即为脏物的吸光度值。最后酶标仪给出的数值为敏感波长下的吸光度值与非常感波长下的吸光度值的差。因此,双波长比色测定具有能排除由微滴板本身、板孔内标本的非特异吸收、指纹、刮痕、灰尘等对特异显色测定吸光度的影响的优点,一般不必设空白孔。如在使用双波长比色时,仍设空白孔,就可能会造成前面提到的测定孔吸光度为负数的现象。由于ELISA测定中单个空白孔的非特异吸收上有一定程度的不确定性,也就是说每次测定或同次测定空白孔位置的不同均有可能得到不同吸光度测定值,故而在ELISA测定比色时,最好是使用双波长比色。 八八八八、、、、结果判定结果判定结果判定结果判定 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 临床ELISA测定按其表示测定结果的方式分为定性和定量测定两大类。定性测定只是对标本中是否含有待测抗原或抗体作出“有”或“无”的结论,分别用“阳性”和“阴性”来表示。可见定性测定通常是用于传染性病原体的抗原或抗体的测定,以判断特定病原体感染的存在与否。而定量测定则是对标本中待测抗原的多少进行量值测定,以具体数值表示。定量测定基本上是用于非病原体抗原物质的测定,如激素、细胞因子、肿瘤标志物、小分子药物等。目前国内在临床上应用的ELISA试剂盒绝大部份是用于传染性病原体的抗原或抗体的定性测定,也有少部份用于αFP、hCG、细胞因子等的定量测定。ELISA定性测定的“阳性”和“阳性”的判定依据是试剂盒所确定的阳性判定值(Cut-off)。定量测定的“量值”依据是试剂盒中所带标准品同时测定得出的剂量反应曲线(又称标准曲线)。有关ELISA定性和定量测定结果的第- 19 -页(共44页) 数据处理后面将有专门章节讨论。本处只想强调的一点是,ELISA定性测定的“阴性”和“阳性”结果的判定依据只能是试剂盒本身所确定的Cut-off值,而不能以卫生部临床检验中心供应弱阳性定值质控血清。为什么要强调这一点呢?主要是因为以前有很多基层实验室均使用部中心供应的弱阳性定值质控血清(以前也称“临界值”血清)的测定吸光度来判定结果,高于其判为阳性,反之为阴性,而不管试剂盒Cut-off值为何。到目前为止,仍有一些实验室在坚持这种错误的做法。试剂盒的Cut-off值的设立是建立在一系列科学试验及统计学研究的
基础上的(详见后述),而部中心供应的弱阳性定值质控血清主要是供临床实验室进行室内质控时使用。 下面再解释一下在下面再解释一下在下面再解释一下在下面再解释一下在ELISA定性测定结果判定中常用的一些缩写定性测定结果判定中常用的一些缩写定性测定结果判定中常用的一些缩写定性测定结果判定中常用的一些缩写。。。。 (1)S/CO:其中S为Sample(样本)或Specimen(标本)的简写,表示的是标本测定的吸光度值,CO为Cut-off值的简写。除竞争抑制法外,其它ELISA定性测定模式中,当S/CO值大于或等于1时,标本的测定为阳性,小于1时为阴性。 (2)S/N或P/N:其中S同(1),N为Negative(阴性对照)的简写,P为Patient(患者)的简写。较早的试剂盒很多都使用S/N或P/N≥2.1为阳性判定标准,现仍有一些试剂盒使用这种方式。这种方式与S/CO方式无根本性区别,只不过是前者将阴性对照(N)的2.1倍视为Cut-off值而已。 九九九九、、、、结果报告及解释结果报告及解释结果报告及解释结果报告及解释 本文转载自生物秀本文转载自生物秀本文转载自生物秀本文转载自生物秀 临床ELISA测定结果的报告较为简单。定性测定报阴性或阳性即可;定量测定则报出具体的数值。结果解释比较起来要复杂的多,它要求实验室技术人员对所测定的项目有较为全面的知识基础。例如,对乙肝“两对半”结果的解释,不但要求检验者要知道不同的结果模式的临床意义,而且必须对乙肝病毒的分子生物学、分子的变异及其对表型的影响有更深层次的了解。现在,检验不再是单纯的实验室测定,而已成为一门临床医学学科,即检验医学,这就要求从事医学检验工作的检验医师,对所做的测定项目除了知其然,还要知其所以然,否则就难免为时代所淘汰。 综上所述综上所述综上所述综上所述,尽管ELISA测定的操作步骤非常简单,但有可能会影响测定结果的因素却较多,分布在测定操作的各步之中,尤以加样、温育和洗板为甚。为帮助大家分析查找测定中出现问题的可能原因,特对常见问题及原因归纳总结于下表。 临床ELISA测定中可能会出现的问题及可能的原因 (非试剂盒本身的原因) 1.弱阳性质控样本检测不出 温育的时间或温度不够;显色反应时间太短;所用配制缓冲液的蒸馏水有问题 2.测定的重复性差 (相同样本两次测定结果不一致) 这是典型的由测定操作引起的问题,包括 (1)加样本及试剂量不准;孔间不一致; (2)加样过快,孔间发生污染; (3)加错样本; (4)加样本及试剂时,加在孔壁上部非包被区; (5)不同批号试剂
盒中组分混用; (6)温育时间、洗板、显色时间不一致; (7)孔内污染杂物; (8)酶标仪滤光片不正确; (9)血清标本未完全凝固即加入,反应孔内出现纤维蛋白凝固或残留血细胞,易出现假阳性反应等。 3.白板 (阳性对照不显色) (1)漏加酶结合物; (2)洗板液配制中出现问题,如量筒不干净,含酶抑制物(如叠氮钠)等。 (3)漏加显色剂A或B; (4)终止剂当显色剂使用。 4.全部板孔均有显色 (1)洗板不干净; (2)显色液变质; (3)加底物的吸光受酶污染; (4)洗板液受酶等污染。 第- 20 -页(共44页) ELISA法测定单克隆抗体的效价法测定单克隆抗体的效价法测定单克隆抗体的效价法测定单克隆抗体的效价 一、实验目的 1.深入了解ELISA 法测定抗体效价的原理。 2.掌握ELISA 法测定单克隆抗体效价的方法。 二、实验原理 ELISA 是以免疫学反应为基础,将抗原、抗体的特异性反应与酶对底物的高效催化作用相结合起来的一种敏感性很高的试验技术。免疫酶技术是将酶标记在抗体/抗原分子上,形成酶标抗体/酶标抗原,称为酶结合物。该酶结合物的酶在免疫反应后,作用于底物使之呈色,根据颜色的有无和深浅,定位或定量抗原/抗体。ELISA 法是免疫酶技术的一种,其特点是利用聚苯乙烯微量反应板(或球)吸附抗原/抗体,使之固相化,免疫反应和酶促反应都在其中进行。在每次反应后都要反复洗涤,这既保证了反应的定量关系,也避免了末反应的游离抗体/抗原的分离步骤。在ELISA 法中.酶促反应只进行一次,而抗原、抗体的免疫反应可进行一次或数次,即可用二抗(抗抗体)、三抗再次进行免疫反应。 目前常用的几种ELISA 方法有:测定抗体的间接法,测定抗原的双抗体夹心法和测定抗原的竞争法等。本实验采用间接法测定单克隆抗体效价。其主要过程为:首先将已知定量抗原吸附在聚苯乙烯微量反应板的凹孔内,加待测抗体,保温后洗涤以除去未结合的杂蛋白质,加酶标抗抗体,保温后洗涤,加底物保温30分钟后,加酸或碱终止酶促反应,用目测或光电比色测定抗体含量。 三、仪器、原料和试剂 仪器 聚苯乙烯96孔酶标板、微量移液管、酶联免疫阅读仪、水浴锅。 原料 单克隆抗体 试剂 1. 抗原及酶标记抗体 ①抗原:兔抗人IgG(Rabbit Aanti-human IgG,Code No.A0423); ②酶标抗抗体:兔抗鼠IgG-HRP(Rabbit Anti-mouse IgG-HRP,Code No.P0260);均为 DAKO 公司产品,使用时按照说明书要求稀释。 4. 洗涤液(含0.05%Tween 20的PBS):1LPBS 中加入Tween-20 500?L。 5. 封闭液(含1%牛血清白蛋白,0.1%Tween 20的PBS):10mLPBS 中加入100mgBSA,10?LTween-20。 6.
底物溶液 ①磷酸钠盐缓冲液(0.1mol/LpH6.0):称Na2HPO4·12H2O2.2g,NaH2PO4·2H2O 6.84g,用蒸馏水溶解,定容至500mL。 ② TMB 贮液:称60mgTMB 溶于10mL 二甲基亚砜中,4℃避光保存。 ③底物应用液:现用现配,磷酸钠缓冲液10mL,TNB 贮液10?L。30%H2O2 15?L,混匀。 7. 终止液:2mol/LH2SO4 四、操作步骤 ①抗原包被:兔抗人IgG 作为抗原,用包被液l:8000稀释,100?L/孔加入聚苯乙烯96孔反应板 中。4℃放置过夜。 ②洗涤:次日倾去凹孔内的液体,洗涤液洗3次。 ③封闭:加l00?L/孔封闭液,室温放置0.5h。 ④洗涤:用洗涤液洗3次。 ⑤加待测样品(一抗):将含单克降抗体的细胞培养上清在另—块板上用PBS 连续稀释(按照1:2或1:10),100?L /孔加到已包被的板上,每个样品平行做两份,PBS 或空白培养基作为阴性对照,已第- 21 -页(共44页) 知样品作为阳性对照。加盖37℃恒温箱温育1~2h。 ⑥洗涤:用洗涤液洗3次。 ⑦加酶标抗抗体:兔抗鼠IgG-HRP,用封闭液l :8000稀释,100?L/孔,加盖37℃恒温箱温育1h。 ⑧洗涤:用洗涤液洗5次,蒸馏水洗2次。 ⑨显色:加新鲜配制的底物溶液100?L/孔,室温暗处放置5~30min,显示蓝色。 ⑩终止反应、比色:加50?L/孔终止液.颜色变黄;用酶标仪测定450nm 处各孔的吸光值,阳性反应的最大稀释度为待测样品的效价。 免疫组化基本原理免疫组化基本原理免疫组化基本原理免疫组化基本原理 免疫组化是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂 (荧光素、酶、金属离子、同位素) 显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。 众所周知,抗体与抗原之间的结合具有高度的特异性。免疫组化正是利用这一特性,即先将组织或细胞中的某些化学物质提取出来,以其作为抗原或半抗原去免疫小鼠等实验动物,制备特异性抗体,再用这种抗体(第一抗体)作为抗原去免疫动物制备第二抗体,并用某种酶(常用辣根过氧化物酶)或生物素等处理后再与前述抗原成分结合,将抗原放大,由于抗体与抗原结合后形成的免疫复合物是无色的,因此,还必须借助于组织化学方法将抗原抗体反应部位显示出来(常用显色剂DAB显示为棕黄色颗粒)。通过抗原抗体反应及呈色反应,显示细胞或组织中的化学成分,在显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞或组织原位确定某些化学成分的分布、含量。组织或细胞中凡是能作抗原或半抗原的物质,如蛋白质
、多肽、氨基酸、多糖、磷脂、受体、酶、激素、核酸及病原体等都可用相应的特异性抗体进行检测。 免疫组织化学技术按照标记物的种类可分为免疫荧光法、免疫酶法、免疫铁蛋白法、免疫金法及放射免疫自影法等。 用于病理诊断的主要有免疫荧光法和免疫酶法。免疫荧光法是现代生物学和医学中广泛应用的方法之一,包括荧光抗体和荧光抗原技术,具有抗原抗体反应的特异性,染色技术的快速性,在细胞或组织上定位的准确性,以及荧光效应的灵敏性等优势。但是,由于免疫荧光法必须具有荧光显微镜,荧光强度随时间的延长而逐渐消退,结果不易长期保存等缺点,在普及应用上受到一定限制,而逐渐被免疫酶法所取代。 免疫组化技术优点免疫组化技术优点免疫组化技术优点免疫组化技术优点 (1)特异性强 免疫学的基本原理决定了抗原与抗体之间的结合具有高度特异性,因此,免疫组化从理论上讲也是组织细胞中抗原的特定显示,如角蛋白(keratin)显示上皮成分,LCA显示淋巴细胞成分。只有当组织细胞中存在交叉抗原时才会出现交叉反应。 (2)敏感性高 在应用免疫组化的起始阶段,由于技术上的限制,只有直接法、间接法等敏感性不高的技术,那时的抗体只能稀释几倍、几十倍;现在由于ABC法或SP法的出现,使抗体稀释上千倍、上万倍甚至上亿倍仍可在组织细胞中与抗原结合,这样高敏感性的抗体抗原反应,使免疫组化方法越来越方便地应用于常规病理诊断工作。 第- 22 -页(共44页) (3)定位准确、形态与功能相结合 该技术通过抗原抗体反应及呈色反应,可在组织和细胞中进行抗原的准确定位,因而可同时对不同抗原在同一组织或细胞中进行定位观察,这样就可以进行形态与功能相结合的研究,对病理学研究的深入是十分有意义的。 免疫组化实验步骤免疫组化实验步骤免疫组化实验步骤免疫组化实验步骤 1 仪器设备 (1)18cm不锈钢高压锅或电炉或医用微波炉; (2)水浴锅 2 试剂 (1)PBS缓冲液(pH7.2~7.4):NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L。 (2)0.01mol/L柠檬酸盐缓冲液(CB,pH6.0,1000ml):柠檬酸三钠 3g,柠檬酸 0.4g。 (3)0.5mol/L EDTA缓冲液(pH8.0):700ml水中溶解186.1gEDTA·2H2O,用10 mmol/L NaOH调至pH8.0,加水至1000ml。 (4)1mol/L的TBS缓冲液(pH8.0):在800ml水中溶解121gTris碱,用1N的HCl调至pH8.0,加水至1000ml。 (5)酶消化液: a、0.1%胰蛋白酶液:用0.1%CaCl2(pH7.8) 配制。 b、0.4%胃蛋白酶液:用0.1N的HCl配制。 (6)3%甲醇-H2O2溶液:
用30%H2O2和80%甲醇溶液配制。 (7)封裱剂: a 甘油和0.5mmol/L碳酸盐缓冲液(pH9.0~9.5)等量混合; b 油和TBS(或PBS)配制。 (8)TBS/PBS pH9.0~9.5,适用于荧光显微镜标本;pH7.0~7.4适合于光学显微镜标本。 3 操作流程 (1)脱蜡和水化 脱蜡前,应将组织芯片在室温中放置60分钟或60℃恒温箱中烘烤20分钟。 1)组织芯片置于二甲苯中浸泡10分钟,更换二甲苯后再浸泡10分钟; 2)无水乙醇中浸泡5分钟; 3)95%乙醇中浸泡5分钟; 4)70%乙醇中浸泡5分钟; (2)抗原修复 用于福尔马林固定的石蜡包埋组织芯片。 1)抗原热修复 在沸水中加入EDTA(pH8.0)或0.01M枸橼酸钠缓冲溶液(pH6.0)。盖上不锈钢高压锅的盖子,但不进行锁定。将玻片置于金属染色架上,缓慢加压,使玻片在缓冲液中浸泡5分钟,然后将盖子锁定,第- 23 -页(共44页) 小阀门将会升起来。10分钟后,去除热源,置入凉水中,当小阀门沉下去后打开盖子。本方法适用于较难检测或核抗原的抗原修复。 2)煮沸热修复 电炉或者水浴锅加热0.01M枸橼酸钠缓冲溶液(pH6.0)至95℃左右,放入组织芯片加热10~15分钟。 3)微波热修复 在微波炉里加热0.01M枸橼酸钠缓冲溶液(pH6.0)至沸腾后将组织芯片放入,断电,间隔5~10分钟,反复1-2次。适用的抗原有:AR,Bax,Bcl-2,C-fos,X-jun,C-kit,C-myc,E-cadherin,Chromogranin A,Cyclin,ER,Heat shock protein,HPV,Ki-67,MDMZ,p53,p34,p16,p15,P-glycoprotein,PKC,PR,PCNA,ras,Rb,TopoismeraseⅡ等。 4)酶消化方法 常用0.1%胰蛋白酶和0.4%胃蛋白酶液。胰蛋白酶使用前预热至37℃,切片也预热至37℃,消化时间约为5~30分钟;胃蛋白酶消化37℃时间为30分钟。适用于被固定遮避的抗原,其中有:Collagen,Complement,Cytokeratin,C-erB-2,GFAP,LCA,LN等。 (3)免疫组织化学染色 SP法 1)脱蜡、水化; 2) PBS洗2~3次各5分钟; 3)3%H2O2(80%甲醇)滴加在TMA上,室温静置10分钟 4)PBS洗2~3次各5分钟; 5)抗原修复; 6)PBS洗2~3次各5分钟; 7)滴加正常山羊血清封闭液,室温20分钟。甩去多余液体。 8)滴加Ⅰ抗50?l,室温静置1小时或者4℃过夜或者37℃1小时。 9)4℃过夜后需在37℃复温45分钟。 10)PBS洗3次各5分钟; 11)滴加Ⅱ抗40~50?l,室温静置,或37℃1小时; 12)抗中可加入0.05%的tween-20。 13)BS洗3次各5分钟; 14)DAB显色5~10分钟,在显微镜下掌握染色程度; 15)PBS或自来水冲洗10分钟; 16)苏木精复染2分钟,盐酸酒精分化;
17)自来水冲洗10~15分钟; 18)脱水、透明、封片、镜检。 第- 24 -页(共44页) SABC法 1)脱蜡、水化。 2)PBS洗两次各5分钟。 3)用蒸馏水或PBS配置新鲜的3%H2O2,室温封闭5~10分钟,蒸馏水洗3次。 4) 抗原修复。 5) PBS洗5分钟。 6) 滴加正常山羊血清封闭液,室温20分钟。甩去多余液体。 7) 滴加Ⅰ抗,室温1小时或者4℃过夜或者37℃1小时(4℃过夜后在37℃复温45分钟)。 8) PBS洗三次每次2分钟。 9) 滴加生物素化二抗,20℃~37℃20分钟。 10)PBC洗3次每次2分钟。 11)滴加试剂SABC,20℃~37℃20分钟。 12)PBS洗4次每次5分钟。 13)DAB显色:DAB显色试剂盒或者自配显色剂显色(镜下掌握显色程度)。 14)蒸馏水洗。苏木素复染2分钟、盐酸酒精分化。 15)脱水、透明、封片、镜检。 ? 免疫组化技术之免疫荧光法免疫组化技术之免疫荧光法免疫组化技术之免疫荧光法免疫组化技术之免疫荧光法 免免免免疫荧光法是最早建立的免疫组织化学技术,免疫荧光法的基本原理是抗原抗体特异性结合的原理,将已知的抗体或抗原分子标记上荧光素,当与其相对应的抗原或抗体起反应时,在形成的复合物上就带有一定量的荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下就可以看见发出荧光的抗原抗体结合部位,从而可确定组织中某种抗原的定位,进而还可进行定量分析。由于免疫荧光技术特异性强、灵敏度高、快速简便,所以在临床病理诊断、检验中应用比较广。 常用的荧光素有: ①异硫氰酸荧光素(fluorecein isothiocyante,FITC),为黄色、橙黄色或褐黄色结晶粉末,有两种异构体,易溶于水和酒精等溶剂。分子量为389,最大吸收光谱为490~495,最大发射光谱为520~530urn,呈现明亮的黄绿色荧光,是最常用的标记抗体的荧光素。 ②四甲基异氰酸罗达明(tetrametrylrhodarnine isothiocyante,TRITC),是一种紫红色粉末,较稳定,是罗达明(rhodamine)的衍生物。最大吸收光谱550urn,最大发射光谱620urn呈橙红色荧光,与FITC发射的黄绿色荧光对比鲜明,常用于双标记染色。 按照抗原抗体反应的结合步聚,免疫荧光法可分为以下三种: 1) 直接法 用荧光素标记的特异性抗体直接与相应的抗原结合,以检查出相应的抗原成分。 2) 间接法 先用特异性抗体与相应的抗原结合,洗去未结合的抗体,再用荧光素标记的抗特异性抗体(间接荧光抗体)与特异性抗体相结合,形成抗原一特异性抗体一间接荧光抗体的复合物。在此复合物上带有比直接法更
多的荧光抗体,所以,此法较直接法灵敏。 3) 补体法 用特异性的抗体和补体的混合液与标本上的抗原反应,补体就结合在抗原抗体复合物上,再用抗补体的荧光抗体与之相结合,就形成了抗原一抗体一补体一抗补体荧光抗体的复合物。荧光显微镜下所见到的发出荧光的部分即是抗原所在的部位。补体法具有敏感性强的优势,同时适用于各种不同种属来源的特异性抗体的标记显示,在各种不同种属动物抗体的检测上为最常用的技术方法。 4) 双重免疫荧光法 在对同一组织细胞标本上需要检测两种抗原时,可进行双重荧光染色,即将两种特异性抗体(例第- 25 -页(共44页) 如抗A和抗B)分别以发出不同颜色的荧光素进行标记,抗A抗体用异硫氰酸荧光素标记发出黄绿色荧光,抗B抗体用四甲基异硫氰酸罗明达标记发出橙红色荧光,将两将荧光抗体按适当比例混合后,加在标本上(直接法)就分别形成抗原抗体复合物,发出黄绿色荧光的即抗A抗体结合部位,发出橙红色荧光的即抗B抗体结合的部位,这样就明确显示两种抗原的定位。 免疫组化技术之免疫酶法免疫组化技术之免疫酶法免疫组化技术之免疫酶法免疫组化技术之免疫酶法 免疫酶法是借助酶细胞化学等手段显示组织抗原(或抗体)的新技术,是在免疫荧光法的基础上发展起来的。免疫酶法的基本原理与免疫荧光法有所相似,免疫酶法是将酶以共价键的形式结合在抗体上,制成酶标抗体,再借助酶对底物的特异催化作用,生成有色的不溶性产物或具有一定电子密度的颗粒,于光镜或电镜下进行细胞表面或细胞内部各种抗原成分的定位。已如前述,免疫荧光法具有操作简便、灵敏、特异性高、省时的优势,但同时也具有令人遗憾的不足,特别是荧光标本不能长期保存以及需要价格昂贵的荧光显微镜才能观察的问题。为此,Nakane等人(1966)尝试了用酶代替荧光素来标记抗体的方法,从而成功地开创了酶标记抗体的新技术(酶标抗体法)。Sternbenger等人又将非标记抗体过氧化物酶法成功地引人,使免疫酶法有了很大的进步,成为当今使用最为广泛的免疫组织化学技术。 免疫酶法与免疫荧光法相比较,具有以下优点:酶反应产物呈现的颜色不仅能在一般的普通生物显微镜下观察,而且其产物因具有一定的电子密度也可在电镜下观察(免疫电镜技术),光镜与电镜的结合,使灵敏度进一步提高,标本又能长期保存,并能加设HE染色等其他复染,有利于将被检测物质与病变的形态学改变联系起来(定性与定位),弥补了免疫荧光法的不足。 从理论上讲,
用细胞化学方法能显示的酶,均可用于标记抗体进行免疫酶法染色,但实际上能用于免疫组织化学技术的酶并不多。sternbenger等人指出:用于标记的酶应具备以下六点: 1) 酶催化的底物必需是特异的,而且容易被显示,即催化反应所形成的产物易于 在光镜和电镜下观察。 2) 酶反应的终产物所形成的沉淀必须稳定,即终产物不能从酶活性部位向周围组织弥散,而影响组织学定位。 3) 较易获得纯的酶分子。 4) 中性PH值时,酶分子应稳定。 5) 在酶标过程中,酶连接在抗体上,不能影响二者的活性。 6) 被检组织中,不应存在与标记酶相同的内源性酶或类似的物质,否则结果将难以判定。 上述六点中以1.2两点最为重要,因为并非所有的容易显示的酶均能形成不溶性的复合物。符合上述要求的,最为常用的酶是辣根过氧化物酶(Horseradish Peroxidase,H::flJ)。其次是碱性磷酸酶(Alkaline phosphatase,AKP),除此两种外,还有葡萄糖氧化酶(Glucose oxidase,GOD)等,但因其形成的不溶性色素扩散作用较大,在应用上受到很大限制。 HRP广泛分布于植物界,因其辣根含量最高而得名。它是由无色酶蛋白和深棕色的铁叶结合组成的一种糖蛋白(糖占18%左右),分子量为40000道尔顿,等电点3~9,最适 PH为 5.0左右。HRP易溶于水和58%以下的饱和硫酸铰溶液,其活性部分为铁叶琳,称辅基。酶的蛋白部分无活性。酶蛋白和铁叶琳辅基的最大吸收光谱分别为275urn和403urn;HRP的纯度用两者的光密度比值(M03人工卫75)来衡量,以RZ(Reinheitzahi)来表示。一般认为,标记酶的RZ值为 3.0左右,不应<2.8,RZ值越小,酶的纯度越差,对于纯度低,质量差的酶,需经纯化后才能使用。 AKP是一种磷酸酶的水解酶,磷酸单酯酶对于连接于作用物磷酸基上的醇基没有特异性,因它可以水解多种有机磷酸酯,生成醇和磷酸盐离子。该酶在许多人体组织或动物组织中有分布,如肝、胎盘、白细胞、肾、小肠等。AKP的分子量为80KD,最适PH为9.8,其活性受底物及浓度、缓冲液及其离子浓度等因素影响,如用二乙醇胺缓冲液(1mol/L,PH9.8)对AICI’具有活化作用,酶的活性高,而用甘氨酸一NaOH缓冲液则对AKP有抑制作用。AKP的活化剂有镁和锰离子,Mg++的适应浓度为10mol/L。甘氨酸、柠檬酸盐,EDTA等对 AKP有抑制作用。AKP对温度具有较高的敏感性,从 25℃增加到 35℃,其催化反应速度增加 1.5倍。当选用不同的底物时,AKP可催化形成不同颜色的终产物。例如,萘酚一第- 26 -页(共44页) AS一MX和快蓝(Fast blue,Fh)为底物时生成蓝
色产物,可与HRP催化的产物形成鲜明的对比,用快红(Fast red)代替快蓝则生成红色不溶性产物,而且内源性AKP较易清除,可以较好地避免内源性酶的干扰,使其具备了某些独特的优点而日益备受重视。 GOD所催化的底物为葡萄糖,电子供体为对硝基蓝四隆(Paranitroblue Tetrazolium),终产物比较稳定,为不溶性的蓝色沉淀。从理论上讲,GOD较AKP和HRP为佳,因为哺乳动物组织内不存在内源性葡萄糖氧化酶,这样可以很好地避免内源性酶的干扰。但是,GOD的分子较HRP大三倍,具有较多的氨基,在标记时易形成广泛的聚合,而影响酶的活性。 免疫酶法与免疫荧光法大致相同,也可以分为以下几种。 ((((1))))直接法直接法直接法直接法 用酶标记的特异性抗体直接与标本中的相应抗原反应结合,再与酶的底物作用产生有色的产物,沉积在抗原抗体反应的部位,即可对抗原进行定性、定位以至定量研究。 直接法的第一步是特异的——即酶催化底物的反应,其余步骤则是非特异的,可用各种电子供体介导。以HRP为例,HRP的底物是巴H2O2,在分解已过程中,与H2O2形成初级复合物,无电子供体存在时,反应不再继续进行,当电子供体存在时,反应以一定的速度形成第二种复合物,继之HRP催化H2O2所形成的中间型产物,迅速生成水,酶被还原,电子供氢体被氧化,聚合,再经氧化环化,最后形成引哚胺多聚体,于酶反应部位,形成不溶性棕褐色沉淀,与组织对比清晰,达到定位、定性、定量的目的。 直接法简便、快速、特异性强,非特异性背景反应低。其缺点是,每种抗原必须分别用其抗体的酶标记物,且敏感性较间接法低。 ((((2))))间接法间接法间接法间接法 间接法是先用未标记的特异性抗体(一抗)与标本中相应抗原反应,再用抗特异性抗的酶标记抗体与结合在抗原上的一抗(即特异性抗体)反应。例如,第一次使用的特异性抗体(一抗)是由家兔产生的,则第二次使用的抗体(二抗)必须是酶标记的抗兔的免疫球蛋白,常用的羊抗兔lgG的酶标记物(即酶标羊抗兔IgG)。然后与直接法相同,与底物反应、显色、将抗原的性质,部位和含量检测出来。 间接法的优点是用一种酶标抗体就可与多种特异性一抗配合而检查多种抗原,而且敏感性也优于直接法。 ((((3))))酶桥法酶桥法酶桥法酶桥法 酶桥法的建立是免疫酶法重大改进的标志。将用化学交联法将酶与抗体分子结合的技术改进为用酶和酶抗体免疫反应而结合的方法,避免了由于化学反应过程中对酶活性和抗体
效价的不良影响。其基本原理是用酶免疫动物,制备高效价、特异性强的抗酶抗体,然后用第二抗体作桥,将抗酶抗体和特异性的第一抗体(即连结在组织抗原上的抗体)连接起来,再将酶结合在抗酶抗体上,经过酶催化底物的显色反应后,显示出抗原所在的部位及含量。作为桥的第二抗体(即桥抗)必须对特异性抗体(一抗)和酶抗体都具有特异 性,这样才能将二者相连起来,因此,一抗和酶抗体应由同一种属动物产生。例如,特异性抗体和酶抗体都是兔产生的,再用羊抗兔IgG作为桥抗体就能将两者连接起来。在此 过程中,由于任何抗体均未被酶标记,酶是通过免疫学原理与抗酶抗体结合的,避免了共价连接对酶活性的影响,提高了方法的敏感性,同时也节省了特异性抗体(即一抗)的用量。 酶桥法虽然克服酶标记抗体法的缺点,较好地保护了抗体和酶的活性,但是仍存在不足,其主要表现为①在抗酶抗体的抗血清中,含有低亲和力和高亲和力两类抗体,它们作为抗原与抗体结合,主要依赖于桥抗体对它的亲和力,而与其本身对酶的亲和力无关,故两者均可被连接在桥抗体上,由于低亲和力的抗酶抗体与酶结合较弱,漂洗时易解离,使部分酶丢失,从而降低了方法的敏感性。②抗酶抗体血清中,亦含有非特异性抗体,其抗原性与抗酶抗体相同,所以能与桥抗体结合,但却不能与酶结合,这样影响了组织抗原的显示。为解决这些不足,70年代初,Sternberg在各种标记抗体法和酶桥法的基础上,建立了PAP法,并加以改良,成为应用最为广泛的免疫组织化学技术之一。 ((((4))))PAP法法法法 PAP法是酶桥法等基础之上建立的,其基本原理与酶桥法相似,都是利用桥抗体将 酶连接在第一抗体结合的部位,所不同的是,将酶和抗酶抗体制成复合物(PAP)以代替酶桥法中的抗酶抗体和随后结合的酶,将两个步骤合并为一个步骤,这一重要的改进,不仅仅是简化步骤,而具有更大的优势,因第- 27 -页(共44页) 为PAP是由3个过氧化物酶分子和2个抗酶抗体分子结合形成的一个环形分子,排列呈五角形结构,3个角辣根过氧化酶(HRP),另2个角为抗HRP抗体,其分子量为400,000~430,000道尔顿,直径约为20.5nm,这种结构异常稳定,冲洗时酶分子不会脱落,从而大大提高了敏感性,Petrali等报告,PAP法比酶桥法灵敏度高20倍。有人认为是免疫荧光法的100~1000倍。 PAP法应用广泛,其主要优点为: 1) 最大限度地保存了抗体活性。 因为在所有的反应过程中,任何抗体均未被酶标记,避免了标记过程中对抗体活性
的损害。 2) 灵敏度高。 由于是多层抗原抗体反应,由于免疫放大作用,使得结合在抗原抗体复合物上的酶分子增多,并且PAP法复合物性质结构稳定,这样与酶底物反应后的呈色反应增强,使微量的或抗原性弱的抗原显示出来,提高了灵敏度。 3) 背景淡。 酶桥法中,酶标记的非特异性抗体可与组织抗原结合,引起背景染色,给结果判断带来了很大的困难。 PAP法中,连接抗体中即使存在着非特异性抗体,因其不是抗IgG的特异性抗体,故不能与抗HRP抗体相结合,也就不能把PAP复合物连接在非特异性抗体上。当然PAP复合物内也可存在一些非HRP特异性抗体,假如这部分抗体能够与桥抗体及组织成分相结合,但因其不是抗HRP抗体,所以不能与HRP结合,也就无酶活性及背景染色。背景越淡,当然越有利于结果的判断。 PAP法的不足之处是PAP的制备较为复杂。 双PAP法又称双桥法(double bridged technique),是PAP法的重要改进,通过两次连接桥抗体和PAP,在抗原抗体复合物上结合了比PAP法更多的酶分子,可提高敏感性达20~50倍。一般认为,双PAP法通过下述途径来提高敏感性,①重复的桥抗体与PAP中的抗HRP抗体的抗原未饱和位置结合,再连接PAP复合物,即在抗原之处,抗体间形成更大的抗原抗体复合物,具有多个酶分子,使免疫染色增强。②重复的桥抗体,与特异性的第一抗体未饱和抗原相结合,使第一抗体上结合较多的桥抗体和PAP复合物,起到放大作用。双PAP法的不足之处是步骤多,需时长,在实际操作中,可能会带来非特异性放大的问题而影响结果的判断。 ((((5))))APAAP法法法法 APAAP——碱性磷酸酶抗碱性磷酸酶(Alkaline phosphatase antialkaline phosphatase, APAAP)法是Mason和Moir(1983)等在PAP法的基础上,用AKP替代HRP而建立的一种方法,都属于未标记抗体桥联法。APAAP法与PAP一样,利用桥抗体将AKP连接在第一抗体的结合部位,而AKP和抗AKP抗体被制成复合物(APAAP),通过APAAP复合物中的AKP催化底物显色以显示抗原物质。 APAAP法的主要优点: 1) 在内源性的过氧化物酶较高的组织中进行免疫组织化学染色时,APAAP法较 PAP法具有更多的优势,仅需稍加处理就能消除内源性酶的干扰,而PAP法则困难较大。 2) 敏感性与PAP法大致相似。 3) 在血、骨髓、脱落细胞涂片的免疫细胞化学染色上具有PAP法不能替代的优势。 4) 反应稳定,着色清楚,背景淡。 ? 免疫组化技术之免疫金银法免疫组化技术之免疫金银法免疫组化技术之免疫金银法免疫组化技术之免疫金银法 免疫金银法(Immurogold-sli
ver method,IGSM)或称免疫金银染色(Immurogold-sliver staining,IGSS)是一种新的免疫组织化学技术,近年来又不断改进,已成为最为灵敏而又经济的方法之一。免疫金银法实际上是在免疫金法的基础之上发展形成。 免疫金和免疫金银法都是利用胶体金作为标记物。胶体金系指金的水溶胶,溶胶是一种物质以大或小的微小粒子分散在另一种物质中所形成的体系,被分散的物质叫分散相,容纳分散相的物质叫分散介质。按分散相离子的大小可将分散体系分为三种,相分散分散体系(分散相粒子直径大于10nm);胶第- 28 -页(共44页) 体分散体系(分散相粒子直径在1~100 nm之间);低分子一离子分散体系(分散相粒子直径〈1 nm〉。胶体金属于胶体分散体系,是指金以微小的粒子分散在水中所形成的金溶胶。它能迅速而稳定地吸附蛋白,对蛋白的生物学活性则没有明显的影响。因此,用胶体金标记一抗、二抗或其他能特异性结合免疫球蛋白的分子(如葡萄球菌A蛋白)等作为探针,就能对组织或细胞内的抗原进行定性、定位,甚至定量研究。由于胶体金有不同大小的颗粒,且胶体金的电子密度高,所以免疫胶体金技术特别适合于免疫电镜的单标记或多标记定位研究。由于胶体金本身呈淡至深红色,因此也适合进行光镜观察。如应用银加强的免疫金银法则更便于光镜观察。溶胶的颜色取决于分散相物质的颜色,对同一种物质的溶胶而言,粒子大小不同,颜色也不同。若粒子为20-40nm的金溶胶因主要吸收波长为530nm的绿光而呈深红色,60nm的金溶胶因主要吸收波长为600nm的橙黄色光而呈紫蓝色。在光镜水平应用的胶体金粒直径不能小于10nm,否则无可见的红色。 1.免疫金法 免疫金法是将用胶体金(直径>20 nm)标记的间接抗体或A蛋白再与特异性抗体结合,在光镜下就可见红色的反应物出现,不需进行呈色反应。但该法要求金标抗体浓度高,因此,价格昂贵,既不经济同时也不够敏感。 2.免疫金银染色(IGSS) 免疫金银染色是在免疫金染色的基础上,在对苯二酚存在的情况下,通过含银离子的显影液中的还原反应,使在抗原抗体反应部位的金粒子周围形成很多沉淀层,光镜下就可看到阳性反应部位呈清晰的棕黑色,从而显示不易被光镜定位的金粒,显示出组织中抗原的部位。这种方法不仅提高灵敏度,同时金标记抗体可以稀释10倍以上后应用,此外还可避免使用具有致癌危险的有机色素。 IGSS法的主要优点是: (1)敏感性高。与其他的免疫组织化学技术相比,IGSS法被认为是最敏感的方法,尤其适合于只含微量抗原的
组织标本。 (2)应用范围广。IGSS法不仅可以在冰冻切片,细胞涂片以及培养细胞、石蜡切片上进行光镜观察,而且还能应用于树脂包埋的切片的电镜观察,并且能准确定位抗原。 (3)定位准确。IGSS法的银颗粒沉积在搞原体反应部位,一般无扩散,定位较为准确。 (4)方法简便、安全、成本低、经济、同时标本也可以长期保存。 (5)用醋酸银代替硝酸银和乳酸银,不仅保持了原有方法的敏感性、特异性、低背景、对比度好的特点,而且整个显影过程可以在常光下进行,从而弥补了在暗室显色的不足。 IGSS法的主要问题是非特异性背景,由于其非特异性背影染色影响了IGSS法在常规免疫组织化学鉴别诊断上的应用。但若能较好地控制染色的各关键环节,如特异性抗体的纯度,特异性;切片的消化以及显影液的配制和显影时间的控制等,能较好地解决这一问题。 ? 免疫组化操作要点及技巧免疫组化操作要点及技巧免疫组化操作要点及技巧免疫组化操作要点及技巧 (1)固定:最好用4%的多聚甲醛固定液。对于冰冻切片,甲醛固定有时比冰冻丙酮好;但对于不同的组织和抗原,可选用不同的固定液。 有时候商品化的抗体会有比较适合而推荐的固定液,请于购置前注意说明书。 Bouin S固定液:饱和苦味酸750ml,甲醛250ml,冰醋酸50ml,其对组织的穿透力较强,固定较好,结构完整,但因偏酸,对抗原有一定损害,且组织收缩明显,不适于组织标本的长期保存。 PLP液:即高碘酸钠-赖氨酸-多聚甲醛,适于固定石蜡切片。适于富含糖类组织,对超微结构及许多抗原的抗原性保存较好。 (2)组织脱水,透明:时间不能太长,否则在切片时容易碎片,切不完整。 (3)切片时展片:有些组织在切片后难以在水中展开,这时可适当地在水中加入几滴乙醇。 第- 29 -页(共44页) (4)烤片:60℃ 30分钟或37℃ 过夜,温度太高或时间太长,抗原容易丢失。 (5)蜡块及切片的保存:最好在4℃保存 (6)脱片问题: Poly-L-Lysine(多聚赖氨酸)为目前免疫组化染色工作中最常用的一种防脱片剂,6ml的多聚赖氨酸溶液可按1:10稀释成60ml的工作液,适合于需要酶消化、微波、高温高压的防脱片处理。如不行,可用双重处理(APES和Poly-L-Lysine)的切片。在以上两种条件都行不通的情况下,可用如下方法:切片在脱蜡前,放在APES 1:50 丙酮溶液中浸泡3分钟,晾干,即可进行下一步。 (7)灭活内源性酶:HRP系统:3%双氧水灭活;AP系统:3%HAc灭活。 (8)暴露抗原:对于石
蜡切片的免疫组化实验时,必须采用高温加热抗原修复,这将有助于暴露抗原决定簇,从而增加免疫组化染色的强度(不同抗体的最佳修复液请参阅抗体说明书)。对于不同的组织,不同的抗原,不同的抗体,所采用的方法应不一样,可进行热修复、胰酶消化、既不修复也不消化。胶原还可以用胃蛋白酶消化等。 (9)封闭:在山羊血清封闭,非特异性染色仍然较强时,可延长封闭时间或用浓缩血清封闭 (10)抗体稀释:应遵循“现用现配”的原则,对于PBS稀释的抗体一定要当天使用。 (11)背景高:在抗体浓度、反应时间、反应温度等合适的条件下,如果背景依旧高,可采用含1‰ Tween20的PBS洗,特别是在显色之前要多洗。 (12)返蓝:在苏木素复染后,可用碱性缓冲液(如PBS)或Na2HPO4的饱和溶液返蓝。 (13)显色:一定要在显微镜下观察,注意控制背景。 (14)在整个操作过程中,切片千万不能干燥,否则会有非特异性染色。 (15)拍照 1)更换样品时,除了调整焦距和视野外,显微镜上的其他部件都不能动!所有的样品必须一次拍摄完全。特别是在拍摄过程中,不要一会用高倍镜,一会用低倍镜,来回切换物镜。 2)数码相机必须设置为手动曝光,并且保持每张照片用同样的曝光条件,同样的曝光时间,同样的光圈。特别要注意的是,一定要将数码相机的自动白平衡功能给关掉 3)免疫组化切片一般染色不太深,因此拍摄出的照片颜色较浅,就让它浅。拍摄出的照片中空白部位应尽可能呈现纯白色。测量其灰度应在250左右。如果呈现淡蓝色,一般是相机自动白平衡在起作用。另外一个因素是显微镜灯光电压不正确。要使灯光本身的色温正确。既不偏黄,也不偏蓝。 ? 免疫组化技术的关键问题免疫组化技术的关键问题免疫组化技术的关键问题免疫组化技术的关键问题 第- 30 -页(共44页) 1.组织处理组织处理组织处理组织处理 恰当的组织处理是做好免疫组化染色的先决条件,也是决定染色成败的内部因素,在组织细胞材料准备的过程中,不仅要求保持组织细胞形态完整,更要保持组织细胞的抗原性不受损或弥漫,防止组织自溶。如果出现自溶坏死的组织,抗原已经丢失,即使用很灵敏的检测抗体和高超的技术,也很难检出所需的抗原,反而往往由于组织的坏死或制片时的刀痕挤压,在上述区域易出现假阳性结果。 1) 组织及时取材和固定 组织标本及时的取材和固定是做好免疫组化染色的关键第一步,是有效防止组织自溶坏死,抗原丢失的开始,离体组
织应尽快的进行取材,最好2h内,取材时所用的刀应锐利,要一刀下去切开组织,不可反复切拉组织,造成组织的挤压,组织块大小要适中,一般在2.5cm×2.5cm×0.2cm,切记取材时组织块宁可面积大,千万不能厚的原则,(也就是说组织块的面积可以大到3cm×5cm,但组织块的厚度千万不能超过0.2cm,否则将不利于组织的均匀固定)。固定液快速渗透到组织内部使组织蛋白能在一定时间内迅速凝固。从而完好的保存抗原和组织细胞形态。 对于固定液的选择,原则上讲,应根据抗原的耐受性来选择相应的固定液,但除非是专项科研项目,在病理常规工作很难做到这一点,因为病理的诊断和鉴别诊断都是在常规HE病理诊断的基础上决定是否进行免疫组化的染色,而HE染色的常规组织处理是采用10%的中性缓冲福尔马林或4%缓冲多聚甲醛4倍于组织体积进行组织固定,利用其渗透性强,对组织的作用均匀进行固定,但组织固定时间最好在l2h内,一般固定时间不应超过24小时。随着固定时间的延长对组织抗原的检出强度将逐渐降低。 2) 组织脱水、透明、浸蜡 组织经固定后进行脱水、透明、浸蜡和包埋。掌握的原则是脱水透明要充分但不能过,浸蜡时间要够,温度不能高,否则造成组织的硬脆使组织切片困难,即使能切片,由于组织的硬脆,也使切片不能完好平整,染色过程中极易脱片,对免疫组化染色抗原的定位及背景都不利,所以无水酒精脱水和二甲苯透明的时间不宜过长,正常大小的组织无水酒精脱水lh×3次,二甲苯透明lh×2次即可,浸蜡及包埋石蜡温度不要超过65℃。 2.切片切片切片切片 组织得到很好处理后在进行切片之前还应对玻璃片进行处理,由于我们检测抗原是多种多样的,因染色操作程序复杂,时间较长,有些抗原是要进行各种抗原修复处理,如微波、高压、水溶酶等,玻片如果得不到很好的处理,将易造成脱片,为保证免疫组化实验的正常进行,要求在贴片前对载玻片作适当处理,必须在清洗干净的玻片上进行粘合剂的处理以防脱片。 1)Poly-L-Lysine (多聚左旋赖氨酸) 一般采用分子量30000左右的0.5%多聚赖氨酸最好,也可用试剂公司出售的其浓溶液以1:10去离子水稀释。方法是将玻片浸泡其中,倾尽余液,在60℃温箱中烤干备用,此方法的优点是可以用于多种组织化学、免疫组化及分子学检测中的应用,粘贴效果最好,但价格稍贵。 2)明胶硫酸铬钾法 将2.5g明胶加热溶于500ml蒸馏水中,完全溶解冷却后加入0.25g硫酸铬钾搅匀充分溶解即可使用。方法是将玻片浸泡其中2 min,取出控尽液体入温箱中
烤干备用。此法价格便宜、方法简单,任何实验都可以使用,特别适用于大批量的使用,但应注意,如果液体变蓝或粘稠状停用。 3)APES (3-氨丙基-乙氧基甲硅烷) 此法必须现用现配。将洗净玻片入1:50丙酮稀释的APES中,浸泡20s,取出稍停再入丙酮或蒸馏水中刷去末结合的APES晾干即可。用此方法粘合的玻片应垂直烤片不能平拷,否则组织片中易出现气泡。 切片必须保持切片刀锐利,切片要薄而平整、无皱摺、无刀痕,如有上述问题的切片在进行免疫组化染色都将出现假阳性现象,切片厚度一般为3~4?m,切好的切片在60℃温箱中过夜,注意烤片的温度不宜过高,否则易使组织细胞结构破坏,而产生抗原标记定位弥漫现象。 3.免疫组化染色免疫组化染色免疫组化染色免疫组化染色 S—P免疫组化染色试剂盒采用生物素标记的第二抗体与链霉菌抗生物素蛋白连接的过氧化物酶及底物色素混合液来测定细胞和组织中的抗原。 S—P免疫组化染色步骤: 第- 31 -页(共44页) 1) 石蜡切片脱蜡和水化后,用PBS(pH7.4)冲洗三次,每次3分钟(3×3’)。 2) 根据每一种抗体的要求,对组织抗原进行相应的修复。 3) 每张切片加1滴或50ul过氧化酶阻断溶液(试剂A),以阻断内源性过氧化物酶的活性,室温下孵育10分钟。 4) PBS冲洗3×3’。 5) 甩去PBS液,每张切片加1滴或50ul的非免疫性动物血清(试剂B),室温下孵育10分钟。 6) 甩去血清,每张切片加1滴或50ul的第一抗体(用户自选),室温下孵育60分钟或4℃过夜,建议参阅每种抗体的说明书。 7) PBS冲洗3×5’。 8) 甩去PBS液,每张切片加1滴或50ul生物素标记的第二抗体(试剂C),室温下孵育10分钟。 9) PBS冲洗3×3’。 10)甩去PBS液,每张切片加1滴或50ul链霉菌抗生物素-过氧化物酶溶液(试剂D),室温下孵育10分钟。 11)PBS冲洗3×3’。 12)甩去PBS液,每张切片加2滴或100ul新鲜配制的DAB或AEC溶液,显微镜下观察3—10分钟,阳性显色为棕色或红色。 13)自来水冲洗,苏木素复染,0.1%HCL分化,0.1%氨水或PBS冲洗返蓝。 14)如果用DAB显色,则切片经过梯度酒精脱水干燥,(二甲苯透明),中性树胶封固;如果用AEC显色,则切片不能经酒精脱水,而直接用水性封片剂封片。 ? 免疫组化染色注意事项免疫组化染色注意事项免疫组化染色注意事项免疫组化染色注意事项 免疫组化染色方法已不是什么很难的问题,操作步骤简单也易掌握,但要染好免疫组化,其中方法的技巧将是每位操作者在实际工作中不断摸索和探讨的事,但最基本的应从以下方面加以注意
: ((((1)))) 去除内源酶及内源性生物素去除内源酶及内源性生物素去除内源酶及内源性生物素去除内源酶及内源性生物素 一般我们进行免疫组化标记的都是一些生物体组织,其中自身含有一定量的内源酶和内源性生物素,而免疫组化各种染色大部分是用过氧化物酶来标记抗体的,酶的作用是催化底物,使显色剂显色,而组织中的内源性酶同样也能催化底物,使其显色,这就影响免疫组化的特异性,所以在标记抗体的过氧化酶进人组织切片之前就应设法将组织内的内源性各种酶灭活,以保证免疫组化染色在特异性情况下进行。 1) 去除内源酶 常用的去除内源性酶的方法是3%过氧化氢水溶液。但在含有丰富血细胞的标本中,由于其中含有大量的具有活性的过氧化物酶,能与过氧化氢反应,出现气泡现象,易对组织结构和细胞形态产生一些不良影响,但用3%过氧化氢的方法,能够去除大部分内源性酶,即使有些血细胞在显色后也出现棕黄色反应,但由于其形态结构与组织细胞不同,也易鉴别,而且此方法比较通用易操作,但应注意过氧化氢的浓度不能过高,一般为3%一5%,时间不宜过长,最好室温10min。 2) 去除内源性生物素 在正常组织细胞中也含有生物素,特别是肝、脾、肾、脑,皮肤等组织中,在应用亲和素试剂的染色中,内源性生物素易结合卵白素,形成卵白素一生物素复合物,导致假阳性,所以在采用生物素方法染色前也可以将组织切片进行0.01%卵白素溶液室温处理20min,使其结合位点饱和,以消除内源性生物素的活性。 3) 灭活碱性磷酸酶 最常用的方法是将左旋咪挫(以每毫升加24mg)加入底物液中并保持pH值为7.6~8.2,能除去大部分内源性碱性磷酸酶,对于仍能干扰染色的酸性磷酸酶可用0.05mo1/L酒石酸抑制。 ((((2)))) 抑制非特异性背景着色抑制非特异性背景着色抑制非特异性背景着色抑制非特异性背景着色 非特异性着色最常见的情况是抗体吸附到组织切片中高度荷电的胶原和结缔组织成分上,而出现第- 32 -页(共44页) 背景着色,为了防止这种现象,最好用特异性抗体来源的同种动物灭活的非免疫血清在特异性抗体之前进行处理,以封闭荷电点,不让一抗与之结合,但这种方法一般实验室很难实现,一般常见实用的血清是2%~10%羊血清或2%牛血清白蛋白在室温下作用10~30min即可,但应注意此种结合是不牢固结合,所以最好不要冲洗,倾去余液直接加一抗,对于多克隆抗体来讲,易产生背景着色,在稀释特异性抗体时可采用含1%非免疫血清的pH
7.4的PBS液。 ((((3)))) 缓冲液缓冲液缓冲液缓冲液 免疫组化染色标记是对生物体组织抗原进行标记,抗原抗体最适合的pH值为7.2~7.6,最常用的是0.0l mol / LpH7.4磷酸缓冲液(PBS)。简易配法:5000ml蒸馏水中分别加入l g NaH2PO4、15.6gNa2HPO4 、42.5gNaCl。但如果是采用碱性磷酸酶(AP)作为标记物底物的方法时可以用0.02mol/L TBS pH8.2缓冲液比较好。 ((((4)))) 抗原修复抗原修复抗原修复抗原修复 经甲醛固定的部分组织细胞,可使免疫组化标记敏感性明显降低,这是因为甲醛固定过程中形成醛键或保存的甲醛会形成羧甲基而封闭部分抗原决定簇。因此,在染色时,有些抗原需先进行修复或暴露。 抗原修复方法可分为化学方法和物理方法。化学方法是以酶消化方法,常用胰蛋白酶及胃蛋白酶,配制浓度与消化时间要适度。常用的物理方法有单纯加热、微波处理和高压加热。在选用这三种加热法时,浸泡切片的缓冲液的离子强度和PH值、加热的温度和时间均影响着抗原修复效果。目前最常用的修复方法有如下凡种: 1)胰蛋白酶(Trpsin) 主要用于细胞内抗原的修复。一般使用浓度为0.1%,37℃作用10min。 配法:0.1g胰蛋白酶加入到0.1%pH7.8CaCl2(无水)水溶液中溶解后即可。 2)胃蛋白酶(Pepsin) 主要用于细胞间质或基底膜抗原的修复。一般浓度为0.4%,37℃作用30min。 配法:0.4g胃蛋白酶溶于0.lmol/L HCl水溶液中。 3)热引导的抗原决定簇修复(Heat Induced Epitope Retrieval,HIER) HIER对大多数的抗体有益,尤其是对核抗原的修复作用更加明显,最常用的抗原修复液是pH6.0的枸橼酸缓冲液和pH8.0的EDTA缓冲液,它们的作用原理是通过钠离子的螯合而实现的。抗原修复液的pH值非常重要,有效的抗原修复pH值要比修复液的化学成分更重要,同样的修复液随着pH值的升高染色的强度逐渐增强,但最佳pH值范围为6.0~10.0,对于大多数抗原这个范围的pH值都能进行有效的修复,有些抗体(如Ki-67、ER)则在pH值l.0~3.0和6.0~8.0更为有效。作为通用修复液碱性pH值的修复液要比酸性的有效,而对固定很长时间旧的存档组织,酸性pH值的修复液则优于碱性的修复液,所以两种抗原修复液可作为相互替补的进行抗原修复。在进行HIER过程中应防止切片的干燥,加热时必须达到规定的温度,保温时间要足够,对于一些不要抗原修复的抗体最好不要采用HIER处理,否则对染色无益,但有些抗体则需要利用多种修复联合应用。 HIER方法有:1)水浴加热法 将脱蜡人水后的切片放人盛有修复的容器中,放人
加热煮沸水中,当修复液温度达到95℃左右时计时l5min,自然冷却,PBS洗3min×3次。 2)微波加热法 将切片放入修复液中微波加热使温度在96℃左右,计时l0min,在微波炉中停留2min,室温自然冷却,PBS洗3min×3次。 3)高压加热法 将修复液在高压锅中煮沸,切片插在染色架上,放入锅中(要使修复液淹没切片)开始喷气时盖上压力阀。计时2min,冷水冲至室温取出切片,PBS洗3min×3次。 ((((5)))) 显色显色显色显色 免疫组化染色的显色是最后的关键问题,一般辣根过氧化物酶(HRP)的检测系统选用DAB或AEC显色系统进行显色。但要得到最佳的显色效果,必须在镜下严格控制,以检出物达到最强显色而背景无色为最终点,尤其DAB显色时间短着色浅,时间长背景又深,都将影响结果判断,根据经验DAB在配第- 33 -页(共44页) 制完后最长宜放置30min以内,过时不能使用,DAB加到组织切片时作用时间最长不宜超过10min(最好在5min内),否则不管有无阳性都应终止反应。对一些含有内源性酶较高的组织用DAB显色时极易出现背景色更应尽早在镜下控制,以达到最佳的分辨效果(棕色)。AEC显色系统(红色)的弊端是易溶于有机溶剂,所以封片时应以水性封片剂为主,同时染色的切片也不能久存。 如果是碱性磷酸酶(AP)最好选用NBT/BCIP作为显色系统(结果染为蓝黑色)。 ((((6)))) 结果判断结果判断结果判断结果判断 免疫组化的结果判断有两种方法: 一是对以检测结果阳性细胞指数来定性(如核抗原的标记),判断方法是以一个视野中的阳性细胞数与总细胞的百分比,再取10个相同视野算取平均指数。 另一种方法以染色阳性强度和阳性检出率相结合而定,一般阳性细胞数在0~25为阴性,25~50为十,50~75为十十,75以上为十十十。此种判定方法容易出现人为误差现象。 有条件的实验室最好能用图像分析系统进行结果检测定量分析更为准确。一切的判定方法都是力求使免疫组化染色结果判断更标准,但各单位采取的标准不尽相同,所以判断标准化问题还有待长期实践中病理学术界商讨判定标准。 IHC中常见的抗原表达模式有以下几种: 1)细胞浆内弥漫性分布,多数胞浆型抗体的反应如此,如细胞角蛋白(cytokeratin,CK)和波形蛋白(vimentin)等; 2)细胞核周的胞浆内分布,其判别要点是细胞核的轮廓被勾画得很清楚,如CD3多克隆抗体的染色; 3)胞浆内局限性点状阳性,如CDl5抗体的染色; 4)细胞膜线性阳性,大多数淋巴细胞标记的染色如此,如CD
20、CD45RO; 5)细胞核阳性,如Ki-67及雌、孕激素受体蛋白ER、PR等。一种抗体可同时出现细胞浆和细胞膜的阳性表达,如EMA可呈膜性和胞浆内弥漫性阳性反应;CD30抗体可同时呈膜性和胞浆内点状阳性反应等。 ((((7)))) 对照片的设置对照片的设置对照片的设置对照片的设置 免疫组化的质量取决于正确使用各种对照,没有对照的免疫组化结果是毫无意义的。对照包括阴性对照、阳性对照和自身对照。在实践中可用染色组织切片中不含抗原的组织作为阴性对照,而用含抗原的正常组织作阳性对照,这种自我对照具有节约的意义。观察染色结果时,先观察对照组织的结果,如阳性对照组织中阳性细胞呈强阳性,阴性对照细胞呈阴性,内源酶阴性,背景无非特异性染色时,表明本次实验的全部试剂和全过程技术操作准确无误,待检组织中的阳性细胞也就是可信的正确结果。 免疫组化染色中对照片的设置非常重要,它是判断您的染色是否成功的关键依据,而且也是检测每一个抗体的质量标准,常设的对照如下,一般实验最常用的只选第二种方法。 1)空白对照(阴性对照) 第一抗体由PBS或非免疫血清取代。 2)阳性对照 用已知含有要检测抗原的切片作阳性对照。 3)回收实验阴性对照 已知抗原与相应的第一抗体混合,发生结合沉淀,再用此沉淀抗体复合物进行免疫组化实验,结果为阴性。 4)替代对照 用于第一抗体同种动物的血清或无关抗体代替第一抗体结果为阴性。 5)自身对照 在同一切片上,应将不同组织成分中的阳性或阴性结果与检测的目的物对照比较。如actin、CD34在正常组织中的血管壁肌层应为阳性,vimentin可以间质细胞,对照desmin以血管壁及肌束为对照,S-l00蛋白以小神经末梢为对照等,如果应为阳性的组织是阳性,则免疫组化技术正确,如为阴性,则表明染色技术有问题或免疫试剂质量有问题。 第- 34 -页(共44页) 免疫组织化学工作流程免疫组织化学工作流程免疫组织化学工作流程免疫组织化学工作流程 1 石蜡切片脱蜡和水化后,用PBS(PH7.4)冲洗三次,每次5分钟。 PBS配制 (2000ml)PH7.4 氯化钠: 17g 磷酸二氢钠:0.4g 磷酸氢二钠:6.3g 2 根据每一种抗体的要求,对组织抗原进行相应的修复。我科采用压力锅进行抗原修复,取一定量的修复液于压力锅中,加热至沸腾,将脱蜡水化后的组织切片置于不锈钢或耐高温塑料切片架上,放入已沸腾的缓冲液中,盖上锅盖,扣上压力阀,继续加热至喷气,从喷气开始计时,2分钟后,压力锅离开热源,冷却至室温(也可以
稍冷后,在自来水龙头下加速冷却)。取出玻片,先用蒸馏水冲洗两遍(用蜡在组织周围划圈,防止抗体跑散,但圈要大一点),之后用PBS(PH7.4)冲洗三遍。每次5分钟。 柠檬酸缓冲液的配制(PH6.0) 0.1M柠檬酸:(4.2g+200ml蒸馏水) 0.1M柠檬酸三钠 (14.7g+500ml蒸馏水) 取柠檬酸三钠41ml+柠檬酸9ml加入450ml蒸馏水中,总量为500ml即可。 3 配制3%过氧化氢阻断内源性过氧化物酶,孵育十分钟。 PBS90 ml+30 %过氧化氢10 ml,现用现配并摇匀,盖上盖子,防止见氧分解挥发。 4 PBS冲洗三次,每次5分钟。 5 滴加4 %羊血清封闭,室温30分钟,以减少非特异性染色。 PBS10 ml+正常羊血清400 ul 6 甩去羊血清,根据不同的项目配制并滴加不同的一抗,浓缩型的抗体一定要在购买后先用已知的阳性片做梯度实验,根据结果情况找出最佳稀释浓度再用到临床诊断。工作液也应该在购买后先用已知的阳性片检测抗体的染色效果,直接滴加即可。每次还应带上阳性对照和阴性对照,以保证结果的可靠性。每张切片滴加足够量的一抗并放入湿盒,防止切片干燥影响结果,室温孵育2小时。 抗体稀释液的配制 牛血清白蛋白:2mg 叠氮钠: 10~20ml 双蒸水: 10ml 7 PBS冲洗三次,每次5分钟。 8 滴加二步法EnVision TM孵育30分钟。 9 PBS冲洗三次,每次5分钟。 10 甩去PBS液,每张切片滴加新鲜配制的DAB显色液,显微镜下观察,阳性信号为棕黄色或棕褐色。一般显色时间为5分钟左右,终止反应,自来水充分冲洗。 11 苏木素复染,0.1%盐酸酒精分化,氨水返兰或自来水返兰(自来水返兰时间要稍长些,应该在显微镜下看以下苏木素复染情况),自来水冲洗。 12 梯度酒精脱水,二甲苯透明,中性树胶封片,阅片并总结染色结果。 ? 免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂----封固剂封固剂封固剂封固剂 1.甘油-TBS及甘油-PBS 配制方法:按比例将甘油和TBS(或PBS)充分混合后,置4℃,冰箱静止;待气泡排除后方可使用。 2.甘油-明胶(冻) 第- 35 -页(共44页) 试剂:明胶 10g 甘油 12ml 蒸馏水 100ml 香草酚 少许 配制方法:称取1g明胶于温热(约40℃)的蒸馏水中,充分溶解后过滤,再加入12ml甘油混合均匀。少许香草酚是为了防腐。 3.液体石蜡 液体石蜡因含杂质少,很少引起非特异性荧光,故常用于荧光组化及免疫荧光法时标本的封固。 4.DPX 试剂:Distrene 10g 酸二丁 5ml 二甲苯 35ml DPX为中性封固剂,用于多种染色方法匀不易褪色,但组织收缩较明显,故应尽量使
其为均匀的一薄层。DPX现有商品出售,可直接应用。若感过于粘稠,也可加少量二甲苯稀释后应用。注意:二甲苯不可加得太多,二甲苯挥发后,片子上出现许多干燥的空泡,影响观察,遇有这种情况,可用二甲苯浸泡掉盖玻后重新封固。 ? 免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂----酶消化液酶消化液酶消化液酶消化液 1.0.1%胰蛋白酶 试剂:胰蛋白酶 0.1gm 0.1%氯化钙(pH7.8) 100ml 配制方法:先配制0.1%的CaCl2,用0.1mol/L的NaOH将其pH调至7.8,然后加入蛋白酶溶解之。用前将胰蛋白酶消化液在水浴中予热至37℃(载有标本的玻片也在TBS中予热至同样样温度)。该消化液时间约为5~30min。 2.0.4%胃蛋白酶 试剂:胃蛋白酶 400mg 0.1N HCl 100ml 配制方法:同胰蛋白酶。消化时间在37℃约为30min。 3.0.06% Pronase 第- 36 -页(共44页) 试剂:Pronase 0.06g 0.05mol/L TB(pH7.5) 100ml 配制方法:同前。 在免疫细胞化学染色中,有时经Formalin过度固定的标本,常会产生过量的醛基,遮盖抗原,影响一抗与抗原的结合。用蛋白酶溶液消化,可起到暴露抗原部分的作用。消化时间应根据不同组织而异,总之,在保持组织形态不被破坏的前提下,宜尽量延长消化时间。以上三种酶消化液中,以第一种最为常用。 免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂免疫细胞化学常用试剂-其它其它其它其它 1.蔗糖溶液 免疫细胞化学中应用的蔗精,常用浓度为5%~30%。一般光镜研究,仅用20%蔗糖处理已足矣,若制备电镜标本,在冰冻前最好经上行蔗糖(5%、10%、15%、20%及20%蔗糖-5%甘油等)处理,以确保其良好的细微结构。 (1)20%蔗糖液: 试剂:蔗糖 20g 0.1mol/L PB(pH7.5) 至100ml 配制方法:先以少许0.1mol/L的PB溶解蔗糖,再加0.1mol/l PB至100ml充分混合,置4℃冰箱保存。 该液多用于纯光镜研究。标本在刚放入浓度如此高的蔗糖液,常浮在上面,当标本沉到底部时即可。通常光镜标本浸泡在20%蔗糖液中过夜。都能达到要求。 (2)20%蔗糖-5%甘油: 试剂:蔗糖 20g 甘油 5ml 0.1mol/L PB 至100ml(约95ml) 配制方法:先用少许PB溶解蔗糖后,再加入甘油,充分混匀,最后补足PB至100ml,于4℃保存备用。 该液主要用于电镜标本的处理,常浸泡过夜(其它浓度的蔗糖中常分别为2h左右)。 蔗糖是一种廉价的防冻剂,兼有脱水的作用,它可减小标本在冰冻切片时冰晶形成的数量和大小,应用较为方便。若无试剂蔗糖(Sucrose)也可用普通蔗糖(Cane Suga
r)。配制好的蔗糖溶液,放置时间超过一个月时,应重新配制。 2.T riton X-100(聚乙二醇辛基苯基醚) 免疫细胞化学中,Triton X-100常用浓度为1%和0.3%,但通常是先配制成30%的Triton X-100储备液,临用时稀释至所需浓度。 30% Triton X-100的配制: 第- 37 -页(共44页) 试剂:Triton X-100 28.2ml 0.1mol/L PBS(pH7.3)或0.05mol/l TBS(pH7.4) 72.8ml 配制方法:取Triton X-100及PBS(或TBS)混合,置37℃~40℃水浴中2~3h,使其充分溶解混匀。用前取该储备液稀释至所需浓度。 Triton X-100是一种非离子型表面活性剂(或称清洁剂),分子量为646.86(C34H62O11)。它能溶解脂质,以增加抗体对细胞膜的通透性。1%的Triton X-100常用于漂洗组织标本,0.3%的Triton X-100则常用于稀释血清,配制BSA等。 3.甲醇-H2O2液 试剂:纯甲醇 10ml 30% H2O2 0.1ml 配制方法:吸取30%的H2O20.1ml,加入100ml纯甲醇中,充分混匀即可,使H2O2终浓度为0.3%(也有的用0.03%、0.5%等)。 甲醇-H2O2处理组织标本,具有封闭内源性过氧化物酶活性的作用,但其具体机制至今仍不详。通常处理时间在室温约为5~30min。注意,用H2O2处理标本,对某些抗原的抗原性有影响,故建议在使用新的抗血清或抗原时,最好同时设立非处理对照组。 4.常用生理盐液 常用生理盐液的成分(g/1000ml) Kerbs Kerbs-Hen-selsit Locke Tyrode Ringer NaCl 5.54 6.92 9.00 8.00 6.50 KCl 0.36 0.35 0.42 0.20 0.14 MgCl2 - - - 0.10 - MgSO4·7H2O 0.29 0.29 - - - CaCl2 0.28 0.28 0.24 0.20 0.12 NaH2PO4 - - - 0.05 0.01 KH2PO4 0.16 0.16 - - - NaHCO3 2.10 2.10 0.15 1.00 0.20 Glucose 2.10 - 1.00 1.00 2.00 Pyruvic acid 0.43 - - - - Fumaric acid 0.62 - - - - Glutamic acid 0.72 - - - - 配制方法:精确称取各种药品(如上表),加入500ml重蒸水中,待完全溶解后,补足重蒸水至1000ml,充分混匀即可。 第- 38 -页(共44页) 在免疫细胞化学实验中,某些物质不宜经固定剂作用或经固定剂作用后仍易丢失,而需浸泡在生理盐液中。这些生理盐液的成分与正常哺乳动物血清的成分相似,能使组织离体后能处于尽量接近生理状态时的环境。Glucose通常是在用前临时加入。有的(如Kerbs液)在使用时通常需通入含CO2/O2为2.5~5%/97.5~95%的气体。这些生理盐液中的CO2和二碳酸盐,主要起缓冲作用,Glucose主要是提供离体组织有限的代谢所需的能量。 ELISA试验中所用物品及试剂详解试验中所用物品及试剂详解试验中所用物品及试剂详解试验中所用物品及试剂详解 在临床检验中一般采用商品试剂盒进行测定。ELISA中有三个必要的试剂:免疫吸附剂、结合物和酶的底物等。完整的ELISA试剂盒包含以下各组分: (1)已包被抗原或抗体的固
相载体(免疫吸附剂); (2)酶标记的抗原或抗体(结合物); (3)酶的底物; (4)阴性对照品和阳性对照品(定性测定中),参考标准品和控制血清(定量测定中); (5)酶联物(结合物)及标本的稀释液; (6)洗涤液; (7)酶反应终止液。 3.1 免疫吸附剂免疫吸附剂免疫吸附剂免疫吸附剂 已包被抗原或抗体的固相载体在低温(2~8℃)干燥的条件下一般可保存6个月以上。有些不完整的试盒,仅供应包被用抗原或抗体,检测人员需自行包被。以下简述固相载体和包被过程。 3.1.1 固相载体 固相载体在ELISA测定过程中作为吸附剂和容器,不参与化学反应。可作ELISA中载体的材料很多,最常用的是聚苯乙烯。聚苯乙烯具有较强的吸附蛋白质的性能,抗体或蛋白质抗原吸附其上后仍保留原来的免疫学活性,加之它的价格低廉,所以被普遍采用。聚苯乙烯为塑料,可制成各种形式。 ELISA载体的形状主要有三种:微量滴定板、小珠和小试管。以微量滴定板最为常用,专用于EILSA的产品称为ELISA板,国际上标准的微量滴定板为8×12的96孔式。为便于作少量标本的检测,有制成8联孔条或12联孔条的,放入座架后,大小与标准ELISA板相同。ELISA板的特点是可以同时进行大量标本的检测,并可在特制的比色计上迅速读出结果。现在已有多种自动化仪器用于微量滴定板型的ELISA检测,包括加样、洗涤、保温、比色等步骤,对操作的标准化极为有利。聚苯乙烯经射线照射后,其吸附性能特别是对免疫球蛋白的吸附性能增加,应用于双抗体夹心法可使固相上抗体量增多,但用于间接法测抗体时空白值较大。 良好的ELISA板应该是吸附性能好,空白值低,孔底透明度高,各板之间、同一板各孔之间、同一板各孔之间性能相近。聚苯乙烯ELISA板由于原料的不同和制作工艺的差别,各种产品的质量差异很大,因此,每一批号的ELISA板在使用前须事先检查其性能。常用的检查方法为:以一定浓度的人IgG(一般为10ng/ml)包被ELISA板各孔,洗涤后每孔内加入适当稀释度的酶标抗人IgG抗体,保温后洗涤,加底物显色,终止酶反应后,分别测每孔溶液的吸光度。控制反应条件,使各孔读数在吸光度0.8左右。计算全部读数的平均值。所有单个读数与全部读数的均数之差,应小于10%。 与聚苯乙烯类似的塑料是聚氯乙烯。作为ELISA固相载体,聚氯乙烯的特点为质软板薄,可剪割,价廉,但光洁度不如聚苯乙烯板,孔底亦不如聚苯乙烯平整。聚氯乙烯对蛋白质的吸附性能比聚苯乙烯高,但空白值也略高。 第- 39 -页(共44页) 为比较不同固相在某一ELISA测定中的优劣,可应
用如下的试验:用其他免疫学测定方法选出一个典型的阳性标本和阴性标本,将它们进行一系列稀释后,在不同的固相载体上按预定的ELISA操作步骤进行测定,然后比较结果。在哪一种载体上阳性结果与阴性结果差别最大,这种载体就是这一ELISA测定项目的最合适的固相载体。 在ELISA中,用作固相载体的小珠一般为直径0.6cm的圆珠,表面经磨砂处理后吸附面积大大增加。ELISA板孔的吸附面积约为200mm2,小珠均为1000mm2,将近ELISA板孔的5倍。吸附面积的增大即意味着固相抗原或抗体量的增加。再者,球型小珠的表面弧度更有利于吸附的抗原决定簇或抗体结合位点的暴露面处于最佳反应状态,因此珠式ELISA的反应往往更为灵敏。小珠的另一特点是更易于使洗涤彻底,使用特殊的洗涤器,使小珠在洗涤过程中滚动淋洗,其洗涤效果远较板孔的浸泡式为好。但由于磨砂工艺的难度较大,小珠的均一性较差。 小试管作为固相载体也有较大的吸附表面,而且标本的反应量也相应增加。板式及珠式ELISA的标本量一般为00-200ul,而小试管可根据需要加大反应体积,标本反应量的增加有助于试验敏感性的提高。小试管还可以当作比色杯,最后直接放入分光光度计中比色。 也有应用聚苯乙烯胶乳或其他材料制成的微粒作为ELISA固相载体的。其优点是表面积极大,反应在悬液中进行,其速率与液相反应近似。以含铁的磁性微粒作为ELISA固相载体,反应后用磁铁的吸引进行分离,洗涤方便,试剂盒一般均配以特殊仪器。 3.1.2 包被的方式 将抗原或抗体固定在过程称为包被(coating)。换言之,包被即是抗原或抗体结合到固相载体表面的过程。蛋白质与聚苯乙烯固相载体是通过物理吸附结合的,靠的是蛋白质分子结构上的疏水基团与固相载体表面的疏水基团间的作用力。这种物理吸附是非特异性的,受蛋白质的分子量、等电点、浓度等的影响。载体对不同蛋白质的吸附能力是不相同的,大分子蛋白质较小分子蛋白质通常含有更多的疏水基团,故更易吸附到固相载体表面。IgG对聚苯乙烯等固相具有较强的吸附力,其联结多发生在Fc段上,抗体结合点暴露于外,因此抗体的包被一般均采用直接吸附法。蛋白质抗原大多也可采用与抗体相似的方法包被。当抗原决定簇存在于或邻近于疏水区域时,抗原与固相载体的直接吸附可使抗原决定簇不能充分暴露,在这种情况下,直接包被效果不佳,可以采用间接的捕获包被法,即先将针对该抗原的特异抗体作预包被,其后通过抗原抗体反应使抗原固相化。此间接结合在固相上的抗原远离载体表面,其抗原决定簇也得以充分暴露。间
接包被的抗原经固相抗体的亲和层析作用,包被在固相上的抗原纯度大大提高,因此含杂质较多的抗原也可采用捕获包被法(见2.2.4),试验的特异性、敏感性均由此得以改善,重复性亦佳。间接包被的另一优点是抗原用量少,仅为直接包被的1/10乃至于/100。不易吸附在聚苯乙烯载体上的非蛋白质抗原可采用特殊的包被方式。例如,在检测抗DNA抗体时,需用DNA作为包被抗原,而普遍的固相载体一般不能直接与核酸结合。可将聚苯乙烯板先经紫外线照射(例如30W紫外灯,75cm照射12小时),以增加其吸附性能。固相载体先用碱性蛋白质,如聚赖氨酸、鱼精蛋白等作预包被,也可提高核酸的结合力。也可用亲和素生物素系 统作间接包被,即用亲和素先包被载体,然后加入生物素化的DNA,这种包被方法均匀、牢固,已扩大应用于各种抗原物质的定量测定。 脂类物质无法与固相载体结合,可将其在有机溶剂(例如乙醇)中溶解后加入ELISA板孔中,开盖置冰箱过夜或冷风吹干,待酒精挥发后,让脂质自然干固在固相表面。抗心磷脂抗体的ELISA试剂一般采用这种包被方式。 3.1.3 包被用抗原 第- 40 -页(共44页) 用于包被固相载体的抗原按其来源不同可分为天然抗原、重组抗原和合成多肽抗原三大类。天然抗原可取自动物组织、微生物培养物等,须经提取纯化才能作包被用。如HBsAg可以从携带者的血清中提取,一般的细菌和病毒抗原可以从其培养物中提取,蛋白成份抗原可从富含此抗原的材料中提取等(例如AFP从脐带血或胎肝中提取)。重组抗原是抗原基因在质粒体中表达的蛋白质抗原,多以大肠杆菌或酵母菌为质粒体。重组抗原的优点是除工程菌成份外,其他杂质少,而且无传染性,但纯化技术难度较大。以大肠杆菌为质粒体的重组抗原如不能充分除大肠杆菌成份,用于ELISA,在反应中可出现假阳性,因不少受检者受大肠杆菌感染而在血清中存在抗大肠杆菌抗体。重组抗原的另一特点是能用基因工程制备某些无法从天然材料中分离的抗原物质。例如丙型肝炎病毒(HCV)尚不能培养成功,而且丙肝病人血清中HCV抗原含量极微。目前检测抗HCV ELISA中所用包被抗原大多为根据HCV的基因克隆表达而制备的重组抗原。在传染病诊断中,不少重组抗原如HBsAg、HBeAg和HIV抗原等均在ELISA中取得应用。合成多肽抗原是根据蛋白质抗原分子的某一抗原决定簇的氨基酸序列人工合成的多肽片段。多肽抗原一般只含有一个抗原决定簇,纯度高,特异性也高,但由于分子量太小,往往难于直接吸附于固相上。多肽抗原的包被一般需先使其与无关蛋白质如牛血清白蛋白质(
BSA)等偶联,借助于偶联物与固相载体的吸附,间接地结合到固相载体表面。应用多肽抗原的另一注意点为他仅能检测与其相应的抗体。一种蛋白质抗原往往含有多个不同的能引起抗体产生的决定簇,因此在受检血清中的其他抗体就不能与该多肽抗原发生反应。另外,某些微生物发生变异时往往发生抗原结构变化,在这种情况下,用个别多肽抗原进行包被可引起其他抗体的漏检。 3.1.4 包被用抗体 包被固相载体的抗体应具有高亲和力和高特异性,可取材于抗血清或含单克隆抗体的腹水或培养液。如免疫用抗原中含有杂质(即便是极微量的),在抗血清中将出现杂抗体,必须除去(可用吸收法)后才能用于ELISA,以保证试验的特异性。抗血清不能直接用于包被,应先提取IgG,通常采用硫酸铵盐析和Sephadex凝胶过滤法。一般经硫酸铵盐析粗提的IgG已可用于包被,高度纯化的IgG性质不稳定。如需用高亲和力的抗体包被以提高试验的敏感性,则可采用亲和层析法以除去抗血清中含量较多的非特异性IgG。腹水中单抗的浓度较高,特异性亦较强,因此不需要作吸收和亲和层析处理,一般可将腹水作适当稀释后直接包被,必要时也可用纯化的IgG。应用单抗包被时应注意,一种单抗仅针对一种抗原决定簇,在某些情况下,用多种单抗混合包被,可取得更好的效果。 3.1.5 包被的条件 包被用抗原或抗体的浓度,包被的温度和时间,包被液的pH等应根据试验的特点和材料的性质而选定。抗体和蛋白质抗原一般采用pH9.6的碳酸盐缓冲液作为稀释液,也有用pH7.2的磷酸盐缓冲液及pH7~8的Tris-HCL缓冲液作为稀释液的。通常在ELISA板孔中加入包被液后,在4-8℃冰箱中放置过夜,37℃中保温2小时被认为具有同等的包被效果。包被的最适当浓度随载体和包被物的性质可有很大的变化,每批材料需通过实验与酶结合物的浓度协调选定。一般蛋白质的包被浓度为100ng/ml-20ug/ml。 3.1.6 封闭 封闭(blocking)是继包被之后用高浓度的无关蛋白质溶液再包被的过程。抗原或抗体包被时所用的浓度较低,吸收后固相载体表面尚有未被占据的空隙,封闭就是让大量不相关的蛋白质充填这些空隙,从而排斥在ELISA其后的步骤中干扰物质的再吸附。封闭的手续与包被相类似。最常用的封闭剂是0.05%-0.5%的牛血清白蛋白,也有用10%的小牛血清或1%明胶作为封闭剂的。脱脂奶粉也是一种良好的封闭剂,其最大的特点是价廉,可以高浓度使用(5%)。高质量的速溶食用低脂奶第- 41 -页(共44页) 粉即可直接当作封闭剂使用,但由于奶粉的成份复杂,而且封闭后的载体不易长期保存,因此在试剂盒的制
备中较少应用。 封闭是否必要,取决于ELISA的模式及具体的实验条件。并非所有的ELISA固相均需封闭,封闭不当反而会使阴性本底增高。一般说来,双抗体夹心法,只要酶标记物是高活性的,操作时洗涤彻底,不经封闭也可得到满意的结果。特别是用单抗腹水直接包被时,因其中大量非抗体蛋白在包被时同样也吸附在固相表面,业已起到了类似封闭剂的作用。但在间接法测定中,封闭一般是不可少的(见2.2.2)。包被好的ELISA板干燥后放入密封袋或锡袋中,在低温可保存数月。 3.2 酶联物酶联物酶联物酶联物((((结合物结合物结合物结合物)))) 结合物即酶标记的抗体(或抗原),是ELISA中最关键的试剂。良好的结合物应该是既保有酶的催化活性,也保持了抗体(或抗原)的免疫活性。结合物中酶与抗体(或抗原)之间有恰当的分子比例,在结合试剂中应尽量不含有或少含有游离的(未结合的)酶或游离的抗体(或抗原)。此外,结合物尚要有良好的稳定性。 3.2.1酶 用于ELISA的酶应符合以下要求:纯度高,催化反应的转化率高,专一性强,性质稳定,来源丰富,价格不贵,制备成酶结合物后仍继续保留它的活性部分和催化能力。最好在受检标本中不存在相同的酶。另外,它的相应底物易于制备和保存,价格低廉,有色产物易于测定等。 在ELISA中,常用的酶为辣根过氧化物酶(horseradish peroxidase, HRP)和碱性磷酸酶(alkaline phosohatase, AP)。在少数商品ELISA试剂中,应用的酶尚有葡萄糖氧化酶、β-D-半乳糖苷酶和脲酶等。国产ELISA试剂一般都用HRP制备结合物。HRP是一种糖蛋白,含糖量约为18%,分子量为44000,是一种复合酶,由主酶(酶蛋白)和辅基(亚铁血红素)结合而成,是一种卟啉蛋白质。主酶无色糖蛋白在275nm波长处有最高吸收峰,辅基是深棕色的含铁卟啉环,在403nm波长处有最高吸收峰。HRP的纯度用RZ(Reinheit Zahl,德文,意为纯度数)表示,是403nm的吸光度与280nm吸光度之比,高纯度的HRP的RZ≥?.0。 HRP除符合上述的ELISA中标记酶的要求外,更有价格低廉和性质较稳定的特点。值得注意的是,在选用酶制剂时,除其纯度RZ外,更应注意酶的活力。高纯度的酶如保存不当,活力也会降低。酶制剂的活力以所含的酶活力单位表示,可用对底物作用后生成产物量的测定进行试验。 国外很多ELISA试剂采用碱性磷酸酶(AP)作为标记酶。常用的AP有两个来源,分别从大肠杆菌和小牛肠膜中提取。不同来源的酶生化特性特性略不相同,从大肠杆菌中提取的AP分子量为80000,酶作用的最适合pH为8.0;用小牛肠膜中提取的AP分子量为100000,最适pH为9.6。
在ELISA中,AP系统的敏感度一般高于HRP系统,空白值也较低,但AP价格昂贵,制备结合物所得率也较HRP低。 3.2.2 抗原和抗体 制备结合物时所用抗体一般 均为纯度较高的IgG,以免在与酶联结时其他杂蛋白的干扰。最好用亲和层析纯的抗体,这样全部酶结合物均具有特异的免疫活性,可以在高稀释度进行反应,实验结果本底浅淡。如用F(ab')2进行标记,则更可避免标本中RF的干扰。在ELISA中用酶标抗原的模式不多,总的要求是抗原必须是高纯度的。 3.2.3 结合物的制备 酶标记抗体的制备方法主要有两种,即戊二醛交联法和过碘酸盐氧化法。 第- 42 -页(共44页) (1)戊二醛交联法:戊二醛是一种双功能团试剂,它可以使酶与蛋白质的氨基通过它而联结。碱性磷酸一般用此法进行标记。交联方法一步法、两步法两种。在一步法中戊二醛直接加入酶与抗体的混合物中,反应后即得酶标记抗体。 ELISA中常用的酶一般都用此法交联。它具有操作简便、有效(结合率达60%-70%)和重复性好等优点。缺点是交联反应是随机的,酶与抗体交联时分子间的比例不严格,结合物的大小也不均一,酶与酶,抗体与抗体之间也有可能交联,影响效果。诹讲椒ㄖ校?br> 先将酶与戊二醛作用,透析除去多余的戊二醛后,再与抗体作用而形成酶标抗体。也可先将抗体与戊二醛作用,再与酶联结。两步法的产物中绝大部分的酶与蛋白质是以1:1的比例结合的,较一步法的酶结合物更有助于本底的改善以提高敏感度,但其偶联的有效率较一步法低。 (2)过碘酸盐氧化法:本法只适用于含糖量较高的酶。辣根过氧化物酶的标记常用此法。反应时,过碘酸钠将HRP分子表面的多糖氧化为醛基很活泼,可与蛋白质上的氨基形成Schiff氏碱而结合。酶标记物按克分子比例联结,其最佳比例为:酶/抗体=1-2/1。此法简便有效,一般认为是HRP最可取的标记方法,但也有人认为所有试剂较为强烈,各批实验结果不易重演。 按以上方法制备的酶结合物一般都混有未结合物的酶和抗体。理论上,结合物中混有的游离酶一般不影响ELISA中最后的酶活性测定,因经过彻底洗涤,游离酶可被除去,并不影响最终的显色。但游离的抗体则不同,它会与酶标抗体竞争相应的固相抗原,从而减少了结合到固相上的酶标抗体的量。因此制备的酶结合物应予纯化,去除游离的酶和抗体后用于检测,效果更好。纯化的方法很多,分离大分子化合物的方法均可应用。硫酸铵盐析法最为简便,但效果并不理想,因为此法只能去除留在上清中的游离酶,但相当数量的游离抗体仍与酶结合物一起沉淀而不能分开。用离子
交换层析或分子筛分离更为可取,高效液相层析法可将制备的结合物清晰地分成三个部分:游离酶、游离抗体和纯结合物而取得最佳的分离效果,但费用较贵。 结合物制得后,在用作ELISA试剂前尚需确定其适当的工作浓度。使用过浓的结合物,既不经济,又可使本底增高;结合物的浓度过低,则又影响检测的敏感性。所以必须对结合物的浓度予以选择。最适的工作浓度就是指结合物稀释至这一浓度时,能维护一个低的本底,并获得测定的最佳灵敏度,达到最合适的测定条件和测定费用的节省。就酶标抗体本身而言,它的有效工作浓度是指与其相应抗原包被的载体作试验时,能得到阳性反应的最高稀释度。例如某一HRP:抗人IgG制剂标明的工作浓度为1:5000,表示该制剂经1:5000稀释后,在与人IgG包被的固相作ELISA试验时,将发生阳性反应。但在用于具体的ELISA检测中,酶标抗体的最适工作浓度受到固相载体的性质、包被抗原或抗体的纯度以及整个检测系统如标本、反应温度和时间等的影响,因此必须在实际测定条件下进行"滴配"选择能达到高敏感度的最大稀释度作为试剂盒中的工作浓度。 3.2.4 结合物的保存 酶标抗体中的酶和抗体均为生物活性物质,保存不当,极易失活。高浓度的结合物较为稳定,冰冻干燥后可在普通冰箱中保存一年左右,但冻干过程中引起活力的减低,而且使用时需经复溶,颇为不便。结合物溶液中加入等体积的甘油可在低温冰箱或普通冰箱的冰格中较长时间保存。早期的ELISA试剂盒中的结合物一般均按以上两种形式供应,配以稀释液(见3.2.5)临用时按标明的稀释度稀释成工作液。现在较先进的ELISA试剂盒均已用合适的缓冲液配成工作液,使用时不需再行稀释,在4-8℃保存期可达6个月。由于蛋白质浓度较低,结合物易失活,需加入蛋白保护剂。另外再加入抗生素(例如庆大霉素)和防腐剂(HRP结合物加硫柳泵,AP结合物可加叠氮钠),以防止细菌生长。 第- 43 -页(共44页) 3.2.5 结合物的稀释液 用于稀释高浓度的结合物以配成工作液。为避免结合物在反应中直接吸附在固相载体上,在稀释缓冲液中常加入高浓度的无关蛋白质(例如1%牛血清白蛋白),通过竞争以抑制结合物的吸附。一般还加入具有抑制蛋白质吸附于塑料表面的非离子型表面活性剂,如吐温20,0.05%的浓度较为适宜。在间接测定抗体时,血清标本需稀释后进行测定,也可应用这种稀释液。 3.3 酶的底物酶的底物酶的底物酶的底物 3.3.1 HRP的底物 HRP催化过氧化物的氧化反应,最具代表性的过氧化物为H2O2,其反应式如下:DH2+ H2O2 D+ H2O 上式中,DH2为
供氧体,H2O2为受氢体。在ELISA中,DH2一般为无色化合物,经酶作用后成为有色的产物,以便作比色测定。常用的供氢体有邻苯二胺(O-phenylenediamine,OPD)、四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)和ABTS[2,2'-azino-di-(3-ethylbenziazobine sulfonate-6)]。 OPD氧化后的产物呈橙红色,用酸终止酶反应后,在492nm处有最高吸收峰,灵敏度高,比色方便,是HRP结合物最常用的底物。OPD本身难溶于水,OPD·2HCL为水溶性。曾有报道OPD有致异变性,操作时应予注意。OPD见光易变质,与过氧化氢混合成底物应用液后更不稳定,须现配置现用。在试剂盒中,OPD和H2O2一般分成二组分,OPD可制成一定量的粉剂或片剂形式,片剂中含有发泡助溶剂,使用更为方便。过氧化氢则配入底物缓冲液中,有制成易保存的浓缩液,使用时用蒸馏水稀释。先进的ELISA试剂盒中则直接配成含保护剂的工作浓度为0.02% H2O2的应用液,只需加入OPD后即可作为底物应用液。 TMB经HRP作用后共产物显蓝色,目视对比鲜明。TMB性质较稳定,可配成溶液试剂,只需与H2O2溶液混和即成应用液,可直接作底物使用。另外,TMB又有无致癌性等优点,因此在ELISA中应用日趋广泛。酶反应用HCL或H2SO4终止后,TMB产物由蓝色呈黄色,可在比色计中定量,最适吸收波长为405nm。 ABTS虽不如OPD和TMB敏感,但空白值极低,也为一些试剂盒所采用。 另一种HRP的底物为3-(4-羟基)苯丙酸[3-(4-hydroxy)phenly propionic acid,HPPA],经HRP作用后,产物显荧光,可用荧光光度计测量。用于ELISA的优点为可加宽定量测定的线性范围。 HRP对氢受体的专一性很高,仅作用于H2O2、小分醇的过氧化物和尿素过氧化物(urea peroxide)。H2O2应用最多,但尿素过氧化物为固体,作为试剂较H2O2方便、稳定。试剂盒供应尿素过氧化物片剂,用蒸馏水溶解后,在底物缓冲液中密闭、低温(2~8℃)可稳定1年。 3.3.2 AP的底物 AP为磷酸酯酶,一般采用对硝基苯磷酸酯(p-nitrophenyl phosphate,p-NPP)作为底物,可制成片剂,使用方便。产物为黄色的对硝基酚,在405nm波长处有吸收峰。用NaOH终止酶反应后,黄色可稳定一时间。AP也有发荧光底物(磷酸4-甲基伞酮),可用于ELISA作荧光测定,敏感度较高于用显色底物的比色法。 3.4 洗涤液洗涤液洗涤液洗涤液 在板式ELISA中,常用的稀释液为含0.05%吐温20磷酸缓冲盐水。 第- 44 -页(共44页) 3.5 酶反应终止液酶反应终止液酶反应终止液酶反应终止液 常用的HRP反应终止液为硫酸,其浓度按加量及比色液的最终体积而异,在板式ELISA中一般采用2mol/L。 3.6 阳性对照品和阴性对照品阳性对照品和阴性对照品阳性对照品和阴性对照品阳性对
照品和阴性对照品 阳性对照品(positive control)和阴性对照品(negative control)是检验试验有效性的控制品,同时也作为判断结果的对照,因此对照品,特别是阳性对照品的基本组成应尽量与检测标本的组成相一致。以人血清为标本的测定,对照品最好也为人血清,因为正常人血清在各种ELISA模式中可产生不同程度的本底。由于大量正常人血甭较难得到,国外试剂盒中的对照品多以复钙人血浆(recalcified human plasma)为原料,即在血浆中加入钙离子,使其中的纤维蛋白质凝固,除去凝块后所得的液体,其组成与血清相似。阴性对照品须先行检测,确定其中不含待测物质。例如HBsAg检测的阴性对照品中不可含HBsAg,最好抗HBs也是阴性。阳性对照品多以含蛋白保护剂的缓冲液为基质,其中加入一定量的待检物质,此量最好在试剂说明书中标明。加入的量应与试剂的敏感度相称,在测定中得到的吸光值与受检标本吸光值比较,可对标本中受检物质的量有一个粗略的估计。国外检测HBsAg的ELISA试剂盒检测敏感度约为0.5ng/ml,阳性对照品中含量约为10ng/ml。在对照品中一般加入抗生素和防腐剂,以利保存。 3.7 参考标准品参考标准品参考标准品参考标准品 定量测定的ELISA试剂盒(例如甲胎蛋白质癌胚抗原测定等)应含有制作标准曲线用的参考标准品,应包括覆盖可检测范围的4-5个浓度,一般均配入含蛋白保护剂及防腐剂的缓冲液中。 ELISA常用试剂的配制常用试剂的配制常用试剂的配制常用试剂的配制 1、抗体或免疫球蛋白稀释液0.01mol/L pH7.2PBS NaH2PO4·2H2O 0.39克 Na2HPO4 1.27克 NaCl 0.85克 NaN3 200mg H2O(蒸馏水) 至 1000ml 2、ELISA洗液及HRP标记抗体稀释液PH7.4,PBST NaCl 2.0克 KH2PO4 0.2克 Na2HPO4·12H2O 2.9克 KCl 0.2克 NaN3 0.2克 H2O 至 1000ml 吐温(Tween)20 0.5ml 4°C保存备用 3、包被液(简称CB)pH9.6 Na2CO3 1.59克 第- 45 -页(共44页) NaHCO3 2.93克 NaN3 0.2克 H2O 至 1000ml 密封盖好,4°C存放备用 4、ELISA底物液(可溶性底物) 磷酸-柠檬酸缓冲液pH5.0 0.1mol/L柠檬酸(21.014克/100ml) 24.3ml 0.2mol/L Na2 HPO4(28.4克/1000ml) 25.7ml H2O 50ml 4°C存放备用 5、DAB底物液(不溶性底物,组化病理等) 0.05mol/L pH7.6 Tris-HCL Tris 6.05克 HCL(36%) 3.15克(约2.7ml浓HCL) H2O 至 1000ml DAB为3?,3?二氧基联苯胺,不溶性底物,呈棕红色 6、DAB溶液配制:(组化及Western blot 显色) 称DAB30mg,用0.05mol/L pH7.6Trs-HCL缓冲液100ml溶解,如有沉淀,过滤后使用,一般新鲜配制使用。 用前加入1%H2O2 1-1.5ml,H2O2浓度为0.01%,混均后使用。 7、3?,3?,5?,5?,-四甲基联苯胺(TMB)溶液配制: 用二甲基甲酰胺(dimethylformamide,
DMF)或无水乙醇,将TMB配成1%浓度,4°C保存半年以内使用。 使用前,用pH5.0磷酸-柠檬酸底物液9.9ml加入0.1ml(1mg/TMB)1%TMB液,再按每毫升TMB加入30%H2O2 1ul混匀后立即使用。 2N H2SO4终止后,450nm测定OD值。 8、1%离子琼脂胶配制液 作免疫双相扩散,单相扩散及免疫电泳中使用。 0.05UpH8.6巴比妥钠-HCL缓冲液 巴比妥钠 23.8克 1mol/L HCL 34.5ml H2O 2150ml
-
有关实验报告的书写格式
有关实验报告的书写格式江苏省泗阳县李口中学沈正中一、完整实验报告的书写完整的一份实验报告一般包括以下项目:实验名称:实验目的:实验…
-
实验报告(实验步骤、评分标准)
实验报告实验步骤评分标准实验A探究化学变化过程中常伴随的现象实验仪器酒精灯坩埚钳石棉网镊子试管胶头滴管烧杯废液缸1打开细口瓶用量筒…
-
数据分析实验报告
数据分析课程实验报告学院:理学院专业:信息与计算科学班级:姓名:学号:一、实验题目所做实验属于哪一部分的内容。例如:一元线形回归及…
-
网页制作实验报告完成步骤
《网页与Web程序设计》实验报告年级:20xx级(必修)学号:20xx姓名:专业:一、实验题目分析或参考给定的“网站设计实例”,设…
-
程序实验报告
《程序设计基础》实验报告实验一面向过程的简单程序设计1.实验目的掌握C++语言的数据类型(包括对各种数据类型变量的定义、初始化、赋…
-
20xx年教育系统教师年度考核个人工作总结
20xx年教师年度考核个人工作总结一年来,本人积极地工作,虚心请教,耐心教育学生,得到上级领导及家长们的表扬和肯定,现将一年来的工…
-
师生书画展总结
新城二中艺术节师生书画展总结书画乐七彩丹青歌盛世翰墨缘笔墨互动抒豪情。为弘扬民族传统文化,促进校园文化繁荣发展,展现广大师生高雅健…
-
六年级上班主任工作总结
六年级上学期班主任工作总结时间飞逝,转眼间一学年又要结束了。本学年我担任了六年级二班班主任工作和教学工作。班主任工作千丝万缕、繁琐…
-
房地产总结
半年度工作总结当华美的叶片落尽,生命的脉络才历历可见。在这半年里我从一名还未初出茅庐的大学生到正式加入博思堂大家庭,从象牙塔般的大…
-
办公室个人工作总结
办公室工作总结一年来,办公室在局党组的正确领导下,在各科室的支持下,全面贯彻落实科学发展观,贯彻落实党的十七大、十七届三中全会、省…