实验五 氧化还原反应与电极电势
实验五 氧化还原反应与电极电势
一、实验目的
1、掌握电极电势对氧化还原反应的影响。
2、定性观察浓度、酸度对电极电势的影响。
3、定性观察浓度、酸度、温度、催化剂对氧化还原反应的方向、产物、速度的影响。
4、通过实验了解原电池的装置。
二、实验原理
氧化剂和还原剂的氧化、还原能力强弱,可根据她们的电极电势的相对大小来衡量。电极电势的值越大,则氧化态的氧化能力越强,其氧化态物质是较强氧化剂。电极电势的值越小,则还原态的还原能力越强,其还原态物质是较强还原剂。只有较强的氧化剂才能和较强还原剂反应。即φ氧化剂-φ还原剂﹥0时,氧化还原反应可以正方向进行。故根据电极电势可以判断氧化还原反应的方向。
利用氧化还原反应而产生电流的装置,称原电池。原电池的电动势等于正、负两极的电极电势之差:E = φ正-φ负。根据能斯特方程:


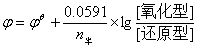
其中[氧化型]/[还原型]表示氧化态一边各物质浓度幂次方的乘积与还原态一边各物质浓度幂次方乘积之比。所以氧化型或还原型的浓度、酸度改变时,则电极电势φ值必定发生改变,从而引起电动势E将发生改变。准确测定电动势是用对消法在电位计上进行的。本实验只是为了定性进行比较,所以采用伏特计。浓度及酸度对电极电势的影响,可能导致氧化还原反应方向的改变,也可以影响氧化还原反应的产物。
三、仪器和药品
仪器:试管,烧杯,伏特计,表面皿,U形管
药品:2 mol·L-1 HCl,浓HNO3, 1mol·L-1 HNO3,3mol·L-1HAc,1mol·L-1 H2SO4,3mol·L-1 H2SO4,0.1mol·L-1 H2C2O4,浓NH3·H2O(2mol·L-1),6mol·L-1NaOH,40%NaOH。 1mol·L-1 ZnSO4,1mol·L-1 CuSO4,0.1mol·L-1KI,0.1mol·L-1AgNO3,0.1mol·L-1KBr,0.1mol·L-1FeCl3,0.1mol·L-1Fe2(SO4)3,0.1mol·L-1FeSO4,1mol·L-1FeSO4, 0.4mol·L-1K2Cr2O7, 0.001mol·L-1KMnO4,0.1mol·L-1Na2SO3,0.1mol·L-1Na3AsO3,
0.1mol·L-1 MnSO4, 0.1mol·L-1NH4SCN, 0.01mol·L-1I2水,Br2水,CCl4,固体NH4F,固体(NH4)2S2O8,饱和KCl。锌粒,琼脂,电极(锌片、铜片、铁片、碳棒),水浴锅,导线,鳄鱼夹,砂纸,红色石蕊试纸。
四、实验内容
1.电极电势和氧化还原反应
(1)在试管中分别加入少量0.5mL 0.1mol·L-1 KI溶液和2滴0.1mol·L-1 FeCl3溶液,混匀后加入0.5mL CCl4,充分振荡,观察CCl4层颜色有何变化?
(2)用0.1mol·L-1KBr溶液代替KI进行同样实验,观察CCl4层是否有Br2的橙红色?
(3)分别用Br2水和I2水同0.1mol·L-1FeSO4溶液作用,有何现象?再加入1滴0.1mol·L-1NH4SCN溶液,又有何现象?
根据以上实验事实,定性比较Br2/Br-、I2/I-、Fe3+/Fe2+三个电对的电极电势相对高低,指出哪个物质是最强的氧化剂,哪个物质是最强的还原剂,并说明电极电势和氧化还原反应的关系。
2.浓度和酸度对电极电势的影响
(1)浓度影响
1) 在两支50mL烧杯中,分别加入30mL 1mol·L-1 ZnSO4和30mL 1mol·L-1 CuSO4溶液。在ZnSO4溶液中插入Zn片,在CuSO4溶液中插入Cu片,用导线将Zn片和Cu片分别与伏特计的负极和正极相连,用盐桥连通两个烧杯溶液,测量电动势(如图33所示)。
2)取出盐桥,在CuSO4溶液中滴加浓NH3·H2O溶液并不断搅拌,至生成的沉淀溶解而形成蓝色溶液,放入盐桥,观察伏特计有何变化。利用能斯特方程解释实验现象。
CuSO4 + 2NH3·H2O = Cu2(OH)2SO4 + (NH4)2SO4
(NH4)2SO4 + 2NH3·H2O = 2[Cu(NH3)4]2+ + SO42- + 2OH-
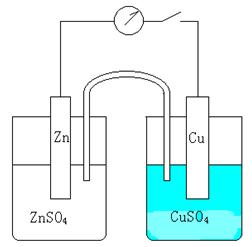
图33 原电池装置
3)再取出盐桥,在ZnSO4溶液中滴加浓NH3·H2O溶液并不断搅拌至生成的沉淀溶解后,放入盐桥,观察伏特计有何变化。利用能斯特方程解释实验现象。
ZnSO4 + 2NH3·H2O = Zn (OH)2+ (NH4)2SO4
Zn (OH)2+ 4NH3 = [Zn(NH3)4]2+ + 2OH-
(2)酸度影响
1)取两支50mL烧杯,在一只烧杯中注入30mL 1mol·L-1 FeSO4溶液,插入Fe片,另一只烧杯中注入30mL 0.4mol·L-1 K2Cr2O7溶液,插入碳棒。将Fe片和碳棒通过导线分别与伏特计的负极和正极相连,用盐桥连通两个烧杯溶液,测量电动势。
2)往盛有K2Cr2O7的溶液中,慢慢加入1mol·L-1 H2SO4溶液,观察电压有何变化?再往K2Cr2O7的溶液中逐滴加入6mol·L-1NaOH,观察电压有何变化?
3.浓度和酸度对氧化还原产物的影响
(1)取两支试管,各放一粒锌粒,分别注入2mL浓HNO3和1mol·L-1 HNO3,观察所发生现象。写出有关反应式。浓HNO3被还原后的产物可通过观察生成气体的颜色来判断。稀HNO3的还原产物可用气室法检验溶液中是否NH4+离子生成的方法来确定。
气室法检验NH4+离子:将5滴被检验溶液滴入一个表面皿中,再加3滴40%NaOH混匀。将另一个较小的表面皿中黏附一小块湿润的红色石蕊试纸,把它盖在大的表面皿上做成气室。将此气室放在水浴上微热两分钟,若石蕊试纸变蓝色,则表示有NH4+离子存在。
加入3mL去离子水,用pH试纸测定其pH值,再分别加入5滴0.1mol·L-1 HCl或0.1mol·L-1NaOH溶液,测定它们的pH值。
(2)在3支试管中,各加入0.5mL0.1mol·L-1 Na2SO3溶液,再分别加入1mol·L-1 H2SO4、蒸馏水、6mol·L-1NaOH溶液各0.5mL,摇匀后,往三支试管中加入几滴0.001mol·L-1KMnO4溶液。观察反应产物有何不同?写出有关反应式。
4.浓度和酸度对氧化还原反应方向的影响
(1)浓度的影响
1)在一支试管中加入1mL水,1mL CCl4和1mL0.1mol·L-1Fe2(SO4)3溶液,摇匀后,再加入1mL0.1mol·L-1KI溶液,振荡后观察CCl4层的颜色。
2)取另一支试管加入1mL CCl4,1mL0.1mol·L-1Fe SO4和1mL0.1mol·L-1Fe2(SO4)3溶液,摇匀后,再加入1mL0.1mol·L-1KI溶液,振荡后观察CCl4层的颜色与上一实验中的颜色有何区别?
3)在以上两个试管中分别加入固体NH4F少许,振荡后观察CCl4层的颜色变化。
(2)酸度影响
在试管中加入0.1mol·L-1Na3AsO3溶液5滴,再加入I2水5滴,观察溶液颜色。然后用2mol·L-1HCl酸化,又有何变化?再加入40%NaOH,有何变化?写出有关反应方程式,并解释之。
5.酸度、温度和催化剂对氧化还原反应速度的影响
(1)温度影响 在两支各盛1mL 0.1mol·L-1KBr溶液的试管中,分别加入3mol·L-1H2SO4和3mol·L-1HAc溶液0.5mL,然后往两支试管中各加入2滴0.001mol·L-1KMnO4溶液。观察并比较两支试管中紫红色褪色的快慢。写出有关反应方程式,并解释之。
(2)温度影响 在两支试管中分别加入1mL0.1mol·L-1 H2C2O4,5滴1mol·L-1 H2SO4和1滴0.001mol·L-1KMnO4溶液,摇匀,将一支试管放入80℃水浴中加热,另一支不加热,观察两支试管褪色的快慢。写出有关反应方程式,并解释之。
(3)催化剂的影响 在两支试管中分别加入2滴0.1mol·L-1 MnSO4溶液1mL1mol·L-1 HSO4和少许固体(NH4)2S2O8,振荡使其溶解。然后往一支试管中加入2~3滴0.1mol·L-1AgNO3溶液,另一支不加,微热。比较两支试管反应现象有何不同?为什么?
五、注意事项
1、电极Cu片、Zn片及导线头,鳄鱼夹等必须用砂纸打干净,若接触不良,会影响伏特计读数,正极接在3V处。
2、FeSO4和Na2SO3必须新鲜配制。
3、滴瓶使用时不能倒持滴管,也不能将滴管插入试管中,而要悬空从试管上方按实验用量滴入,用完立即插回原试液滴瓶中。
4、试管中加入锌粒时,要将试管倾斜,让锌粒沿试管内壁滑到底部。
六、思考题
1、通过本次实验,你能归纳出哪些因素影响电极电势?怎样影响?
2、为什么K2Cr2O7能氧化浓HCl中的Cl-离子,而不能氧化浓度比HCl大得多的NaCl浓溶液中的Cl-离子?
3、如何将反应KMnO4 + KI + H2SO4 → MnSO4 + I2 + H2O设计成一个原电池,写出原电池符号及电极反应式?
4、两电对的标准电极电势值相差越大,反应是否进行得越快?你能否用实验证明你的结论?
5、试验中,对“电极本性对电极电势的影响”你是如何理解的?
6、若用饱和甘汞电极来测定锌电极的电极电势,应如何组成电池?写出原电池符号及电极反应式。
[附注] 盐桥的制法:
称取1g琼脂,放在100mL饱和KCl溶液中浸泡一会,加热煮成糊状,趁热倒如U形玻璃管(里面不能有气泡)中,冷却后即成。
第二篇:第5章 氧化还原反应和电极电势
第5章 氧化还原反应和电极电势
一、 教学要求:
1.掌握氧化数、氧化与还原、氧化态、还原态、氧化还原电对、原电池、电极电势、标准氢电极、标准电极电势等基本概念;并能对氧化还原反应方程式进行配平。
2.掌握用电池符号表示原电池及原电池电动势的计算;了解原电池电动势与?rGm的关系。
3.掌握能斯特方程式及浓度(或分压)、酸度、沉淀反应对电极电势影响的相关计算。
4.掌握电极电势的应用(判断氧化剂或还原剂的相对强弱,确定氧化还原反应进行的方向、次序和程度)。
5.掌握原电池电动势与氧化还原反应平衡常数的关系,了解元素的标准电极电势图及其应用。
【重点】:
1.氧化还原反应、原电池及电极电势的概念,离子电子法配平氧化还原反应方程式;
2.运用标准电极电势判断氧化剂、还原剂的相对强弱及标准状态下氧化还原反应自发进行的方向、反应的完成程度;
3.能斯特方程的应用,判断非标准状态时氧化还反应的自发方向。掌握酸度、沉淀反应、配位反应等对氧化还原反应方向的影响;
4.利用元素的标准电极电势图判断元素不同氧化态的稳定性。
【难点】:
1. 电极电势的概念及其应用;
2.能斯特方程的应用。。
二、重点内容概要
1.氧化数和氧化还原反应方程式的配平
1.1氧化数
氧化数:“氧化数是指某元素一个原子的“形式电荷数”,该电荷数是假定把每个化学键中的电子指定给电负性(原子在分子中吸引电子的能力)更大的原子而求得”。
1.2氧化还原反应与电对
任何氧化还原反应,都包括两个半反应,即氧化反应和还原反应,且两个反应同时发生,
3+-2+-在下列反应中 2Fe + 2I + I2 I失电子,氧化数升高,为还原剂,发生氧
3+化反应;Fe得电子,氧化数降低,为氧化剂,发生还原反应。
氧化还原电对:任何一种元素的两种不同氧化数状态,如Fe3+/Fe2+ Zn2+/Zn Cu2+/ Cu
1.3 氧化还原反应方程式的配平方法
经常遇到的氧化还原反应大都是以离子的形式在水溶液中进行的,对这类氧化还原反应方程式的配平常用离子-电子法。
配平原则:①质量守恒:反应前后各元素原子的种类和数目不变。
② 电荷平衡:反应中得失电子数相等即氧化剂得电子数等于还原剂失电子数。
2. 原电池和电极电势
1
2.1 原电池和电极
电极是电池的基本组成部分,电极的种类很多,根据它们各自组成的特点,一般可分为四类。
(1)金属—金属离子电极 Zn2+ Zn+ 2e Zn︱Zn2+(c)
(2)金属—金属难溶盐电极 AgCl(aq)+e Ag(s) + Cl Ag|AgCl?|Ccl (-
(3)氧化还原电极 Fe3+(aq) + e Fe2+(aq) Pt|Fe3+(c1),Fe2+(c2)
(4)气体—离子电极 2H+(aq)+2e 2(g) Pt|H2(p)|H+(c)
原电池由两个电极(半电池)构成,分别发生氧化反应和还原反应(也称电极反应)。每个半电池由一对氧化态与还原态物质组成,称为一个“氧化还原电对”,简称为电对,常用符号“氧化态/还原态”表示。如Zn2+/Zn电对, Zn2+为氧化态,Zn为还原态。原电池常用符号表示,通常将电池的负极写在左边,电池的正极写在右边,中间用盐桥(“‖”表示盐桥)联通,如铜一锌原电池可表示为:
2+2+(-)Zn︱Zn(c) ‖Cu(c)︱Cu(+)
负极 锌半电池 铜半电池 正极
电极反应中常含有一种能导电的固体物质,称为“电极”。有些电极即起导电作用又参与电极反应,有些电极只起导电作用但不参与电极反应,称“惰性电极”。
2.2电极电势与电池电动势
电极电势 是指金属在其盐溶液中达沉积—溶解平衡时,金属表面与盐溶液中的金属离子间产生的平衡电势(φ)。通常采用相对电极电势,一般以标准状态下氢电极H+(1mol?L-1) ? H2(100Pa)作为标准而求得,用φθ表示。
原电池两电极间的电势差称为“电池电动势” 用符号ε表示,并规定ε =φ(+)-φ(-) 标准电极电势φθ:参与电极反应的各物质均处于热力学标准状态下的电极电势
对在水溶液中进行的反应,可用φθ值的大小比较氧化剂或还原剂的相对强弱。φθ值越大,电对中氧化态的氧化能力越强,还原态的还原能力越弱;反之,φθ值越小,还原态的还原能力越强,氧化态的氧化能力越弱。
标态下:εθ=φθ正极-φθ负极 非标态下:ε=φ正极一φ负极
电池电动势与电池反应的吉布斯自由能变化
△rGm=W电=-zFε
若反应在标态下进行:△rGθm=-zFεθ
3.影响电极电势的因素
3.1电对物质本身浓度(或分压)对电极电势的影响
0.0592Vcra(氧化态) 能斯特方程式 ????lgbncr(还原态)θ
能斯特方程式表明了参与电极反应的各物质的相对浓度(气体用相对分压)及反应的温度对电极电势的影响。
3.2溶液酸度对电极电势的影响
2
能斯特方程表明,如果电极反应中有H+或OH参与时,可以通过调节溶液的pH改变电极电势。
3.3沉淀(或配合物)的生成对电极电势的影响
能斯特方程表明,向电极反应中加入沉淀剂或配位剂,通过沉淀反应或配位反应改变电极反应中物质的浓度,从而电极电势也将发生改变。
总之,对电极反应,凡降低氧化态(或增大还原态)浓度,φ将减小;反之,凡增大氧化态(或降低还原态)浓度,φ将增大。对电池反应,增大反应物浓度,ε将增大,增大生-成物浓度,ε将减小。
4.电极电势的应用
4.1判断氧化剂及还原剂的相对强弱
电极电势的大小反映了电极中氧化态物质和还原态物质在水溶液中氧化还原能力的相对强弱。
4.2判断氧化还原反应的方向
氧化还原反应系统吉布斯自由能的减少等于系统对环境做的最大电功
?rGm = -W电=-zFε
式中:F 是法拉第常数,其值为96500C?mol-1;z是电池反应中电子转移的计量数。
当?rGm<0时,则ε>0,即φ(+)>φ(-) ,电池反应能正向自发进行;
当?rGm>0时,则ε<0,即φ(+)<φ(-) ,电池反应能逆向自发进行;
当?rGm= 0时,则ε = 0,即φ(+)= φ(-) ,电池反应处于平衡状态。
如果电池反应中的各物质均处于标准状态时,?rGmθ= -zFεθ
这时反应自发的判据应为:
当?rGmθ<0时,则εθ>0,即φθ(+)>φθ(-) ,电池反应能正向自发进行;
当? rGmθ>0时,则εθ<0,即φθ(+)<φθ(-) ,电池反应能逆向自发进行;
当? rGmθ= 0时,则εθ= 0,即φθ(+)=φθ(-) ,电池反应处于平衡状态。
4. 3判断氧化还原反应进行次序
当溶液中存在多种氧化剂,它们都能与同一种还原剂作用,若不考虑反应速率的因素时,原则上氧化性最强的氧化剂首先被还原。也就是电极电势值最大的先被还原。即两电对电极电势相差最大的先反应。
4.4判断氧化还原反应进行的程度
化学反应进行的程度是用标准平衡常数来衡量的。根据反应的标准摩尔吉布斯自由能变?rGθm与标准平衡常数Kθ的关系,推导出氧化还原反应的标准平衡常数与标准电动势εθ之
z?θ
间的关系。 IgK = 0.0592Vθ
上式表明,在一定温度下,标准平衡常数Kθ的大小取决于电池标准电动势εθ及电池反应中电子的转移的化学计量系数z。电池标准电动势εθ越大,标准平衡常数Kθ也就越大,反应进行得越完全。
4.5元素的标准电极电势图及其应用
4.5.1 元素电势图
为了方便比较各种氧化数状态物质的氧化还原能力及它们之间的相互关系,通常将元素的各种氧化数状态,按由高到低的顺序从左到右依次排列,然后在每对氧化还原电对之间标出相 3
应的标准电极电势值,这时所得到的图形,称为“元素的标准电极电势图”(简称元素电势图)。
4.5.2 电势图的应用
(1) 判断歧化反应能否发生
歧化反应发生条件:φθ右>φθ左
(2)计算电对的标准电极电势 n1??(1)?n2??(2)????ni??(i) ??n?n?n1?n2????ni
三、 典型例题
【例5.1】 配平离子方程
(1)Cr2O72-+ H2SO3→Cr3++HSO4- (酸性溶液)
(2)CrO42-+ SO32-→Cr(OH)4-+SO42- (碱性溶液)
【解】(1)Cr2O72-+ H2SO3→Cr3++HSO4-
氧化数改变:Cr (+3)-(+6)=-3
S (+6)-(+4)=+2
得失电子最小公倍数为6,1、3即反应物化学计量数:
Cr2O72-+ 3H2SO3→2Cr3++3HSO4-
酸介质中,左边O多4个加H+,右边加4 H2O
电荷配平: Cr2O72-+ 3H2SO3+5H+ = 2Cr3++3HSO4-+4H2O
注意:对离子反应,除了质量守恒还要电荷守恒,可通过调节H+或OH-来完成。
(2)CrO42-+ SO32-→Cr(OH)4- + SO42-
氧化数改变:Cr (+3)-(+6)=-3
S (+6)-(+4)=+2
得失电子最小公倍数为6,2、3即反应物化学计量数:
2CrO42-+ 3SO32-→2Cr(OH)4- + 3SO42-
碱介质中,左边O少加H2O ,右边加OH-
电荷配平:2CrO42-+ 3SO32- +5H2O=2Cr(OH)4-+3SO42- +2OH-
L): 【例5.2】 根据下列氧化还原反应设计原电池,写出电池符号(各离子浓度均为1mol?
(1) 2Ag(aq)+Cu===2Ag+Cu(aq)
+3+2+(2) 6Fe2+(aq)+Cr2O3-
7(aq)+14H(aq)===6Fe(aq)+2Cr(aq)+7H2O +2+-1
【解】⑴ Cu∣Cu2+(1.0mol﹒L-1)‖Ag+(1.0 mol﹒L-1)︱Ag
⑵ Pt∣Fe2+(1.0mol﹒L-1),Fe3+(1.0mol﹒
4
2?L-1)‖Cr2O7(1.0mol?L-1),Cr3?(1.0mol?L?1),H+(1.0mol?L?1)︱Pt
【例5.3】将下列电池符号写成电池反应。
(1)(-)PtI2,I-H2O,H+O2,Pt(+)
(2)(-)PbPb2+Sn4+,Sn2+Pt(+)
2- (3)(-)CuCu2+Cr2O7,Cr3+Pt(+)
【解】(1)由电池符号电极半反应
+正极:O2+4H+4eH2O
负极:(2I-I2+ 2e)×2
两式相加得电池反应:O2 + 4I- + 4H+ = 2I2 + 2H2O
同理:
(2)Pb + Sn4+ = Sn2+ + Pb2+
(3)Cr2O72- + 3Cu + l4H+ = 2Cr3+ +3Cu2+ + 7H2O
2-【例5.4】已知298.15 K时,c(Cr2O7L,计算⑴ )=1.0mol?L-1,c(Cr)=1.0mol?
2-pH=5.0;⑵ c(H)=10mol?L时Cr2O7/Cr3+电极的电极电势。
2-+【解】 Cr aq)+7HOq)+6e3+2Cr2(2O7(aq)+14H(a?
2-?Θ(Cr2O7/Cr3+)=1.232 V +-13+-1
(1)pH=5.0时,c(H)=1.0?10mol?L
2-Θ+Θ????c(CrO)/c?c(H)/c0.059227???? 2-3+Θ2-?(Cr2O7/Cr)??(Cr2O7)?lg3+Θ26??c(Cr)/c??14+-5-1
?1.232?0.0592lg(1.0?10?5)14 6
?1.232V?0.691V
?0.541V
(2) c(H)=10mol?L
2-Θ+Θ????c(CrO)/c?c(H)/c0.059227 2-3+Θ2-3+?(Cr2O7/Cr)??(Cr2O7/Cr)?lg23+Θ6??c(Cr)/c??14+-1
?1.232V?0.0592Vlg1014?1.37V 6
5
【例5.5】已知电对H3AsO3+H2O?H3AsO4+2H??2e,?Θ?0.560V;电对
?3I??I3?2e, ?Θ?0.536V。计算下列反应的平衡常数:H3AsO3(aq)+I3-+H2O=H3AsO4+I-+2H+,并判断⑴ pH=7.0;⑵ 溶液的c(H+)=6 mol·L-1时,其他物质均处于标准条件下反应的自发方向。 【解】?Θ??Θ(I2I-)??Θ(H3AsO4H3AsO3)?0.536V?0.560V??0.024V
n?Θ2?(?0.024)lgK????0.814,KΘ?0.153; 0.05920.0592Θ
⑴
c(H?)?10?7mol?L?1
?(H3AsO4H3AsO3)??Θ?
0.0592lg(cH?/c?)2?0.560?0.0592lg10?7?0.1456V2
则:?Θ(I2I-)??(H3AsO4H3AsO3),所以反应正向进行;
(2)c(H?)?6mol?L?1
?(H3AsO4H3AsO3)??Θ?0.0592lgc2(H?)?0.560?0.0592lg6?0.606V 2
则:?Θ(I2I-)??(H3AsO4H3AsO3),反应逆向进行。
【例5.6】判断在酸性水溶液中下列等浓度的离子能否共存? Sn2+和Hg2+, Fe2+和Cr2O72-
【解】(1)查表,Sn2+和Hg2+
Hg2+ + 2e
Sn4+ +2e Hg Sn2+ ?Θ=0.851V ?Θ=0.15V
εθ=0.851V-0.15V=0.701V>0
故 可发生下列反应 Hg2+ + Sn2+Hg + Sn4+ ∴ 不能共存。
(2)查表:Fe2+和Cr2O72-
Cr2O72- + l4H+ + 6e2Cr3+ + 7H2O Eθ=1.33V Fe3+ +2eFe2+ Eθ=0.77V εθ=0.56V>0
可有反应 Cr2O72- + 6 Fe2+ + l4H+2Cr3+ + 6 Fe3+ + 7H2O ∴Fe2+和Cr2O72- 不能共存
6
【例5.7】已知反应Fe2+(aq)+Ag+(aq)===Ag(s)+Fe3+(aq)
(1) 判断298.15 K时,c(Ag+)=0.01mol?L-1,c(Fe2+)=1mol?L-1,c(Fe3+)=0.1mol?L-1时反应的方向。
(2) 若在该电池的负极加入氨水,电池的电动势将怎样变化(定性回答)?
K。 (3) 求出此原电池的?rGm、?rGΘ
m及
【解】(1)Θ?(Ag+?0.7996?0.0592lg0.01?0.6812V
<?(Fe3+Fe)?0.771?0.0592lg0.1?0.7118V2+,反应逆向进行;
即发生:Fe3++Ag=Ag++Fe2+
(2)电动势将增大。
(3)?rGm??nF???96500?(0.7118?0.6812)kJ?mol-1??2.953kJ?mol-1,
Θ-1-1, ?rGΘ??nF???96500?(0.771?0.7996)kJ?mol?2.760kJ?molm
n?Θ0.771?0.7996lgK????0.483,KΘ?0.329; 0.05920.0592Θ
【例5.8】求25℃时PbSO4(s)的Kθsp。
【解】由题意有 PbSO4(s)Pb2+ + SO42-
将反应分解为两个半反应并查表得
正极反应为 PbSO4(s)+ 2e
负极反应为 Pb2+ + 2e
电池反应为 PbSO4(s)
由式 lgKθ?Pb (s) + SO42- ?=-0.358V ΘPb (s) Pb2+ + SO42- ?Θ=-0.126V n2?θ?(?0.232)=-7.838 0.05920.0592
-解得Kθ=1.45×108,即PbSO4(s)的Kθsp值。
Θ+Θ【例5.9】已知?(Ag/Ag)=0.7996 V,KSP(AgI)=8.52?10-17,判断标准状态下
Ag是否能从HI的溶液中置换氢气。
【解】 ?Θ(AgIAg)??Θ(Ag+?0.0592lgKΘsp(AgI)
?0.7996?0.0592lg(8.52?10?17)??0.1517V
?Θ(AgIAg)??Θ(H+2),Ag可以从HI溶液中置换出H2: 2Ag +2H++2I-= 2AgI+H2(g)
7
【例5.10】根据元素电势图 BrO-
3?ΘBr21.066VBr-
0.61V
(1)计算?Θ值; (2)判断Br2能否稳定存在?
?-【解】(1)0.61?6?5?Θ(BrO3Br2)?1.066,?Θ(BrO3Br2)?0.519V,
⑵ ?Θ(右)??Θ(左),所以Br2不能稳定存在。
8
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…
-
实验九 氧化还原与电化学
无机实验报告实验九氧化还原与电化学一、电极电势与氧化还原反应方向结论:(MnO4/Mn2+)(Fe3/Fe2+)(I2/I-)(S…
-
氧化还原反应和电化学的实验步骤
步骤1原电池的组成和电动势的粗略测定在一只井穴皿的123位置分别倒入约12容积的01MolL现象解释结论及方程式21CuCu22C…
-
实验17 氧化还原反应和电化学
实验17氧化还原反应和电化学一实验目的1了解电极电势与氧化还原反应的关系2试验并掌握浓度和酸度对电极电势的影响二实验原理原电池是将…
-
课题_氧化还原反应实验报告
一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化对电极电势的影响3进…
-
第六周化学实验报告电位法测定电池电动势及浓度对电极电位的影响
华南农业大学实验报告专业班次11农学班一组别20xx30010110题目电位法测定电池电动势及浓度对电极电位的影响姓名梁志雄日期一…
-
大学实验化学 氧化还原反应与电极电位
难题解析TOP例81写出并配平下列各电池的电极反应电池反应注明电极的种类1AgsAgClsHClslnCl2100kpPts2Pb…
-
氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要1基本要求TOP11掌握离子电子法配平氧化还原反应式计算元素氧化值…
-
第八章 氧化还原反应与电极电位(大纲)
第八章111基本要求TOP氧化还原反应与电极电位掌握离子电子法配平氧化还原反应式电池组成式的书写根据标准电极电位判断氧化还原反应方…
-
教学指导--氧化还原反应与电极电位
第八章首页基本要求氧化还原反应与电极电位重点难点讲授学时内容提要111基本要求TOP掌握离子电子法配平氧化还原反应式电池组成式的书…
-
氧化还原反应实验报告
实验十二氧化还原反应一实验目的1理解电极电势与氧化还原反应的关系和介质浓度对氧化还原反应的影响2加深理解氧化态或还原态物质浓度变化…