化工合成氨生产实习报告
二.武汉有机实业股份有限公司介绍
武汉有机实业有限公司是国际领先的食品防腐、保鲜、抗氧化的专业公司,运用科技、创新以及人的力量,不断推动人类和动物营养保健的进步。公司将安全、环保、健康的理念贯穿于有机合成与创新,致力于服务全球食品保鲜、制药、染料、制革、国防、橡胶和石油开采等高速发展的终端市场,努力为客户创造解决方案,从而赋予、保证和提高其产品性能。公司在生产经营活动中始终关注经济效益,环境保护和社会责任三方面的和谐发展,以其领先的食品防腐、保鲜和抗氧化等业务,为全球超过100个国家和地区的客户提供种类繁多的产品及服务。
公司始建于19xx年,是一家具有五十多年生产历史,集科、工、贸为一体,专业生产经营有机精细化工产品的国家大型二类化工企业,主要产品有芳烃氧化、氯化、氨化、高分子材料和其他精细化工产品共五大系列100多个品种。公司是国内最为悠久的食品添加剂生产经营企业之一,是中国食品添加剂工业发展的先驱之一,是国家食品添加剂苯甲酸钠标准的起草单位,全国食品添加剂协会常务理事单位,是湖北省和武汉市高新技术企业 ,国家火炬计划武汉新材料产业基地骨干企业,武汉市100强企业。公司多次荣获全国石化行业优秀民营企业、湖北省优秀企业、武汉市诚信示范企业等荣誉称号。
其主导产品苯甲酸钠19xx年获国家最高奖-银质奖,苯甲酸钠、氯化苄和苯甲醇多次被评为湖北及武汉市名牌产品。公司19xx年获自营出口权,主要产品苯甲酸钠、苯甲酸、氯化苄在国内外久负盛名,主导产品苯甲酸钠不仅覆盖全国,还出口到世界各地,生产能力和市场占有率居世界第一,工艺技术、产品质量保持国内领先,国际先进水平。
经过多年的发展与调整,目前公司产品结构日趋合理,形成了以甲苯氧化、甲苯氯化为主体,二甲苯氧化、氯化以及丙烯氧化等为新的增长点的快速发展局面。同时注重了产品技术含量的提高,注重了产品向纵深的拓展,注重了向国际化及高附加值产品发展的步伐,注重了与国际大公司的交流与合作,在副产物二次利用方面取得了较好的成效。目前,从苯甲酸副产物生产苯甲酸苄酯及苯甲醛以及副产物资源综合利用衍生开发出来的新工艺生产苯甲腈、苯代三聚氰胺,整个产业链从工艺到市场日趋成熟,为公司开辟了新的利润增长点。
作为食品添加剂的资深传统生产企业,公司在食品防腐、保鲜、抗氧化行业中一直发挥领军作用,其工艺技术一直与世界领先的技术水平同步,占据了国内防腐剂苯甲酸盐类70%以上、全球35%左右的市场份额,为食品安全和民族工业的发展做出了巨大的贡献。目前,公司的苯甲酸酯类产品已经拥有全球70%的苯甲酸酯类增塑剂的市场份额,并且建立了绝对的竞争优势和市场进入壁垒,公司的苯甲酸及其钠盐在食品、工业、饲料及医药领域实现了全方位的市场应用。
公司成立至今,秉承着精益求精,做好小事的企业精神,坚持早走一步,多走一步,快走一步的发展战略,坚持以市场为导向,积极倡导安全、环保、健康理念,科学决策,诚信经营,规范管理,已形成产品结构合理,技术储备和开发能力增强,营销网络覆盖全国,辐射全球的发展格局。
三.实习内容
(一)氨合成
1 氨的性质和用途
⑴物理性质
无色、有毒、刺激性气味,易溶于水、易被液化、密度比空气轻(常温常压)
⑵化学性质
氨与酸反应生成盐类,是制造氮肥的基本反应:
2NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3
氨与二氧化碳作用生成氨基甲酸氨,进一步脱水生成尿素:
2NH3+CO2=COONH2NH4 COONH2NH4=CO(NH2)2+H2O
氨与氧作用生成一氧化氮,并能进一步与水作用,制得硝酸:4NH3+3O2=6H2O+2N2
2.用途:在国民经济中,氨占有重要的地位,特别是对农业生产有着重大意义。氨主要是用制造化肥。液氨可以直接用做肥料,它的加工产品有尿素、硝酸氨、氯化氨和碳酸氢氨以及磷酸铵、氮磷钾混合肥等。
氨也是非常重要的工业原料,在化学纤维、塑料工业中,则以氨、硝酸和尿素作为氮元素的来源生产以内酰氨、尼龙-6、丙烯氰等单体和尿醛树脂等产品。由氨制成的硝酸是各种炸药的基本原料,如三硝基甲苯,硝化甘油以及其他各种炸药。硝酸氨既是优良的化肥, 又是安全的炸药,在矿山开发等基本建设中广泛应用。
氨在其他工业中的应用也非常的广泛。在石油炼制、橡胶工业、制金工业和机械加工等部门以及轻工、食品、医药、等工业部门中,氨及其加工产品都是不可缺少的。例如制冷、空调、食品、冷藏系统大多数都是用按叫作为制冷剂。
2合成氨工业的发展及特点
近年来,氨合成工艺技术已取得长足进步。特别是市场经济体制的建立,各氮肥企业为了在市场竞争中走在前列,纷纷围绕节能降耗,加大技改力度,为氨合成技术的新发展提供了一个平台。在此形势下,各企业对氨合成装置的要求,逐渐由以前的强化高负荷生产转变到现在的轻负荷低消耗运行模式上来。因此氨合成的关键设备合成塔,在同等规模条件下,也逐渐的被大塔取代,出现了“大马拉小车”的局面。伴随着大直径塔的使用,氨合成系统工艺运行条件发生了变化。低温低压氨合成催化剂的应用,也是企业节能降耗可行途径之
一。大直径塔及低温低压催化剂的使用,加大了企业的设备投入。企业势必采取各种措施保持装置长周期运行,以求得更多的有效生产时间。因此,原料气的净化度高,避免催化剂中毒,至关重要。积极使用原料气净化新技术,实现原料气微量(CO+CO2)趋近于“零”,避免铜液、油水入塔,最大限度的减少毒物对催化剂的影响将会被人们逐渐重视。
氮对植物生长的作用很早就已了解。空气中氮占78%,但是,除豆科植物外,空气中的氮不能被固定、吸收。1898年,利用炭化钙吸收氮制氨获得成功,19xx年建成工厂。19xx年又实现了在催化剂存在下,氮和氢直接合成氨,并于19xx年建成日产30吨的装置,此后,直接合成氨的方法发展迅速,而利用碳化钙的方法因成本高在30年代被淘汰。几十年来,合成氨在技术上发生了很大变化. 一是生产原料由煤转向气态的天然气和液态的石油产品(合称烃类原料),大型厂绝大多数采用烃类原料,以煤为原料仅在中国和德国有应用。 二是装置大型化,60年代日产500吨氨,近20年来,新建装置大部分为日产1000~1500吨。由于高压设备、离心式压缩机及生产控制系统的成功使用,生产装置的规模得以大型化,从而使合成氨的原材料和能量消耗下降。19xx年,世界合成氨的产量为8930万吨,19xx年我国为2765万吨。
3合成氨工艺
3.1合成氨原料
以煤为原料和燃料,在铁锰脱硫剂和氧化锌脱硫剂的作用下,将煤中的无机硫和有机硫脱除到0.5ppm以下,配入一定量的水蒸汽和空气分别在一、二段转化触媒和一定温度条件下将甲烷转化为氢气,制取合成氨所需的氢气和氮气,在一定的温度和变换触媒的催化作用下,使CO变换成CO2和H2,为尿素车间提供富余的中间蒸汽,同时净化碳化气体中残余的CO2和CO,为后工段输出合格的原料气和净化气(其中CO和CO2的含量<25ppm)。
3.2脱硫
不论是用煤、天然气或别的原料气中,都含有一定量的硫化物主要包括两大类:无机硫(H2S)有机硫(C2S)硫醇(RSH)等。硫化物的存在不仅能腐蚀设备和管道而且能使合成氨生产所用的催化剂中毒。此外,硫是一种重要的化工原料,应当予以回收
从原料气压缩机一段缸出来的天然气在压缩机段间冷却器137-C与冷却水进行换热。从原料气压缩机出口出来的混合气进入一段转化炉101-B的对流段,被预热约399?C,接着进入加氢器102D,在加氢器中有机硫化合物被氢化,生成硫化氢。在加氢器中,基本上所有的有机硫都变成硫化氢。接着气体再进入氧化锌脱硫槽108-DA/DB,每一个脱硫槽内装有21m3的条状氧化锌脱硫剂,气体中的硫化氢与氧化锌反应而被氧化锌所吸附。 脱硫的最好方法是在过量氢气存在的情况下,将这硫化物催化转化成硫化氢然后再使硫化氢与氧化锌反应达到脱除的目的。以焦炉煤气为原料,压缩至2.1 MPa后进入精脱硫装置,将气体中的总硫脱至0.1 ppm以下.焦炉气中甲烷含量达22.4%,采用纯氧催化部分氧化转化工艺,将气体中甲烷及少量多碳烃转化为合成甲醇用的一氧化碳和氢;经压缩进入甲醇合成装置.甲醇合成采用5.3 MPa低压合成技术,精馏采用3塔流程
天然气加氢转化处理就是在有钴、钼催化剂尊在的条件下,与加入的氢气进行转化反应,主要化学反应如下:
R?SH?H2?RH?H2S
R?S?R??2H2?RH?R?H?H2S
R?S?S?R??3H2?RH?R?H?2H2S
C4H4S?4H2?n?C4H10?H2S
COS?H2?CO?H2S
CS2?4H2?CH4?2H2S
用氧化锌做脱硫剂,在一定条件下,它能迅速脱硫,由于氧化锌脱硫剂使用后不能用简单方法再生,因此只运用于低浓度硫的脱除,并作为最后一级脱硫。主要化学反应如下:
H2S?ZnO?H2O(汽)?ZnS
脱硫后的原料气在镍催化剂作用下进行反应以制取合成氨所用的原料气。
主要反应式如下:
CH4?H2O?g??CO?H2
CO?H2O?CO2?H2
转化工序分为两段进行,在一段转化炉里,烃类和水蒸气在反应管内的镍触媒上反应,由管外供给热量。
出口气体残余甲烷浓度约为8~13%,一段氧化后的气体进入二段转化炉,在那里加入空气燃烧放热,又继续进行转化反应。二段炉出口温度在810~870℃之间,经二段转化后可使粗原料气达到反应标准。
氢氮比(分子比):2.8~3.1 残余甲烷(干基):0.3~0.6%
转化气中的H2与空气中的O2发生燃烧反应:
H2 + 1/2O2 = H2O + 241.16KJ
在二段炉内除氢气外一氧化碳和甲烷也能燃烧,但H2燃烧反应的速度比其它可燃气体
快3~4倍,所以在二段炉内催化剂上部的非催化剂空间里,首先是空气中的氧与一段转化气中的氢气进行燃烧,故大量的热用于转化气中的残余甲烷的继续转化
出二段炉原料气中含有大量的CO,变换工序就是使CO在催化剂的作用下与水蒸气反应生成CO2和H2.既除去对后段工序有害的CO,又能制得尿素原料之一的CO2。反应式为:
CO + H2O(g) → CO2 + H2 + 9.8KJ/mol
这是一个等体积、可逆、放热反应,降低温度和提高蒸汽浓度均有利于变换反应的进行。催化剂是铁铬系催化剂,还原后具有催化活性的是Fe3O4,低变采用铜锌系催化剂,还原后具有活性的是Cu。中变在360℃~380℃,在催化剂的作用下,反应速度很快,中变炉出口CO≤3.0%,然后通过换热降温到180℃左右,在低变催化剂的作用下,工艺中的CO含量进一步降到≤0.3%,以满足甲烷化对CO含量的要求。
经过中、低变换和碳化、脱碳的气体尚含有少量的CO2和CO,这些气体会使合成氨触媒中毒丧失活性,所以在送往合成前必须对原料气作进一步净化处理。即将碳化气中残余的CO2和CO与原料气中的H2,在一定温度和镍触媒催化作用下反应生成对合成氨无害的气体甲烷。
以上反应有以下特点:
1、反应是强放热反应,每0.1%CO、CO2、O(所造成的温升分别为:CO7.4℃,2体积含量)
CO26.1℃,O216.5℃;
2、反应是体积缩小的反应,因此,提高压力向正方向进行
3.3脱除二氧化碳
MDEA(N-Methyldiethanolamine) 即N-甲基二乙醇胺,分子式为:
CH3?N(CH2CH2OH)2分子量119.2,沸点246℃-248℃,闪点260℃,凝固点-21℃,汽化潜热519.16KJ/Kg,能与水和醇混溶,微溶于醚。在一定条件下,对二氧化碳等酸性气体有很强的吸收能力,而且反应热小,解吸温度低,化学性质稳定,无毒不降解。纯MDEA溶液与CO2不发生反应,但其水溶液与CO2可按下式反应:
?CO2?H2O?H??HCO3①
H??R2CH3N?R2CH3NH?②
式①受液膜控制,反应速率极慢,式②则为瞬间可逆反应,因此式①为MDEA吸收CO2的控制步骤,为加快吸收速率,在MDEA溶液中加入1%-5%的活化剂DEA(
'R2NH)后,反应按下式进行:
''R2NH?CO2?R2NCOOH③
''''?R2NCOOH?R2NCH3?H2O?R2NH?R2CH3NH?HCO3 ④
③+④:
''?R2NCH3?CO2?H2O?R2CH3NH?HCO3⑤
由式③-⑤可知,活化剂吸收了CO2,向液相传递CO2,大大加快了反应速度,而MDEA又被再生。
脱碳工艺流程图
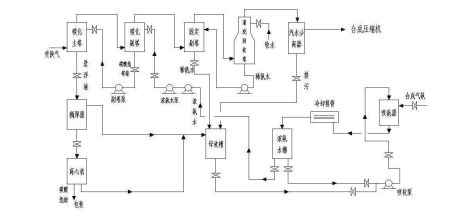
3.4氨的合成:
1、分流进塔:反应气分成两部分进塔,一部分经塔外换热器预热,依次进入塔内换热管、中心管,送到催化剂第一床层,另一部分经环隙直接进入冷管束,两部分气体在菱形分布器内汇合,继续反应,这样使低温未反应气直接竟如冷管束,稍加热后,作为一、二段间的冷激气,从而减少冷管面积和占用空间,提高了催化剂筐的有效容积,并强化了床层温度的可调性。同时仅有65~70%的冷气进入塔内换热器和中心管,减轻了换热器负荷,因而减少了换热面积,相对增加了有效的高压容积,也使出塔反应气温度提高
(310~340℃),即回收热品位提高。气体分流进塔还使塔阻力和系统阻力比传流程小。
2、进塔外换热器的冷气不经环隙,这样温度更低,使进水冷器的合成气温度更低(约75℃左右),提高了合成反应热的利用率,降低了水冷器的负荷和冷却水的消耗。
3、水冷后的合成气直接进入冷交管间,由上而下边冷凝边分离,液氨在重力和离心力的作用下分离,既提高了分离效果,又减小了阻力。
4、塔后放空置于水冷、冷交后,气体经连续冷却,冷凝量多,因此气体中氨含量低,惰气含量高,故放空量少,降低了原料气消耗。
5、塔前补压:循环机设于冷交之后,气体直接进塔,使合成反应处于系统压力最高点,有利于反应,同时循环机压缩的温升不消耗冷量,降低了冷冻能耗。
6、设备选用结构合理,使消耗低,运行平稳,检修量减少,工艺趋于完善。
7、选用先进的自控手段,如两级放氨,氨冷加氨,废锅加水,系统近路的控制,均用了DCS计算机集散系统自动化控制,冷交、氨分用液位检测采用国内近几年问世的电容式液位传感器等新技术使操作更加灵活、平稳、可靠,降低了操作强度。
合成氨工艺流程图
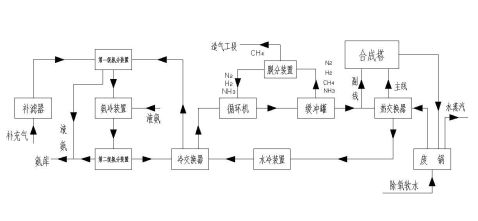
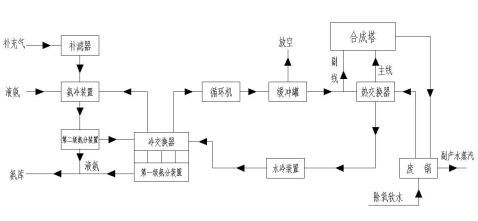
由合成车间液氨仓库经液氨升压泵加压后的原料液氨,压力大于20kg/cm2(表压),温度约<20?C直接送入尿素生产车间27米楼面的液氨过滤器,进入液氨缓冲槽原料室。
来自一段循环系统冷凝器回收的液氨,自氨冷凝器A、B流入液氨缓冲槽的回流室,其中一部分液氨正常为60%,作为一段吸收塔回流液氨用,而其余液氨经过液氨缓冲槽的
中部溢流隔板,进入原料室与新鲜原料液氨混合后一起至高压氨泵,这样可使液氨保持较低的温度以减少高压氨泵进口氨气化。氨缓冲槽压力维持在17kg/cm2左右,设置在高为23米平面上,是为了具有足够的压头,使液氨回流进入一段吸收塔,同时也为了保证高压氨泵所需要的吸入压头。氨缓冲槽原料室的液氨,进入高压氨泵(单动卧式三联柱塞泵、打液能力为每台24M3/hr,反复次数180次/分、电动机250KW、三台高压氨泵一台备用)将液氨加压
二)苯甲酸合成 1苯甲酸的性质及用途
苯甲酸为无色、无味片状晶体。 熔点 122.13℃,沸点249℃,相对密度1.2659(15/4℃)。在100℃时迅速升华,它的蒸气有很强的刺激性 ,吸入后易引起咳嗽 。 微溶于水,易溶于乙醇、乙醚等有机溶剂。苯甲酸是弱酸,比脂肪酸强。它们的化学性质相似,都能形成盐、酯 、酰卤、 酰胺、酸酐等,都不易被氧化。苯甲酸的苯环上可发生亲电取代反应,主要得到间位取代产物。
最初苯甲酸是由安息香胶干馏或碱水水解制得,也可由马尿酸水解制得。工业上苯甲酸是在钴、锰等催化剂存在下用空气氧化甲苯制得;或由邻苯二甲酸酐水解脱羧制得。苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其他食品的抑菌剂,也可作染色和印色的媒染剂。
中文名称: 苯甲酸
英文名称: benzoic acid
中文名称2: 安息香酸
英文名称2: carboxybenzene
分子式: C7H6O2
分子量: 136
外观与性状: 鳞片状或针状结晶, 具有苯或甲醛的臭味。
熔点(℃): 121.7
沸点(℃): 249.2
相对密度(水=1): 1.27
相对蒸气密度(空气=1): 4.21
饱和蒸气压(kPa): 0.13(96℃)
闪点(℃): 121
引燃温度(℃): 571
爆炸下限%(V/V): 11
溶解性: 微溶于水,溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳。
主要用途:用作制药和染料的中间体, 用于制取增塑剂和香料等, 也作为钢铁设备的防锈剂。
健康危害:对皮肤有轻度刺激性。蒸气对上呼吸道、眼和皮肤产生刺激。本品在一般情况下接触无明显的危害性。
环境危害:对环境有危害,对水体和大气可造成污染。
燃爆危险:本品可燃,具刺激性。
危险特性:遇明火、高热可燃。
2.苯甲酸合成工艺的发展及特点
苯甲酸于16世纪被发现。1556年,法国预言家诺斯特拉达姆士(Nostradamus)最早描述安息香胶的干馏作用;后由Alexius Pedemontanus和布莱斯德破译分别于1560年和1596年发现。在1875年,Salkowski发现苯甲酸的抗真菌药力,于是苯甲酸用于长期保存云莓。
目前工业上苯甲酸主要是通过甲苯的液相空气氧化制取的。过程是以环烷酸钴为催化剂,在反应温度为140-160℃和操作压力0.2-0.3MPa下反应生成苯甲酸。反应后蒸去甲苯,并减压蒸馏、重结晶,即得产品。该工艺利用廉价原料,收率高,因此是工业上主要使用的方法。
历史上的制备法:首个涉及水中三氯甲苯与氢氧化钙反应的工业程序,使用铁或三氯化铁为催化剂。生成苯甲酸钙与盐酸反应即可转化为苯甲酸。该产品含有大量的氯苯甲酸衍生物。为此,供人使用的苯甲酸要由干馏安息香胶取得;即使发现其他的合成方法后,仍然禁止使用除干馏安息香胶制备法外的苯甲酸其他制法。烷基取代苯衍生给出苯甲酸。苯甲酸也可以由干馏或用碱水水解安息香胶,苯甲醛发生坎尼扎罗反应歧化,或马尿酸水解而得。二十一世纪,着重有机、天然面向,化学制成的苯甲酸逐渐被莓果类天然成份取代。
3.苯甲酸的生产工艺
合成原料:氧气和甲苯
生产工艺:
通过氧气与甲苯在催化剂的催化和一定温度和压力下发生自由基氧化反应制备苯甲酸,机理如下:
链引发:
3
CH2+OOHO2
CH2OOH
+CH2Co2++OH-+Co3+
CH2+OOHCo3+CHOO
+Co2++H+
链增长:
3
CH2OO
+2CH2OOH+
2
CH2OO
+
O2
链终止:
CH2
OOH
+
CH2Co2+
+
OH-
+
Co3+
CH2+
CHO
OH-O
+
H2O
CHO
+
C
Co3+
+
Co2+
+
H+
OC
+
OO2
O+
O
CHO
OOH
+
OC
OOH
+
CHO
2
COOH
副反应:
CH3
CH2+
2
CH2OH
+
CH2+
CHO
OH-+
H2O
O
COOH
+
CH2OH
O
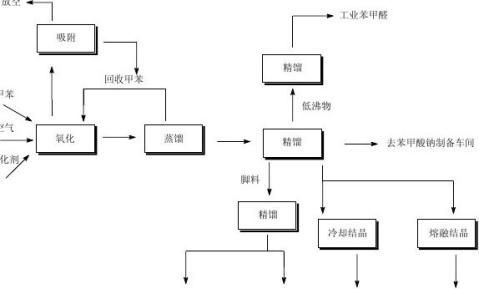
具体的工艺流程如下:
粗苯甲酸苄酯
工业苯甲酸食品级或药用级苯甲酸

四.实习心得体会
通过为期一天的实习,我觉得我的收获还是比较多的。收获的不仅仅是在专业知识上进行习,更多的还是对今后的实际的工作及环境的一个深刻的认识。
当我们下了车踏入武汉有机实业厂区的时候,我环顾四周,厂区的建筑坐落有序,厂房林立整齐,在厂房的周围,是排列有序的高大乔木,在厂房的另一侧的食堂的门前点缀
着高矮一致的灌木,总得来说绿化做得十分的好。登上综合楼听合成工艺的时候,可以隐约闻到某些刺鼻的气味,这是每个化工厂必不可少的元素之一吧。听厂里的工作人员介绍合成工艺与我们互动的时候,我突然发现,自己的基础知识是极其的不牢固,讲授的工作人员随便问一个问题,坐在下面倾听的我们都鸦雀无声,打不上来。在听完工艺介绍之后,我独自思量自己的专业素养还有待提高,基础知识更是要夯实好。开工厂坐研究工艺开发产品这些活可不比实验室做实验,原料,生产率,环境污染,利润,成本等等。这些东西都需要潜心研究,一个传统经典的工艺往往是经过几代人的努力,呕心沥血所创造出来的结局。在实际生产中,原料的输送,反应条件的控制,产品的提纯等等都是要严格按照规定来不得有一丝马虎的。而这一切,都需要日复一日年复一年所积累的知识和平时学习中培养出来专业素养作为必要条件。下午在厂区实地参观。我们这个组去生产苯甲酸的车间参观。来到实地后,苯甲酸浓烈的刺激气味迎面而来,参观的学生无一不拿出纸巾捂住口鼻。而带我们参观的师傅却泰然自若,令我好生钦佩。一边是呛得几乎让人窒息的气味,一边是师傅比划着庞大繁杂的车间的各部位的讲解,虽说有的地方听的不明不白,不过我们还是坚持着听完讲解。在离开厂区的那一刹那,心中如释重负,却又犹如巨石压胸。因为外出呼吸到新鲜空气而放松,对日后的工作及工作环境感到压力巨大。坐在开回学习的大巴上,心中百感交集。短短一天的实习,不仅让我认识到自己专业知识的贫乏,同时还让我见识到现实工作的残酷。似乎到了今天,我才算弄明白这份专业具体是干什么怎么操作。这是一份十分严谨不能有半点懈怠的专业,从厂区到处贴的离上次发生事故有多少天的牌子就可以看出,搞生产搞工艺容不得半点马虎,记得之前在学校参观合成氨工艺的时候,教我们专业课的周老师说武汉有机的一个罐子爆炸,半个武汉市就没了。虽然是句玩笑话,但是失之毫厘谬之千里,细微的差错,也许会造成巨大的损失。这告诫了我们,在日后的学习及工作中,一定要严谨严谨再严谨。同时我得向那些在浓烈的刺激性气味中恪尽职守,坚持自己岗位的工作人员致敬。吃苦耐劳谁都会说,但是他们把这种坚忍不拔的精神演绎到淋漓尽致,绝对值得每一个人学习。总得来说,这次的实习具体的知识虽然学的不多,但是对自己的专业性的认识,以及把所学理论转化为实际应用的重要性,还有对自己的专业的那份敬业精神。都是值得我深思学习的。过多的感叹和体会再怎么说都是无力的,关键要落到实处。且看日后的行动吧。
参考资料:百度文库——合成氨工艺,《合成氨工艺(第2版)》吴玉萍主编
维基百科——苯甲酸,《化工进展》中苯甲酸的合成工艺。
-
生产实习报告范文
IE生产实习报告院系管理工程学院姓名方宗炼专业工业工程班级081班学号3080502101指导老师费志敏曹邦平梁艳叶逊王志国刘从虎…
-
生产实践实习实习报告
生产实践实习实习报告学科专业武器系统与工程弹药方向学生姓名张洪铭学号1101510340实习日期20xx年3月实习地点豫西工业集团…
-
大学生生产实习报告
生产实习报告学院专业年级姓名学号一概述实习目的生产实习是高等工科院校教学计划中的一个重要的实践性教学环节为了响应课本知识与实践相结…
-
一汽大众生产实习报告
姓名:吴彦民院系:广东机电职业技术学院机械工程系专业:数控技术一、实习目的............................…
-
生产实习报告
生产实习报告实习地点东风汽车公司湖北十堰实习时间学生姓名班级学号一生产实习内容每天的实习内容字数不应少于1000字要求字迹工整11…
-
合成氨仿真实习报告
氨合成仿真实习报告一实习目的及意义仿真实习是毕业实习计划的组成部分通过实习使学生了解化工生产一般特点规律和工艺参数的控制获得化工生…
-
NJUT合成氨仿真实习报告20xx.11
南京工业大学城市建设与安全工程学院仿真实习报告书AAAAAA1000000000安全工程系化学化工实验教学中心20xx年11月一实…
-
合成氨仿真实习报告
南京工业大学城建学院仿真实习报告书刘皓19xx090228安全工程系化学化工实验教学中心20xx年10月合成仿真实习报告30万吨合…
-
实习报告合成氨仿真
南京工业大学合成氨仿真实习报告书学院班级学号姓名签名20xx年11月1实习目的仿真实习是认识实习实习计划的组成部分通过实习使学生了…
-
合成氨仿真实习指导书_简_与实习报告[1]
南京工业大学化学化工学院仿真实习教学指导化学化工实验教学中心20xx年10月书仿真实习教学指导书一实习目的仿真实习是实习计划的组成…