药品生产过程质量风险评估报告模板
XXXX胶囊生产过程质量风险管理报告
质量风险管理号:QRM-
起草人: 起草日期: 年 月 日
审核人: 审核日期: 年 月 日
审核人: 审核日期: 年 月 日
批准人: 批准日期: 年 月 日
XXXX药业有限公司
目录
XXXX胶囊生产过程质量风险管理报告
1、简介
2、目的
3、范围
4、引用资料
5、风险管理小组组员及职责分工
6、质量风险管理流程
7、风险管理过程
8、风险管理总结及结论
9、风险管理回顾审核
XXXX胶囊生产过程质量风险管理报告
1.简介:
1.1产品概述:XXXX胶囊为以化学原料药XXXX和适量等辅料制成的化学药胶囊剂制剂,为耳鼻喉科及皮肤科用药类非处方药药品。用于缓解过敏性鼻炎有关的症状,如喷嚏、流涕、鼻痒、鼻塞以及眼部痒及灼烧感。口服药物后,鼻和眼部症状及体征得以迅速缓解。亦适用于缓解慢性荨麻疹、瘙痒性皮肤病及其他过敏性皮肤病的症状和体征。规格为10 毫克;贮藏:遮光,密闭保存;包装:铝塑泡罩包装。每板6粒,每盒1板;每板6粒,每盒2板;每板12粒,每盒1板,每板4粒,每盒1板。有效期:30个月。
1.2生产批量:35万粒,140万粒。
1.3主要生产工艺过程及参数:
1.3.1过筛:取XXXX、乳糖、硬脂酸镁及羟丙纤维素分别过100目筛。
1.3.2预混合:批量为35万粒用SYH-200型三维运动混合机进行,混合速度900转/分,混合时间20分钟;批量为140万粒的预混合和35万粒相同,但原辅料均分4等分进行4次混合。
1.3.3 粘合剂15%聚维酮K30的乙醇溶液的配制:按聚维酮K30:95%乙醇量=1.5:8.5(重量比)进行配置,溶解完全100目滤布过滤。
1.3.4制软材:上述预混合好的细粉,用GHL-250型高效混合制粒机中(每次35万粒量),设定混合I和切割I开动设备混合10分钟后,徐徐加入粘合剂(15%聚维酮K30的乙醇溶液),加完后继续混合3-4分钟,收集软材。
1.3.4制粒:用YK-160型摇摆式颗粒机制粒,筛网目数为 24目。
1.3.5干燥:湿颗粒用GFG-120型高效沸腾干燥机干燥,每次干燥量为35万粒胶囊的颗粒量,控制干燥温度为50℃~70℃,干燥时间20分钟。
1.3.6整粒:干燥好的颗粒用YK-160型摇摆式颗粒机整粒,筛网目数为 24目。
1.3.7总混:批量为35万粒的总混:用SYH-200型三维运动混合机进行,混合速度900转/分,混合时间20分钟;批量为140万粒的总混:用EYH-1000型二维运动混合机进行,混合时间35分钟(此设备无速度调节)。
1.3.8充填、抛光:根据对总混颗粒XXXX的含量、总颗粒量、规格计算胶囊充填量。用NJP-1200C-1型全自动胶囊充填机,二号胶囊充填模具,用二号空心胶囊进行充填,装量差异控制在充填量的±8%范围内,充填速度为800~1200粒/分。充填过程中,每20分钟检查一次装量。将充填好的胶囊用HTP-Ⅱ型胶囊、片剂抛光机抛光。
1.3.8铝塑泡罩包装:用DPP-138A型平板式铝塑泡罩包装机或DPP-250型平板铝塑泡罩包装机进行泡罩包装,同时产品冲印批号、有效期。按4粒/板、6粒/板或12粒/板泡罩规格采用相应的二号胶囊泡罩模具,上、下封温度约为120℃,热封温度为160℃。
1.3.9外包装:每盒一张说明书,每个盒子及纸箱均打印产品批号、生产日期、有效期,电子监管码?;按6粒/板×1板/盒×200盒/箱或12粒/板×1板/盒×200盒/箱或6粒/板×2板/盒×200盒/箱或4粒/板×1板/盒×200盒/箱的包装规格进行包装。
1.4中间产品的贮存要求:XXXX胶囊颗粒(总混后)用洁净塑料袋盛装,扎紧袋口置洁净的不锈钢桶中密闭,在口服制剂车间中间站贮存,贮存期:天;XXXX胶囊(内包前)用洁净塑料袋盛装,扎紧袋口置洁净的不锈钢桶中密闭,在口服制剂车间中间站贮存,贮存期:天;XXXX胶囊待包装半成品在口服制剂车间中间站或外包间暂存区暂存,贮存期:天。
1.5生产环境条件:整个生产过程中外包装工序在一般生产区,称量、筛粉、预混合、配粘合剂、制粒、干燥、整粒、总混、充填、抛光、铝塑泡罩包装工序D级洁净区。
XXXX胶囊作为公司的主要产品,自20##年正式生产以来,生产产品 批,产品均符合标准规定,未产生过质量事故,也发生过严重的毒副作用及不良反应。
2、目的:
2.1通过对XXXX胶囊生产过程质量风险管理,对其带来的质量风险进行有效控制,保证产品质量。
2.2为确定XXXX胶囊生产工艺、操作规程及生产过程涉及的厂房设施、设备等的确认和验证的范围和限度提供风险分析评估的参考依据。
3、范围:适用于XXXX胶囊生产过程质量风险管理。
4、引用资料:
4.1《药品生产质量管理规范》(2010版);《药品GMP指南》2011
4.2《质量风险管理规程》;
4.3相关的资料:《XXXX胶囊生产工艺规程》
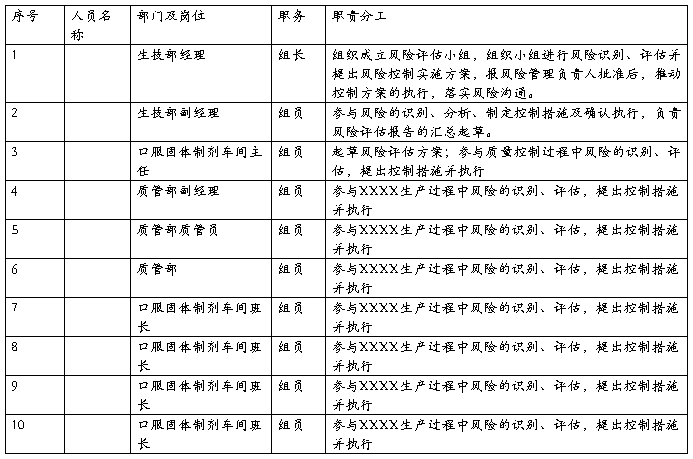
5、风险管理小组成员及职责分工
风险管理小组成员及职责分工表
6、质量风险管理流程:执行公司制定的《质量风险管理规程》
7、风险管理过程
7.1风险评估与控制
7.1.1使用的方法和工具:使用失效模式效果分析(FMEA)法进行
7.1.2风险的评估及控制措施
7.1.2.1风险识别:通过对该产品的整个生产过程所涉及到的人、机、料、法、环等各方面进行风险梳理识别。
7.1.2.2风险分析、评价及控制措施
(1)风险严重程度、发生几率、发现的可能性评分标准及风险级别评判标准及风险控制措施:见下表1. 表2. 表3.表4.
表1.严重程度

表中的“顾客”一词,可以是内部顾客,例如一下工序,也可以是最终用户。
表2.发生几率

表3.发现的可能性

表4.不同风险得分值划定风险等级及风险控制措施

注:风险可接受标准的制定:
严重程度:结果的严重性:中等,对生产线造成较小的破坏,可能有部分产品需报废(但无需挑选)或需对100%产品进行返工。顾客感觉到不方便或有些不满。得分:3分;
发生几率:中等:偶尔发生的失败。得分:3分;
发现的可能性:中等可能性:目前的方法有中等的可能性可以检测出失败模式,得分:3分;
最低可接受标准:3×3×3=27分
(2)风险评价及控制措施:
通过检索资料、产品质量回顾与总结历史经验等方法识别确定潜在的失效模式,列出每个失效模式的潜在结果,对每一个失效模式给出严重性分数,识别每个失效模式的原因,给出每个原因的发生几率分数,识别用于发现失效模式的当前控制手段,对每一个原因和控制手段给出发现的可能性分数。
计算FMEA中每一条风险分值:风险分值=严重性分数×发生几率分数×发现的可能性分数。
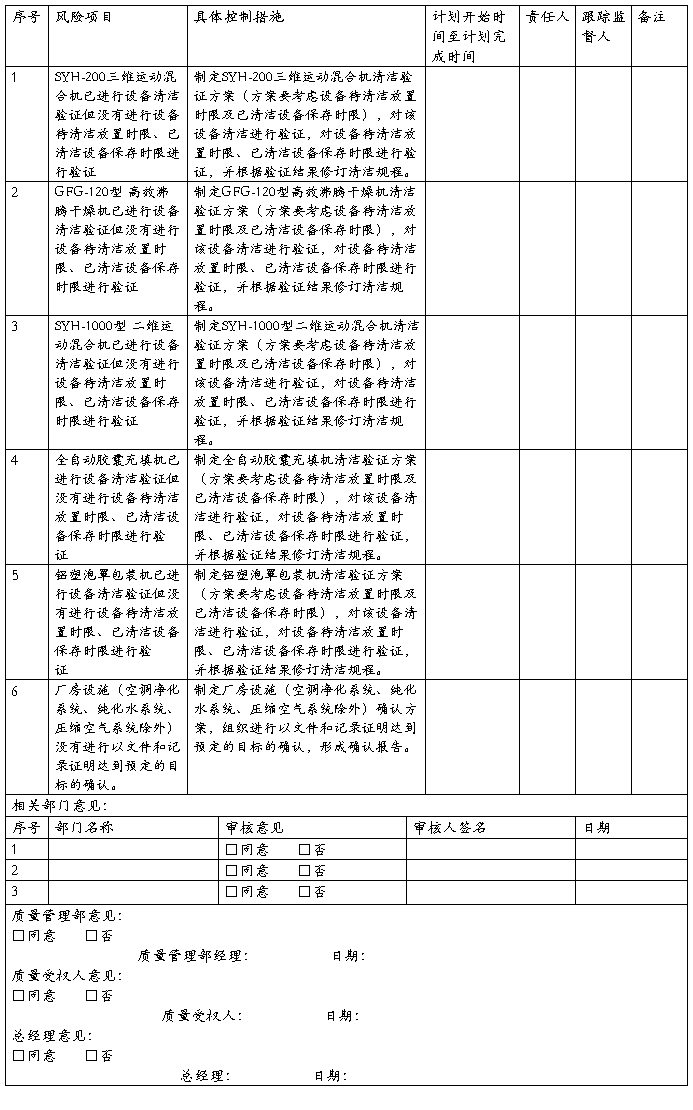
根据风险分值对照上表4. 风险级别评判标准及风险控制措施的要求制定风险预防控制措施,具体见后附的《XXXX胶囊生产过程质量风险评估与控制表》。
从后附的《XXXX胶囊生产过程质量风险评估与控制表》可见,从XXXX胶囊生产过程所涉及到的人、机、料、法、环等各方面进行风险源梳理识别,对XXXX生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等等45项风险进行评估。39项风险按现行控制措施进行管理其风险属于低风险级别,可以接受,只需按现行控制措施控制,不需要采取新的更多的控制措施。6项风险属于中等风险,需要采取有效措施控制解决,控制措施见该表。
7.1.3风险控制措施实施计划制定审核批准
根据《XXXX胶囊生产过程质量风险评估与控制表》制定风险预防控制措施制定的口服固体制剂车间空调净化系统风险控制实施计划交相关责任人审核批准,见后附的《XXXX胶囊生产过程质量风险控制实施计划表》。
7.1.4风险控制措施实施计划实施、落实跟踪
XXXX胶囊生产过程质量风险控制实施计划实施情况及跟踪检查确认,见后附的《XXXX胶囊生产过程质量风险控制实施计划落实跟踪记录表》及后附的文件:
7.2风险控制执行完毕后的风险再评估
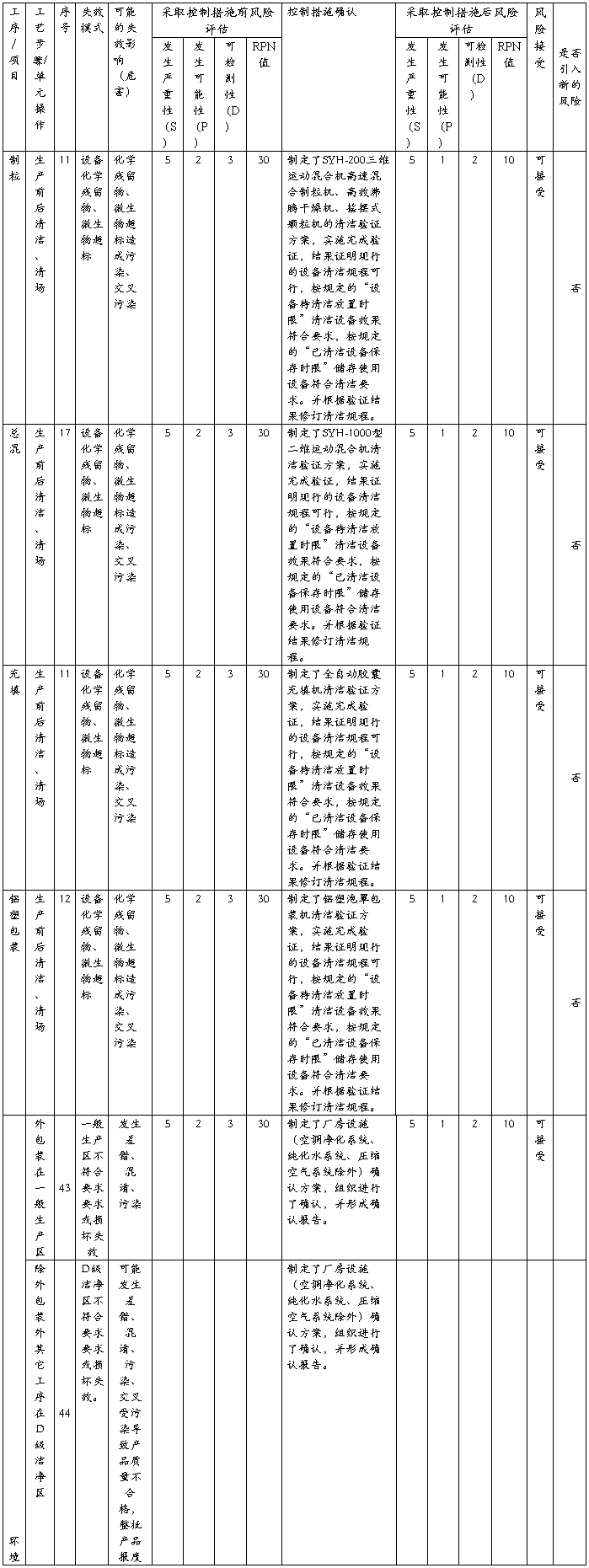
风险控制措施实施计划完成后对其效果进行评估,见后附的《XXXX胶囊生产过程质量风险采用控制措施后的风险再分析与评价表》,从《XXXX胶囊生产过程质量风险采用控制措施后的风险再分析与评价表》可见,风险控制措施计划均规定实施完成,风险均已降低到接受标准,风险得到有效控制,未产生新的风险。
8、风险管理总结及结论
8.1本次按公司质量风险管理规程进行了XXXX胶囊生产过程质量风险管理。对XXXX胶囊生产过程质量风险进行了调查研究讨论,从XXXX胶囊生产过程所涉及到的人、机、料、法、环等各方面进行风险源梳理识别,对XXXX胶囊生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等45项风险进行评估。从评估结果来看,39项风险按现行控制措施进行管理其风险,属于低风险级别,可以接受,只需按现行控制措施控制,不需要采取新的更多的控制措施。6项风险属于中等风险,制定风险控制措施及实施计划,落实实施完成,并进行实施效果评估,风险均已降低到接受标准,风险得到有效控制,未产生新的风险。通过此次质量风险的管理,使XXXX胶囊生产过程质量风险将得到更有效的控制,保证产品质量。
8.2以后在XXXX胶囊生产过程要继续严格执行好现行控制措施,有效的控制质量风险,确保产品质量
9、风险管理回顾审核
9.1对XXXX胶囊生产过程风险管理的过程、结果应进行定期回顾评估:对风险控制措施的有效性等进行再评估,风险审核每年一次。
9.2XXXX胶囊生产过程风险管理回顾评估审核应同时结合最新的知识和经验进行,质量风险管理结果应根据新知识、新环境而更新,通过回顾评估审核确认是否达到可接受标准。
9.3在相关法律、法规变更或XXXX胶囊生产过程对产品质量产生影响的物料、生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等改造、变更、或重要部件维修更换时等情况下,要及时进行风险评估,是否产生新的风险,风险是否均能接受,如不能接受应按要求制定控制措施,并实施控制。
XXXX生产过程质量风险评估与控制表(采用FMEA)

XXXX胶囊生产过程风险控制实施计划表 RD-
XXXX胶囊生产过程质量风险采取控制措施后风险再评估表(采用FMEA)
第二篇:生产部质量风险评估报告
部门质量风险评估报告
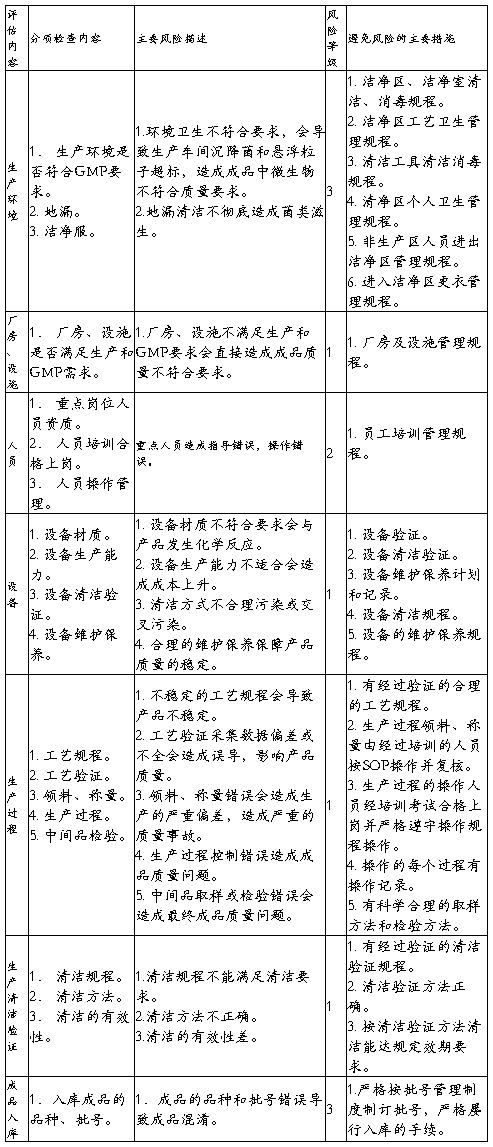
备注:1级为严重,造成产品质量不可控。2级为较严重,产品质量可控但不稳定。3级为较轻,产品偶尔出现问题。
-
药品经营企业质量风险评估报告
XXXX医药有限公司20xx年一季度质量风险管理评估报告报告编制部门质管部编制20xx年3月30日目录1风险评估小组成员2概述21…
-
药品经营企业质量风险评估报告
医药有限公司质量风险评估报告报告起草人起草日期报告审核人审核日期报告批准人批准日期一评估时间及流程安排医药有限公司计划于20xx年…
-
药品生产过程质量风险评估报告模板
XXXX胶囊生产过程质量风险管理报告质量风险管理号:QRM-起草人:起草日期:年月日审核人:审核日期:年月日审核人:审核日期:年月…
-
质量风险评估报告
年月质量风险评估应用质量风险管理的方法确定质量风险管理模式图一风险识别确定事件并启动质量风险管理需要做什么风险评估为什么做成立由验…
-
20xxGSP质量风险排查与评估报告
质量风险评估报告重庆药业有限公司二一四年五月质量控制风险评估报告为有效加强药品质量管理降低药品在经营环节中出现的安全事件的风险更好…
-
药品生产过程质量风险评估报告
XXXX胶囊生产过程质量风险管理报告质量风险管理号:QRM-起草人:起草日期:年月日审核人:审核日期:年月日审核人:审核日期:年月…
- 生产设备风险评估报告
- 生产设备风险评估报告
-
FGJ-300高效粉碎机设备风险评估报告121120
FGJ300高效粉碎机设备风险评估报告编号制订人日期审核人日期日期日期批准人日期设备名称高效粉碎机制造厂商温州市制药设备厂使用部门…
-
JSH-400三维运动混合机设备风险评估报告121120
JSH400三维运动混合机设备风险评估报告编号制订人日期审核人日期日期日期批准人日期设备名称三维运动混合机制造厂商温州健牌药业机械…
-
产品质量风险评估报告
复方氨酚那敏颗粒质量风险评估报告报告起草报告审核报告批准年月日年月日年月日有限公司二0一三年八月118目录1复方氨酚那敏颗粒注册相…