实验二实验报告
液体饱和蒸汽压的测定
摘要 本实验中 通过对液体饱和蒸气压与温度的关系的研究,根据克拉贝隆~克劳修斯方程的简化建立起来的经验方程式,求出液体的平均摩尔汽化热。
关键词 饱和蒸气压 平均摩尔汽化热 克拉贝隆~克劳修斯方程
动态法
1. 前言
在封闭体系中,液体很快和它的蒸汽达到平衡。这时的蒸汽的压力称为液体的饱和蒸汽压。蒸发一摩尔液体需要吸收的热量,即为该温度下液体的摩尔汽化热。当外压为101.325kPa(760mmHg)时,液体的蒸汽压与外压相等时的温度称为液体的正常沸点。在图上,也可以求出液体的正常沸点。
液体饱和蒸汽压的测量方法主要有三种:
1、静态法:在某一固定温度下直接测量饱和蒸汽的压力。
2、动态法:在不同外部压力下测定液体的沸点。
3、饱和气流法:在液体表面上通过干燥的气流,调节气流速度,使之能被液体的蒸汽所饱和,然后进行气体分析,计算液体的蒸汽压。本实验利用第二种方法。此法基于在沸点时液体的饱和蒸汽压与外压达到平衡。只要测得在不同外压下的沸点,也就测得在这一温度下的饱和蒸汽压。
2.实验部分
(一)实验原理
液体饱和蒸气压和平均摩尔汽化热的关系可用克拉贝龙~克劳修斯方程表示:
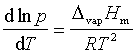 (2-1)
(2-1)
DH:摩尔汽化热(J·mol-1) R:气体常数(8.314J·mol-1·K-1)
若温度改变的区间不大,DH可视为为常数(实际上DH与温度有关)。积分上式得:
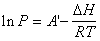 (2-2)
(2-2)
或 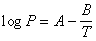 (2-3)
(2-3)
常数 ,
,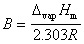 。 (3)式表明
。 (3)式表明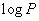 与
与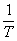 有线性关系。作图可得一直线,斜率为-B。因此可得实验温度范围内液体的平均摩尔汽化热DH。
有线性关系。作图可得一直线,斜率为-B。因此可得实验温度范围内液体的平均摩尔汽化热DH。
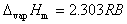 (2-4)
(2-4)
在实验中只要测得不同外压下的沸点,也就测得这一温度下的饱和蒸气压。
(二)仪器与药品
2XZ-2B型旋片真空泵一台(上海真空泵厂;抽速2 L/S;极限真空2³10-2 Pa;转速1430 r/min;功率0.37 KW)
D25-2电动搅拌器一台(杭州仪表电机厂;转速4000r/min;输出功率25W)
CL-150型电炉一台(上海产;功率1500W)
U型压力计一支(测量范围±40 cm;精度1mm;误差 0.5 mm)
水银温度计一支(测温上限102℃;精度0.1℃;误差 0.05℃)
玻璃烧杯一只(容量5000 mL)
(三)实验内容
1、如下图为实验装置图:
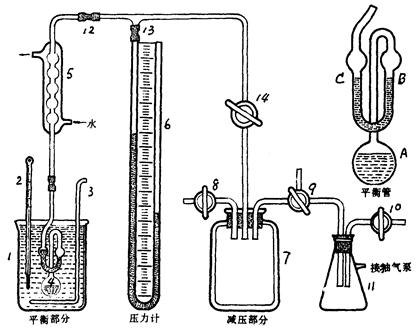
图2-1 纯液体饱和蒸汽压测定装置图
1-盛水大烧杯;2-温度计(分度值为0.1°);3-搅拌;4-平衡管;5-冷凝管;6-开口U形水银压力计;7-具有保护罩的缓冲瓶;8-进气活塞;9-抽气活塞;10-放空活塞;11-安全瓶;12、13-橡皮管14-三通活塞
熟悉实验装置,掌握真空泵的正确使用,了解系统各部分及活塞的作用,读当日大气压。
2、取下平衡管4,洗净、烘干,装入待测液。使A球内有2/3体积的液体。并在B,C管中也加入适量液体,将平衡管接在冷凝管的下端。
平衡管中液体的装法有两种:
一是把A管烘烤,赶走空气,迅速在C管中加入液体,冷却A管,把液体吸入。二是将C管中加入液体,将平衡管与一水泵相连接,抽气,并突然与水泵断开,让C管的水流入A管。
3、系统检漏:管闭活塞8和9,将三通活塞14旋转至与大气相通,关闭活塞10,插上真空泵电源,启动真空泵,将活塞14再转至与安全瓶11相通,抽气5分钟,再将活塞14旋至与大气相通,拔掉真空泵电源,停止抽气。这样做是为了防止真空泵油倒吸。用活塞9调节缓冲瓶的真空度,使U形压力计两臂水银柱高低差为20—40毫米,关闭活塞9。仔细观察压力计两臂的高度,在10分钟内不变化,证明不漏气,可开始做实验。否则应该认真检查各接口,直到不漏气为止。
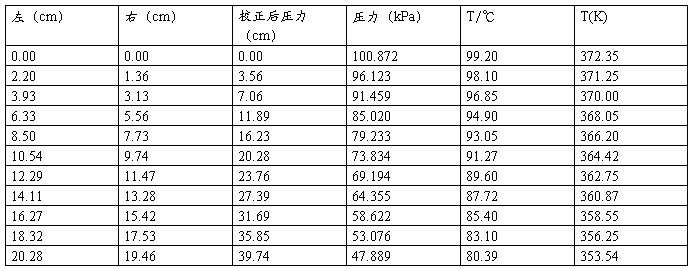
4、不同温度下液体饱和蒸汽压的测定:
A、将平衡管浸入盛有蒸馏水的大烧杯中,并使其全部浸没在液体中。插上电炉加热,同时开冷却水,开启搅拌马达,使水浴中的水温度均匀。
B、关闭活塞9,使活塞8与大气相通。此时平衡管,压力计,缓冲瓶处于开放状态。将活塞14通大气,插真空泵电源抽气,把活塞14旋转至与安全瓶相通,抽5分钟,再将活塞14通大气。拔下电源,此时安全瓶内为负压,待用。
C、随着水浴中液体的温度的不断升高,A球上面的待测液体的蒸汽压逐渐增加,使C管中逐渐有气泡逸出。本实验所测的液体为纯净的水,所以待测水浴中的水沸腾后仍需继续煮沸5-10分钟,把A球中的空气充分赶净,使待测水上面全部为纯液体的蒸汽。停止加热,让水浴温度在搅拌中缓缓下降,C管中的气泡逐渐减少直至消失,液面开始下降,B管液面开始上升,认真注视两管液面,一旦处于同一水平,立即读取此时的温度。这个温度便是实验大气压条件下液体的沸点。
D、关闭活塞8,用活塞9调节缓冲瓶7中的真空度,从而降低平衡管上端的外压,U形压力计两水银柱相差约40mm左右,这时A管中的待测液又开始沸腾,C管中的液面高于B管的液面,并有气泡很快逸出,随着温度的不断下降,气泡慢慢消失,B管液面慢慢升高,在B、C两管液面相平时,说明A、B之间的蒸汽压与外压相等。立即记下此时的温度和U形压力计上的读数。此时的温度即外压为大气压减去两汞柱差的情况下液体的沸点。
E、继续用活塞9调节缓冲瓶的压力,体系产生新的沸腾,再次测量蒸汽压与外压平衡时的温度,反复多次,约10个点。温度控制在80°C以上,压差计的水银柱相差约400mm左右为止。
为了测量的准确性,可将缓冲瓶放空,重新加热,按上述步骤继续重复测量两次。
6、实验结束时,再读取大气压,把三次记录的值取平均。
(四)结果与讨论
从附录中的实验数据处理与误差分析可以得到:
实验测得的水的摩尔汽化热为△vapHm=43.68KJ/mol
与文献值40.69kJ/mo的相对误差为7.4%
实验测得的正常沸点实验值为 Tb=372.64K
与文献值373.15的相对误差为0.137%
误差产生原因:
(1)读数时,气压和温度都不处于平衡状态。读数过程中气压和温度都在变化。
(2)系统误差:实验中用克拉贝隆-克劳修斯方程作为实验的基本原理,但是该方程本身就是一个近似方程,它做了三个近似:忽略凝聚体的体积 ;相变焓不随温度而改变;假设气体为理想气体。实验中水的汽化焓会随着温度的升高而增大。对于沸点的达到是通过观察平衡管的两端液面相平来判断的,因此,视觉误差会产生一定误差。
(3)实验过程中,体系中的液体也不是纯水,含有杂质,所以其沸点相对于纯水的沸点要低一些。
(4)平衡管内部不可能绝对没有空气,由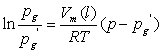 可知,会对结果有影响。
可知,会对结果有影响。
(5)由于反应体系的温度读取的是水浴的温度而不是真正的体系温度,利用水浴加热过程中,体系的温度比水浴的温度会滞后一些,所以与实际的气-液相平衡温度会有一定得偏差。
(五)结论
通过本实验初步验证了克拉贝隆-克劳修斯方程,并且利用动态法测量的水的平均摩尔热以及正常沸点与文献结果相近,而且误差很小。
但是如果可以简化一下读数过程,用机械的方式来完成人工读数过程,会是实验结果更精确。
参考文献
[1] 崔献英等,物理化学实验,中国科学技术大学出版(2000)
[2] 傅献彩等,物理化学,高等教育出版社(2002)
Abstract Dynamic method has been used to measure the standard vapor pressure of pure water at different temperatures. Also, Clapeyron-Clausius equation is used to calculate the molar heat of vaporization of pure water. Experiments show that the standard vapor pressure decreases with the increasing temperature and lnP has a perfect linear relation with 1/T. The results are in good agreement with Clapeyron-Clausius equation.
Key words saturation vapor tension gasification heat Clapeyron-Clausius equation dynamic method
附件:
原始数据记录与处理
大气压

1.第一组数据
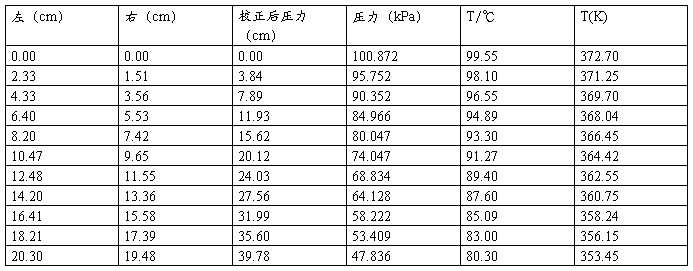
(1)作P~T曲线
得到下表:
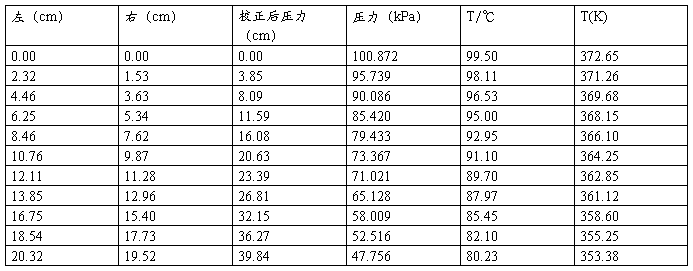
P—T图
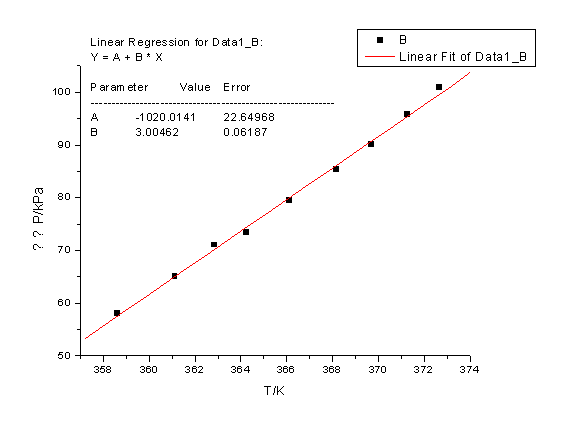 从图中均匀独处10个点:
从图中均匀独处10个点:

(2)根据10点作直线
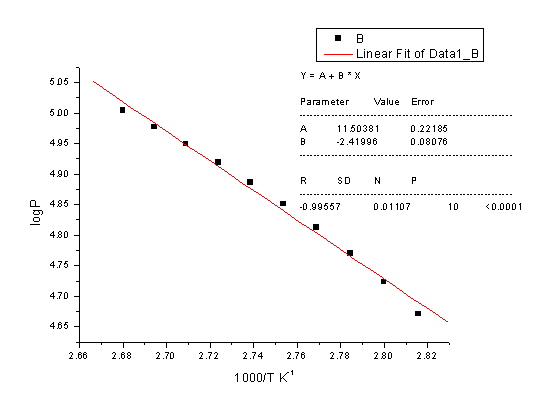
由此可得
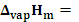 -2.303RB=-2.303*8.314*(-2419.96)=46.34 KJ/mol
-2.303RB=-2.303*8.314*(-2419.96)=46.34 KJ/mol
水的沸点Tb=B/(log P-A)=-2419.96/(log101325-11.5038)
=372.41K
2.第二组数据
(1)作P~T曲线
得到下表:
P—T图
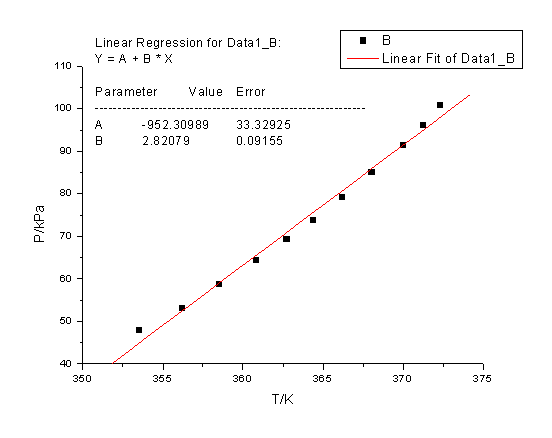
从图中均匀读出10个点

(2)根据10点作直线
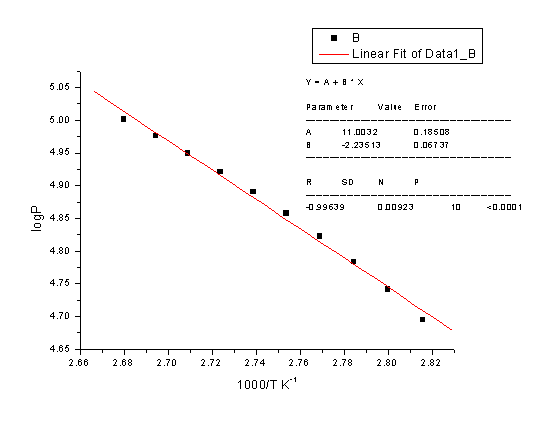
由此可得
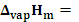 -2.303RB=-2.303*8.314*(-2235.13)=42.80 KJ/mol
-2.303RB=-2.303*8.314*(-2235.13)=42.80 KJ/mol
水的沸点Tb=B/(log P-A)=-2235.13/(log101325-11.0032)
=372.68K
3.第三组数据
(1)作P~T曲线
得到下表:
P-T图
从图中均匀独处10个点:
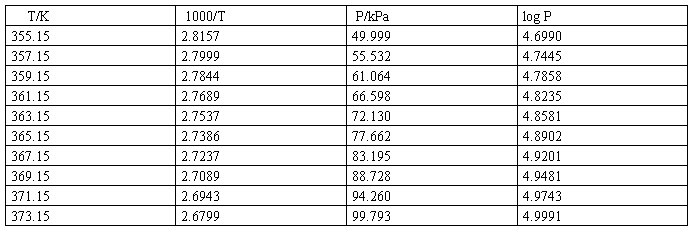
(2)根据10点作直线
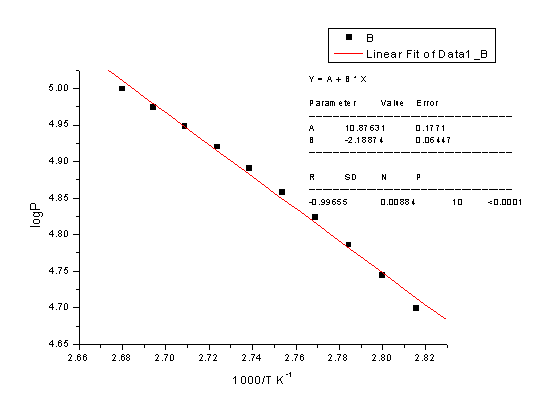
由此可得
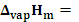 -2.303RB=-2.303*8.314*(-2188.74)=41.91 KJ/mol
-2.303RB=-2.303*8.314*(-2188.74)=41.91 KJ/mol
水的沸点Tb=B/(log P-A)=-2188.74/(log101325-10.87631)
=372.83K
归纳如下表:

误差分析:
已知水的摩尔汽化焓为ΔH = 40.69kJ/mol,
δΔH=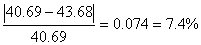
已知当P=760.0mmHg(101.325kPa)时,水的沸点为373.15K,
δΔT=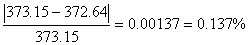
第二篇:数学实验实验报告二答案
实 验 二
实验项目名称:插值与拟合
实验内容:
1、 建立拉格朗日插值的函数M文件lagr.m。
New script 源程序:
function y=lagr(x0,y0,x)
n=length(x0);m=length(x);
for i=1:m
z=x(i);
s=0;
for k=1:n
p=1;
for j=1:n
if j~=k
p=p*(z-x0(j))/(x0(k)-x0(j));
end
end
s=p*y0(k)+s;
end
y(i)=s;
end
保存为larg.m
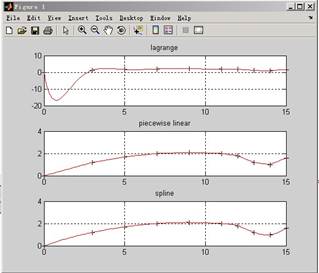
2、 完成机床加工问题中数据增加密度,利用三种插值方法计算加工所需数据,并画出曲线,比较分析三种插值结果。(参考教材P77)
源程序:
 x0=[0,3,5,7,9,11,12,13,14,15];
x0=[0,3,5,7,9,11,12,13,14,15];
y0=[0,1.2,1.7,2.0,2.1,2.0,1.8,1.2,1.0,1.6];
x=0:0.1:15;
y1=lagr(x0,y0,x);
y2=interp1(x0,y0,x);
y3=interp1(x0,y0,x,'spline');
[x',y1',y2',y3'];
subplot(3,1,1)
plot(x0,y0,'k+',x,y1,'r')
grid,title('lagrange')
subplot(3,1,2)
plot(x0,y0,'k+',x,y2,'r')
grid,title('piecewise linear')
subplot(3,1,3)
plot(x0,y0,'k+',x,y3,'r')
grid,title('spline')
实验结果:
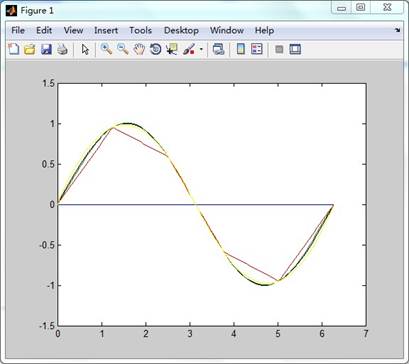
3、 完成教材P80习题1中的函数y=sinx的三种插值结果的分析和比较。
源程序:
n=10;m=100;
x=linspace(0,2*pi,100);
y=sin(x);
z=x*0;
x0=linspace(0,2*pi,6);
y0=sin(x0);
y1=lagr(x0,y0,x);
y2=interp1(x0,y0,x);
y3=interp1(x0,y0,x,'spline');
plot(x,z,x,y,'k',x,y1,x,y2,x,y3,'y')
实验结果:
4、 完成教材P81习题2。
源程序:
x0=[0,1,4,9,16];
y0=sqrt(x0);
x=5;
y=sqrt(5)
y1=lagr(x0,y0,x)
x0(1)=[];
y0=sqrt(x0);
y2=lagr(x0,y0,x)
x0(4)=[];
y0=sqrt(x0);
y3=lagr(x0,y0,x)
x0(1)=[];
y0=sqrt(x0);
y4=lagr(x0,y0,x)
实验结果:
y =2.2361
y1 =2.0794
y2 =2.2540
y3 =2.2667
y4 =2.2000
5、 理解教材的拟合应用实例-给药方案,参考该实例完成教材P81习题6。
源程序:(τ输入成t0)
t = [0.5, 1, 2, 3, 4, 5, 7, 9];
v = [6.36, 6.48, 7.26, 8.22, 8.66, 8.99, 9.43, 9.63];
y = log(10 - v);
a=polyfit(t,y,1);
t0=-1/a(1)
vo=10-exp(a(2))
实验结果:
t0 =3.5269
vo =5.6221
即初始电压为5.6221,充电常数位3.5269
-
传热实验实验报告
江苏大学实验报告完成报告所需时间教师评定实验传热实验一实验目的1了解换热器的结结构及用途2学习换热器的操作方法3了解传热系数的测定…
-
化工原理实验传热实验报告
传热膜系数测定实验第四组一实验目的1了解套管换热器的结构和壁温的测量方法2了解影响给热系数的因素和强化传热的途径3体会计算机采集与…
-
传热实验报告
传热膜系数测定实验实验日期20xx129班级姓名学号同组人实验装置一报告摘要本实验以套管式换热器为研究对象并用常压下100的水蒸汽…
-
传热实验报告
传热膜系数的测定摘要在化工领域中传热膜系数与传热系数对能量传递效率有非常显著的影响对传热膜系数及传热系数的考察广泛应用于不同反应器…
-
化工原理实验报告(传热)
北京化工大学化工原理实验报告传热膜系数测定实验院部化学工程学院专业化学工程与工艺班姓名江海洋20xx011136同组人员王彬刘玥波…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
乙醇的蒸馏及沸点测定 实验报告
报告题目:乙醇的蒸馏及沸点测定实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:***学生姓名:**学号:**20…
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
-
液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
液体饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…