实验八肉桂酸的制备
实验八 肉桂酸的制备
一、实验目的
1.学习肉桂酸的制备原理和方法。
2.学习水蒸气蒸馏的原理及其应用,掌握水蒸气蒸馏的装置及操作方法。
二、基本原理
1、Perkin反应制备肉桂酸
芳香醛与具有α-H原子的脂肪酸酐在相应的无水脂肪酸钾盐或钠盐的催化下共热发生缩合反应,生成芳基取代的α ,β-不饱和酸,此反应称为Perkin反应。反应式如下:
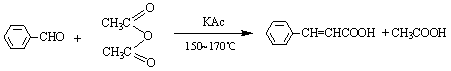
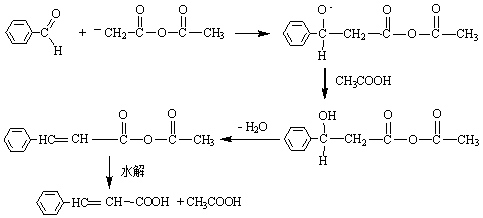
Perkin反应的催化剂通常是相应酸酐的羧酸钾或钠盐,有时也可用碳酸钾或叔胺代替。反应时,可能是酸酐受醋酸钾(钠)的作用,生成一个酸酐的负离子,负离子和醛发生亲核加成,生成中间物b-羟基酸酐,然后再发生失水和水解作用而得到不饱和酸。反应机理如下:

2、水蒸气蒸馏的基本原理及实验操作
(1) 水蒸气蒸馏的基本原理
当有机物与水一起共热时,根据道尔顿(Dalton)分压定律,整个系统的蒸气压应为各组分蒸气压之和,即:P=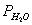 +PA
+PA
其中P代表总的蒸气压,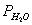 为水的蒸气压,PA为与水不相溶物或难溶物质的蒸气压。当总蒸气压P与大气压相等时,则液体沸腾。这时的温度即为它们的沸点。这时的沸点必定较任一组分的沸点低。因此在常压下用水蒸气蒸馏,就能在低于100℃的情况下将高沸点组分与水一起蒸出来。例如水与苯甲醛混合物的沸点为97.9℃。此时:
为水的蒸气压,PA为与水不相溶物或难溶物质的蒸气压。当总蒸气压P与大气压相等时,则液体沸腾。这时的温度即为它们的沸点。这时的沸点必定较任一组分的沸点低。因此在常压下用水蒸气蒸馏,就能在低于100℃的情况下将高沸点组分与水一起蒸出来。例如水与苯甲醛混合物的沸点为97.9℃。此时:
P=760mmHg 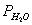 =703.5mmHg P苯甲醛=65.5mmHg
=703.5mmHg P苯甲醛=65.5mmHg
水蒸气蒸馏法的优点在于使所需要的有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。
水蒸气蒸馏常在下列情况下使用:
(a)混合物中含有大量的固体,通常的蒸馏、过滤、萃取等分离方法都不适用。
(b)混合物中含有焦油状物质,采用通常的蒸馏、萃取等方法非常困难。
(c)在常压下蒸馏高沸点有机物质会发生分解。
被提纯物质必须具备以下几个条件:
(a)不溶或难溶于水。
(b)在沸腾下与水不发生化学反应。
(c)在100℃左右必须具有一定的蒸气压(一般不小于10mmHg)。
(2)水蒸气蒸馏的实验操作
水蒸气蒸馏装置如图2所示。用500 mL圆底烧瓶作水蒸气发生器,内盛水约占其容量的1/2~2/3,以长玻璃管作为安全管,管的下端接近瓶底,根据管中水柱的高低,可以估计水蒸气压力的大小。水蒸气导管末端应接近蒸馏烧瓶底部,以使水蒸气和被蒸馏物质充分接触并起搅拌作用。发生器的水蒸气导出管与一个T形管相连,T形管的支管套一个短橡皮管,橡皮管上用螺旋夹夹住,T形管的另一端与蒸馏部分的导管相连,T形管用来除去水蒸气中冷凝下来的水分。在操作中,如果发生不正常现象,应立刻打开螺旋夹,使之与大气相通。
将反应装置按图2连接好,打开T形管上的螺旋夹,把水蒸气发生器里的水加热到沸腾,当有水蒸气从T形管的支管冲出时,再旋紧螺旋夹,让水蒸气通入烧瓶中,这时可以看到烧瓶中的混合物翻腾不息,不久在冷凝管中就会出现有机物质和水的混合物。调节加热温度,使瓶内的混合物不致飞溅得太厉害,并控制馏出液的速度约为每秒种2~3滴。为了使水蒸气不致于在烧瓶内过多地冷凝,在进行水蒸气蒸馏时通常也可用小火将蒸馏烧瓶加热。在操作时,要随时注意安全管中的水柱是否发生不正常的上升现象,以及蒸馏烧瓶中的液体是否发生倒吸现象,一旦发生这种现象,应立刻打开螺旋夹,移去热源,找出发生故障的原因。必须把故障排除后,方可继续蒸馏。当馏出液澄清透明,不再含有油滴时,一般即可停止蒸馏,这时应首先打开螺旋夹,然后移去热源,以免发生倒吸现象。
三、主要试剂与仪器
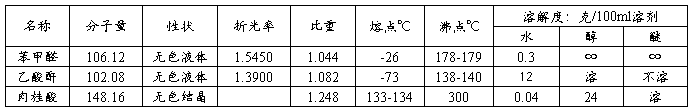
1.试剂 苯甲醛 6 mL (0.06mol),乙酸酐 11 mL (0.12mol),无水醋酸钾 6g (0.06mol),饱和碳酸钠溶液,浓盐酸,活性炭。
2.仪器 250 mL三口烧瓶,空气冷凝管, 250mL圆底烧瓶,75度弯管, 直形冷凝管,支管接引管,锥形瓶,量筒,烧杯,布氏漏斗,吸滤瓶,表面皿,红外灯。
四、主要试剂与产品的物理常数
五、实验装置
制备肉桂酸的实验装置如图1、图2所示。

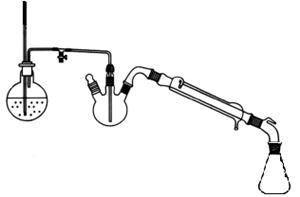
图1 制备肉桂酸的反应装置图 图2 水蒸气蒸馏装置图
六、实验步骤
1.在250 mL三口烧瓶中依次加入无水醋酸钾6g,苯甲醛6 mL,乙酸酐11 mL,沸石2粒。
2.安装反应装置如图1,三口烧瓶一口堵塞,一口插入温度计进液相,一口装空气冷凝管。
3.用电夹套加热,控制温度在150~170℃回流1h。要注意控制加热速度,防止物料从空气冷凝管顶端逸出,必要时可再接一个冷凝管。
4.将反应液冷却至约100℃左右,加入40 mL热水,此时有固体析出。
5.向三口烧瓶内加入饱和碳酸钠溶液,并摇动三口烧瓶,用pH试纸检验,直到pH值为8左右,约需饱和碳酸钠溶液30~40 mL。
6.如图2搭好水蒸气蒸馏装置,蒸出未反应的苯甲醛,蒸到馏出液澄清无油珠时停止蒸馏(可用盛水的烧杯去接引管下接几滴馏出液,检验有无油珠),约需20min。
7.将剩余液转入400 mL烧杯中,补加少量水至液体总量为200~250 mL,再加1~2匙活性炭。
8.煮沸脱色5min。
9.趁热减压过滤,滤液转入干净的烧杯,冷却到室温。
10.搅拌下慢慢加入浓盐酸,到pH试纸变红,大约需要20~40mL。
11、冷却到室温后,减压过滤,滤饼用5~10 mL冷水洗涤,抽干。
12、滤饼转入表面皿,红外灯下干燥。产品称量,回收,计算产率。
七、注意事项
1.久置的苯甲醛含苯甲酸,故需蒸馏提纯。苯甲酸含量较多时可用下法除去:先用10%碳酸钠溶液洗至无CO2放出,然后用水洗涤,再用无水硫酸镁干燥,干燥时加入1%对苯二酚以防氧化,减压蒸馏,收集79℃/25mmHg或69℃/15mmHg,或62℃/10mmHg的馏分,沸程2℃,贮存时可加入0.5%的对苯二酚。
2.无水醋酸钾需新鲜熔融。将含水醋酸钾放入蒸发皿内,加热至熔融,立即倒在金属板上,冷后研碎,置于干燥器中备用。
3.反应混合物在加热过程中,由于CO2的逸出,最初反应时会出现泡沫。
4.反应混合物在150~170℃下长时间加热,发生部分脱羧而产生不饱和烃类副产物,并进而生成树脂状物,若反应温度过高(200℃),这种现象更明显。
5.肉桂酸有顺反异构体,通常以反式存在,为无色晶体,熔点133℃。
6.如果产品不纯,可在水或3∶1稀乙醇中进行重结晶。
八、思考题
1、具有何种结构的醛能进行Perkin反应?
2、本实验中在水蒸气蒸馏前为什么用饱和碳酸钠溶液中和反应物?
3、为什么不能用氢氧化钠代替碳酸钠溶液来中和反应物?
4、水蒸气蒸馏通常在哪三种情况下使用?被提纯物质必须具备哪些条件?
5、肉桂酸能溶于热水,难溶于冷水,试问如何提纯之?定出操作步骤,并说明每一步的作用。
6、苯甲醛和丙酸酐在无水的丙酸钾存在下相互作用得到什么产物?写出反应式?
答:
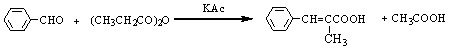
7、反应中,如果使用与酸酐不同的羧酸盐,会得到两种不同的芳香丙烯酸,为什么?
答:酸性条件下,羧酸盐自身也能形成碳负离子,因而反应体系中存在两种不同的碳负离子。
第二篇:实验十七 肉桂酸的制备
实验十七 肉桂酸的制备
一、实验目的
1、了解肉桂酸的制备原理和方法;
2、巩固回流、水蒸气蒸馏等操作。
二、实验原理
1、Perkin反应的特点
2、肉桂酸的制备原理和方法
三、实验药品及其物理常数

四、主要仪器和材料
电炉 三口烧瓶(100 mL、19#×3) 空气冷凝管 温度计(200℃) 空心塞(19#) 螺帽接头(19#,2只,14#,1只) 干燥管 四口烧瓶 空心塞(三个19#,一个14#) 安全管T形管螺旋夹 蒸馏头(塞19#, 口14#)直型冷凝管 弯接管 接受器 布氏漏斗 吸滤瓶 烧杯 水泵 玻棒 滤纸 橡皮管 棉花 沸石等.
五、实验装置
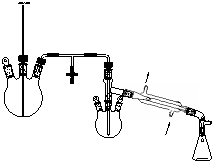
六、操作步骤
【操作要点及注意事项】
⑴ 搭装置:回流装置的仪器必须彻底干燥(包括量取苯甲醛和醋酸酐的量筒)。
⑵ 加料:碳酸钾不能早取,而且必须研细。
⑶ 回流:加热强度不可过大,升温速度不可过快,最高温度不超过200℃。
⑷ 水蒸气蒸馏:进一步巩固安全管与T形管的作用,沸石的加法,是否辅助加热。
⑸ 脱色:活性炭的量,热过滤要快。
= 6 \* GB2 ⑹ 调pH值:盐酸滴加不能过快,所调溶液酸性不能过大。
七、实验结果
1、产品性状: ; 2、理论产量: ;
3、实际产量: ; 4、产率: .
八、实验讨论
1、苯甲醛和丙酸酐在无水碳酸钾的存在下相互作用后得到什么产物?
2、具有何种结构的醛能进行Perkin反应?
3、用水蒸气蒸馏除去什么?为什么能用水蒸气蒸馏法纯化产品?
-
大学有机化学实验报告:肉桂酸的制备
有机化学实验报告实验名称肉桂酸的制备学院化学工程学院专业班级姓名学号指导教师日期20xx年12月22日一实验目的1了解肉桂酸的制备…
-
实验二 香豆素-3-羧酸的制备预习报告
香豆素3羧酸的制备1实验目的1掌握Perkin反应原理和芳香族羟基内酯的制备方法Perkin反应是指由不含有H的芳香醛如苯甲醛在强…
-
肉桂酸的制备实验报告(4)沈杰
实验学专班姓指导日机化学实验报告名称院化学工程学院业化学工程与工艺级化工114班名沈杰学号114020xx417教师肖勋文何炎军期…
-
大学有机化学实验报告:肉桂酸的制备
大学有机化学实验报告肉桂酸的制备一实验目的1了解肉桂酸的制备原理和方法2掌握水蒸气蒸馏的原理用处和操作3学习并掌握固体有机化合物的…
-
实验四 肉桂酸的制备及水蒸气蒸馏
实验四肉桂酸的制备及水蒸气蒸馏6学时实验目的1了解肉桂酸的制备原理和方法2掌握回流水蒸汽蒸馏等操作实验药品新蒸馏过的苯甲醛1ml新…