化学必修1第三章知识点总结
第三章 金属及其化合物知识点总结及方程式
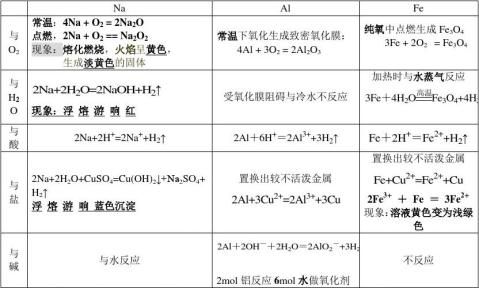

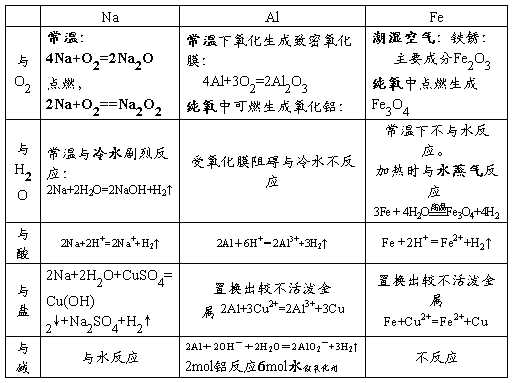
1.金属钠(1)是一种的固体.它的,钠很,,(2)在自然界中以化合态存在
2.钠放置在空气中先,是因为钠与氧气反应生成的,再变是因为氧化3反应,过氧化 4盖
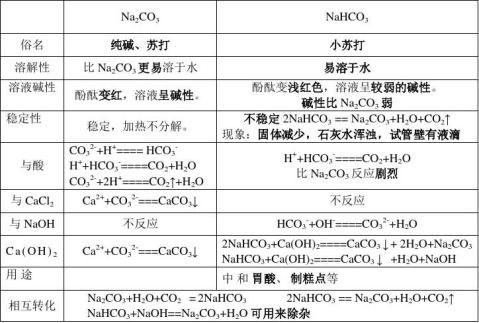
2、碳酸钠与碳酸氢钠的比较
风化是化学变化
区别碳酸钠与碳酸氢钠可用
1. 与CaCl2反应有无沉淀2.与酸反应剧烈程度3碱性强弱4稳定性
2. 碳酸钠与盐酸互滴时中刚开始无现象,后有气泡
3除杂: Na2CO3固体(NaHCO3)加热; Na2CO3溶液(NaHCO3)适量NaOH
NaHCO3溶液(Na2CO3)足量CO2
1.Al3+和OH-互滴现象不同:OH-滴到Al3+中先沉淀后澄清;Al3+到OH-中先澄清后沉淀
Al3++3 OH-=Al(OH)3 ↓ Al(OH)3 + OH- = AlO2- +2 H2O
Al+4OH= AlO2 +2 H2O
2. NaAlO2 和盐酸-互滴现象不同:盐酸滴到NaAlO2中先沉淀后澄清;
NaAlO2 滴到盐酸中先澄清后沉淀
AlO2-+H++H2O=Al(OH)3 ↓ Al(OH)3 + 3H+ = Al3+ + 3H2O .AlO2-+4H+ = Al3+ + 2H2O
2.实验室制取Al(OH)3碱须用氨水
3.铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱
4.明矾的化学式KAl(SO4)2·12 H2O,可做净水剂原因是 Al3+ + 3 H2O = Al(OH)3(胶体)+ 3H+
5.焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃) 实验中用盐酸洗铂丝;实验步骤:烧,蘸,烧,洗
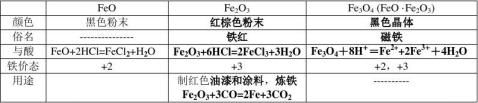
1制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围
2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体:Fe3+ + 3 H2O = Fe(OH)3(胶体)+ 3H+
3.合金的硬度一般高于各成分金属,熔点一般低于各成分金属;铁合金可分为生铁和钢
第三章化学反应归纳 3+ --
1、钠在空气中燃烧 2Na + O2

Na2O2 钠块在空气中变暗 4Na+O2=2Na2O 2、2Na + 2H2O = 2 NaOH + H2 ↑ 2Na + 2H2O = 2Na+ + 2OH- + H2 ↑ 3、2Na2O2 + 2H2O = 4NaOH + O2 ↑ 2Na2O2 + 2H2O = 4Na++4OH -+O2↑
Na2O+H2O=2NaOH
4、 2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液 Na2CO3+2HCl = 2NaCl +H2O+CO2↑ CO32-+2H+= H2O+CO2↑ ②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+ = H2O +CO2↑ 6、2NaHCO3 △
Na2CO3 + H2O +CO2 ↑
7、NaHCO3 + NaOH = Na2CO3 + H2O HCO3-+ OH - = H2O + CO32-
8.Na2CO3+H2O+CO2 = 2NaHCO3
9.2NaHCO3+Ca(OH)23 + 2H2O+Na2CO3
NaHCO3+Ca(OH)23 +H2O+NaOH
10.2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
1、铝箔在氧气中剧烈燃烧 4Al + 3O2 点燃
2Al2O3
2. 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al +6H+=2Al3++3H2↑
3. 2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑ 2Al + 2OH - +2H2O = 2AlO2- + 3H2↑ 4. Al2O3 + 2NaOH 2NaAlO2 +H2O Al2O3 + 2OH - = 2AlO2- + H2O 5. Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4 Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
6.Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
7.Al(OH)3 + NaOH NaAlO2 +2 H2O Al(OH)3 + OH- = AlO2- +2 H2O 8 2Al(OH)32O3+3H2O
++9.Al3 + 3 H2O = Al(OH)3(胶体)+ 3H
11.Al3++3 OH-=Al(OH)3 ↓ Al(OH)3 + OH- = AlO2- +2 H2O
Al3++4OH-= AlO2- +2 H2O
12.AlO2-+H++H2O=Al(OH)3 ↓ Al(OH)3 + 3H+ = Al3+ + 3H2O
.AlO2-+4H+ = Al3+ + 2H2O
13.2AlO2-+CO2+3H2O=2 Al(OH)3+ CO32-
1. 高温下铁与水反应 3Fe + 4H2O(g) 高温
Fe3O4 + 4H2
2. 铁与盐酸反应 Fe + 2HCl = FeCl2 + H2↑ Fe + 2H+ = Fe2+ + H2↑
3. 氧化铁溶于盐酸中 Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O
4.Fe3O4+8H+=Fe2++2Fe3++4H2O
5.Fe2O3+3CO=2Fe+3CO2
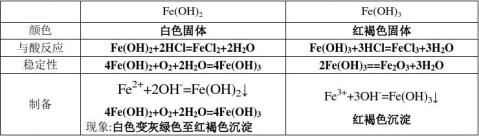
6.FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl Fe3+ + 3OH - = Fe(OH)3 ↓
7.FeCl2 + 2NaOH = Fe(OH)2 ↓+2NaCl Fe2+ + 2OH - = Fe(OH)2 ↓
8. 氢氧化亚铁在空气中被氧化4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
9.Fe(OH)2+2HCl=FeCl2+2H2O
10.Fe(OH)3+3HCl=FeCl3+3H2O
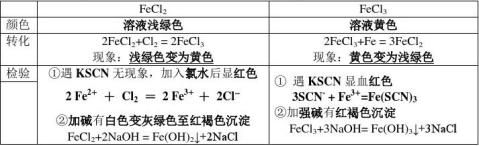
11. 氯化亚铁溶液中通入氯气 2FeCl2 + Cl2 = 2FeCl3 2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
12. 氯化铁溶液中加入铁粉 2FeCl3 + Fe = 3FeCl2 2Fe3+ + Fe = 3Fe2+ 13.2Fe3+ + Cu= 2Fe2++ Cu2+
14.3SCN- + Fe3+=Fe(SCN)3
第二篇:化学必修1第三章知识点总结
第三章 金属及其化合物知识点总结及方程式
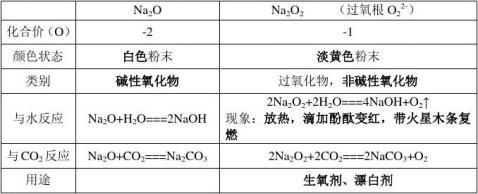
1、氧化钠与过氧化钠的比较
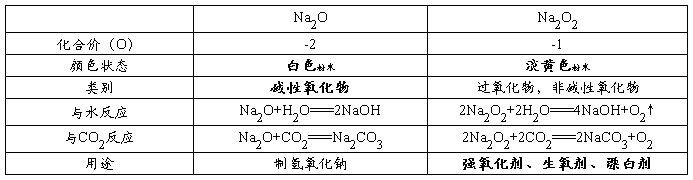
1.金属钠(1)是一种银白色的固体.它的密度比水要小,钠很软,熔沸点低,(2)在自然界中以化合态存在
2.钠放置在空气中先变暗,是因为钠与氧气反应生成的白色的氧化钠,再变潮湿是因为氧化钠与水反应生成的氢氧化钠易吸水.最后形成白色粉末是碳酸钠,
3.钠在氧气中燃烧,火焰呈黄色,生成淡黄色的粉末过氧化钠. 过氧化钠是一种强氧化剂(1)可以用来漂白织物,也可用在呼吸面具上(2)与水和二氧化碳反应都产生氧气。都是放热反应反应中过氧化钠既做氧化剂又做还原剂,质量比为1:1,2mol过氧化钠反应时,转移电子2mol
4将切开的小块钠投入滴有酚酞的水中现象为(1)浮在水面上(2)熔化成银白色的小球(3)四处游动(4)发出响声(5)溶液变红
5.由于钠易与空气中的水或氧气反应,所以通常保存在煤油或石蜡油中.
6.把金属钠投入到CuSO4溶液中,可观察到有(1)气体(2)蓝色沉淀
7.钠与酸反应比钠与水反应更剧烈
2、碳酸钠与碳酸氢钠的比较

1.区别碳酸钠与碳酸氢钠可用
1. 与CaCl2反应有无沉淀2.与酸反应剧烈程度3碱性强弱4稳定性
2. 碳酸钠与盐酸互滴时现象不同,碳酸钠滴到盐酸中马上有气泡,盐酸滴到碳酸钠中刚开始无现象,后有气泡
3除杂: Na2CO3固体(NaHCO3)加热; Na2CO3溶液(NaHCO3)适量NaOH
NaHCO3溶液(Na2CO3)足量CO2
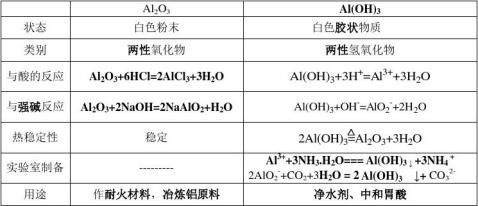
3、铝的氧化物和铝的氢氧化物
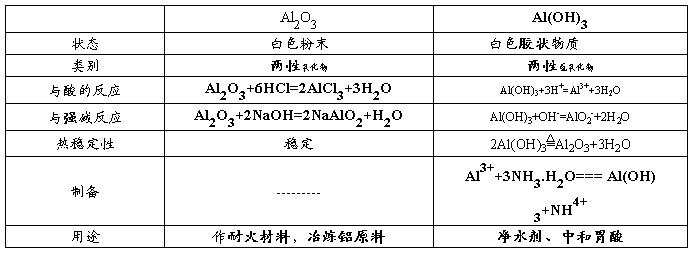
1.Al3+和OH-互滴现象不同:OH-滴到Al3+中先沉淀后澄清;Al3+到OH-中先澄清后沉淀
2.实验室制取Al(OH)3碱须用氨水
3.铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱
4.明矾的化学式KAl(SO4)2·12 H2O,可做净水剂原因是Al3与水反应形成Al(OH)胶体
5.焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃) 实验中用盐酸洗铂丝;实验步骤:洗,烧,蘸,烧,洗,烧
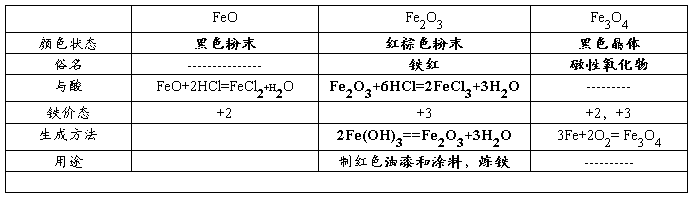
4、铁的氧化物
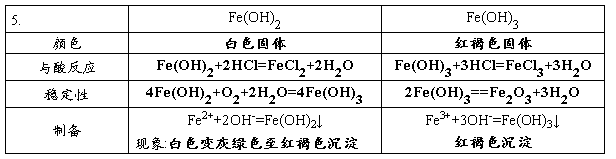
6、铁的盐溶液
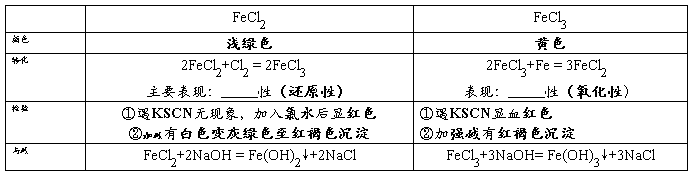
1制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围
2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体
3.合金的硬度高于各成分金属,熔点低于各成分金属;钢可分为碳素钢和合金钢 青铜是我国使用最早的合金
第三章化学反应归纳
1、钠在空气中燃烧(黄色的火焰) 2Na + O2 Na2O2
Na2O2
钠块在空气中变暗 4Na+O2=2Na2O
Na2O在空气中加热(变黄) 2Na2O+O2=2Na2O2
2、钠与水反应(浮、熔、游、响、红)2Na + 2H2O = 2 NaOH + H2↑
2Na + 2H2O = 2Na++ 2OH-+ H2 ↑
3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2+ 2H2O = 4NaOH + O2 ↑ 2Na2O2+ 2H2O = 4Na++4OH -+O2↑
碱性氧化物Na2O与水的反应 Na2O+H2O=2NaOH
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2+ 2CO2= 2Na2CO3+ O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液 Na2CO3+ 2HCl = 2NaCl + H2O+CO2↑
CO32-+ 2H+= H2O + CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3+ HCl =NaHCO3+ NaCl CO32-+ H+= HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+= H2O +CO2↑
6、小苏打受热分解 2NaHCO3 Na2CO3+ H2O +CO2 ↑
Na2CO3+ H2O +CO2 ↑
7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热
NaHCO3+ NaOH  Na2CO3+ H2O
Na2CO3+ H2O
HCO3-+ OH -= H2O + CO32- (若是溶液中反应有离子方程式)
8、铝箔在氧气中剧烈燃烧 4Al + 3O2 2Al2O3
2Al2O3
9. 铝片与稀盐酸反应 2Al + 6HCl = 2AlCl3+ 3H2↑ 2Al +6H+=2Al3++3H2↑
10. 铝与氢氧化钠溶液反应 2Al+2NaOH +2H2O = 2NaAlO2+3H2↑
2Al + 2OH -+2H2O = 2AlO2-+ 3H2↑
11. 氧化铝溶于氢氧化钠溶液 Al2O3+ 2NaOH  2NaAlO2+H2O
2NaAlO2+H2O
Al2O3+ 2OH - = 2AlO2- + H2O
12. 硫酸铝溶液中滴过量氨水 Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
13.氢氧化铝溶液中加盐酸 Al(OH)3+ 3HCl = AlCl3+ 3H2O
Al(OH)3+ 3H+= Al3++ 3H2O
14.Al(OH)3与NaOH溶液反应 Al(OH)3+ NaOH  NaAlO2+2 H2O
NaAlO2+2 H2O
Al(OH)3+ OH- = AlO2- +2 H2O
15. 高温下铁与水反应 3Fe + 4H2O(g)  Fe3O4+ 4H2
Fe3O4+ 4H2
16. 铁与盐酸反应 Fe + 2HCl = FeCl2+ H2↑
Fe + 2H+= Fe2++ H2↑
17. 氧化铁溶于盐酸中 Fe2O3+ 6HCl = 2FeCl3+ 3H2O
Fe2O3+ 6H+= 2Fe3++ 3H2O
18. 氯化铁、氯化亚铁中滴入氢氧化钠溶液
FeCl3+ 3NaOH = Fe(OH)3 ↓+3NaCl Fe3++ 3OH -= Fe(OH)3 ↓
FeCl2+ 2NaOH = Fe(OH)2 ↓+2NaCl Fe2++ 2OH -= Fe(OH)2 ↓
19. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)4Fe (OH)2+ O2+ 2H2O = 4Fe (OH)3
20. 氯化亚铁溶液中通入氯气 2FeCl2+ Cl2= 2FeCl3 2 Fe2++ Cl2= 2 Fe3++ 2Cl-
21. 氯化铁溶液中加入铁粉 2FeCl3+ Fe = 3FeCl2 2Fe3++ Fe = 3Fe2+
-
人教版化学必修二第一章知识点总结
夯实基础提高能力满分答卷持之以恒嘉祥一中高一化学系列之知识清单第一章物质结构元素周期表第一节元素周期表一周期表原子序数核电荷数质子…
-
高一化学必修2第三章有机化合物知识点总结(B4已排版)
第三章有机化学知识点总结第三章有机化学知识点总结第三章有机化合物知识点绝大多数含碳的化合物称为有机化合物简称有机物像COCO2碳酸…
-
高中化学必修二第三章 有机化合物知识点与练习题
第三章有机化学知识点总结第三章有机化学知识点总结第三章有机化合物知识点绝大多数含碳的化合物称为有机化合物简称有机物像COCO2碳酸…
-
必修2 化学 第三章 重要 有机化合物 知识总结 复习 提纲
第三章有机化合物绝大多数含碳的化合物称为有机化合物简称有机物像COCO2碳酸碳酸盐等少数化合物由于它们的组成和性质跟无机化合物相似…
-
化学必修二 第二章知识点总结
第二章化学反应与能量第一节化学能与热能1原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能…
-
高中生物必修三知识点总结
第一章:人体的内环境与稳态1、体液:体内含有的大量以水为基础的物体。细胞内液(2/3)体液细胞内液(1/3):包括:血浆、淋巴、组…
-
【人教版】高中化学选修3知识点总结:第一章原子结构与性质
第一章原子结构与性质小结【课标要求】1.了解原子核外电子的能级分布,能用电子排布式表示常见元素的(1~36号)原子核外电子的排布。…
-
高考生物必修3知识点总结(已做最佳处理)
必修3第一章:人体的内环境与稳态1、体液:体内含有的大量以水为基础的物体。细胞内液(2/3)体液细胞外液(1/3):包括:血浆、淋…
-
高中生物必修三知识点总结
高中生物必修三知识点总结.txt一个人一盒烟一台电脑过一天一个人一瓶酒一盘蚕豆过一宿。永远扛不住女人的小脾气,女人永远抵不住男人的…
-
高中生物必修三稳态与环境知识点总结 20xx
必修三稳态与环境知识点总结20xx3第一章一细胞的生存环境1单细胞直接与外界环境进行物质交换2多细胞动物通过内环境作媒介进行物质交…