初三化学上册课本实验内容专题复习
个性化教学辅导教案
学科:化学 任课教师: 授课时间:2010 年9月 10日 (星期日) 10:00 ~ 12:00

第二篇:初三化学辅导实验专题二典型实验题型复习
初三化学辅导
实验专题二典型实验题型复习
(1)气体的干燥
气体的干燥即除气体中的水蒸气。原则是干燥剂不能跟被干燥的气体发生反应。
A、固体NaOH、生石灰、碱石灰(固体NaOH和CaO的混合物)是碱性干燥剂,可干燥中性气体(如H2、O2、CO、N2、CH4等)和碱性气体(如NH3)。不能干燥CO2、
SO2、HCI等酸性气体。
B、浓硫酸是酸性干燥剂,可干燥中性气体和酸性气体。不能干燥氨气NH3(碱性气体)。
干燥的装置由干燥剂的状态决定,固体干燥剂可用球形干燥管和U形管,液体干燥剂可用洗气瓶。

(2)气体的除杂
除杂原则:被净化的气体不能参加反应,不能引入新的杂质。
常见气体的除杂:
A、NaOH溶液可除去CO2、HCI、SO2等酸性气体。
B、灼热的CuO粉末可除去CO、H2。
C、灼热的铜网可除去O2。
物质的分离和提纯
物理方法:过滤法、结晶法、蒸馏法。
A、过滤法:可溶物质与难溶物质的分离和提纯。例如粗盐的提纯;KCI和MnO2的分离。
B、结晶法:溶解度受温度影响很大的物质与溶解度受温度影响很小的物质的分离。例如,KNO3固体中混有少量的NaCI固体时,提纯KNO3。
C、蒸馏法:沸点不同的物质的分离。分离液态空气制O2;从石油中分离出汽油、煤油等产品;酒精和水的分离。
化学方法:即通过化学反应转化为沉淀、气体等,有的通过置换反应和加热分解来分离。
物质的检验(内容见市资料)
1、制备较纯净干燥的二氧化碳、所需要的试剂是 ( )
A、大理石、稀硫酸、浓硫酸 B、大理石、稀盐酸、浓盐酸
C、大理石、稀盐酸、固体烧碱 D、大理石、稀盐酸、浓硫酸
2、氢气中含有少量的二氧化碳,可让混合气体通过装有______溶液的洗气瓶,再通过装有_______的洗气瓶,使氢气变得纯净干燥。
3、下列气体既可用浓硫酸作干燥剂,又可用氢氧化钠作干燥剂的是 ( )
A、氨气NH3 B、氢气 C、二氧化碳 D、二氧化硫
4、由NaOH和CaO组成的混合物可用作干燥剂。下列气体,能用它干燥的是 ( )
A、CO B、SO2 C、CO2 D、HCI氯化氢
5、要除去二氧化碳中少量的一氧化碳,可让混和气体通过: ( )
A、灼热的碳层 B、灼热的氧化铜 C、石灰水 D、点燃
6、要除去一氧化碳中少量的二氧化碳,可让混合气体通过: ( )
A、灼热的碳层 B、灼热的氧化铜 C、氢氧化钠溶液 D、点燃
7、右图所示装置有多种用途,请回答下列问题:
A、洗气:除去CO2中的水蒸气,装置内应盛_______。
除去H2中的CO2,装置内应盛________。
B、检验:证明CO中混有CO2,装置内应盛________。
C、贮气:若用排空气法收集H2时,气体应从装置的___端通入。
(填A或B,下同)。
若用排空气法收集O2时,气体应从装置的___端通入。
若用排水法收集H2或O2时,瓶内应先装满水,气体从___端通入。
若要用水将装置中的H2或O2排出进行实验,水应从___端通入。
8、要分离碳酸钙和食盐的混合物,可采用的实验步骤是________、_________、________。
9、除杂质:
A、除去铜粉中少量的铁粉,先加足量的______________,再___________。化学方程式为________________________________。
B、除去FeCI2溶液中的CuCI2,先加足量的__________,再___________。化学方程式为
____________________________________。
10、除去下列物质中的杂质(括号内为杂质),所选用的试剂正确的是 ( )
A、CaO(CaCO3)――稀盐酸 B、NaNO3(NaCI)――硝酸银溶液
C、CO(CO2)――稀盐酸 D、CaCO3(Na2CO3)――稀硫酸
11、现有稀盐酸、石灰水、食盐水三瓶无色溶液,只用一种试剂就能将它们一次鉴别出来的
是 ( )
A、石蕊溶液 B、二氧化碳 C、酚酞溶液 D、BaCI2溶液
12、现榨的苹果汁在空气中会由淡绿色变为棕黃色。其原因可能是 ( )
A、苹果汁中的Fe2+变成Fe3+ B、苹果汁中含有Cu2+
C、苹果汁中含有氢氧根离子 D、苹果汁中含有Na+
13、实验室进行粗盐的提纯:a、溶解粗盐时把粗盐加入盛有水的_________里,边加边用____________搅拌,搅拌的作用是_____________________________。b、过滤时玻璃棒起____________作用,如果滤液仍然浑浊,应再___________________。如果两次过滤后滤液仍然浑浊,滤纸可能___________或漏斗内的液面超过___________边缘。C、把过滤好的滤液倒入__________中加热蒸发,同时用________________________滤液,使
滤液_____________,以防______________。待蒸发皿中出现___________________时,
停止加热,利用蒸发皿的________使滤液蒸干。上述的实验过程可归纳为_________、
____________、 和___________三个步骤。下面四种混合物中,能用粗盐提纯的方法除去杂质的是______。
A、MgCI2中含少量CaCO3杂质 B、铜粉中含少量炭粉
C、AgCI中含少量BaSO4杂质 D、硝酸钾中含少量氯化钠
14、用适量盐酸可以将热水瓶胆壁上的水垢〔主要成分是碳酸钙和氢氧化镁〕除去。写出有关反应的化学方程式,并说明去垢的原理。
在家庭里还可以用________来洗涤热水瓶胆壁上的水垢。
15、鉴别氢气、一氧化碳、甲烷三种可燃性气体,可根据它们的 ( )
A、燃烧现象不同 B、燃烧产物不同
C、颜色和气味不同 D、密度不同
16、分别将下列各组物质同时加到足量水中,能得到无色透明溶液的是 ( )
A、HNO3、KOH、FeCI3 B、K2SO4、KCI、HCI
C、AgNO3、HCI、KCI D、Na2CO3、KCI、BaCI2
17、某气体的成分可能含有H2、CO、N2、CH4中的一种或两种。该气体在足量的氧气中充分燃烧后,将全部生成物依次通过浓硫酸和氢氧化钠溶液,发现浓硫酸和氢氧化钠溶液
的质量都增加,则该气体的成分不可能是 ( )
A、CH4 B、CO和N2 C、H2和CO D、CO和CH4
18、下列各组物质的溶液,不另加任何试剂就能将它们区别开来的是〔两个答案〕( )
A、CuSO4、HCI、NaOH B、KNO3、MgCI2、NaOH
C、Na2CO3、HCI、BaCI2 D、NaCI、AgNO3、HCI
19、某同学想用实验证明硫酸铜溶液显蓝色不是SO42-造成的,只进行下列实验,无意义的是 ( )
A、观察硫酸钠溶液没有颜色。
B、向硫酸铜溶液中滴加适量的氯化钡溶液,使沉淀沉降,上层溶液中的蓝色未消失。
C、向硫酸铜溶液中滴加适量的氢氧化钠溶液,使沉淀沉降,上层溶液中的蓝色消失。
D、加水稀释硫酸铜溶液,溶液蓝色变浅。
20、有一瓶溶液,可能含有Na+ 、Ba2+ 、H+、CI-、CO32—、SO42—、OH—中的几种,进行如下实验:
、H+、CI-、CO32—、SO42—、OH—中的几种,进行如下实验:
A、取试样溶液,装入试管,加入BaCI2溶液,溶液中产生白色沉淀,过滤;
B、在滤液中滴入酚酞溶液,溶液呈红色;
C、在沉淀中加入稀硝酸,白色沉淀全部溶解,并产生气泡。
请回答下列问题:
(1)该溶液中一定含有的离子是____________。该溶液中一定不含有的离子是_________________。
(2)步骤A中发生反应的化学方程式是_____________________________________,
步骤C中沉淀溶解的化学方程式是________________________________________。
(3)该溶液中可能含有的离子是____________。
推断题
一、推断题的类型:
(一)推断元素题 例:某元素的单质M可在氧气中燃烧,火星四射,产生黑色固体。若将MCl3溶液与NaOH溶液作用,产生红褐色沉淀A;将A加热时,得到红色粉末B;B与一氧化碳反应又得到金属单质M。试推断M元素的名称和符号,并写出有关变化的化学方程式。
(二)推断微粒题 例:X微粒得一个电子成中性原子,且具有氖原子的电子层;Y微粒与X微粒形成化合物的化学式相当于X2Y,Y离子比X离子核外多8个电子;Z微粒的质子数比X微粒多4,且不显电性。试推断X、Y、Z微粒的名称和化学符号。
(三)推断物质题 例:现有A、B、C、D四种封锁色溶液,它们分别是稀盐酸、氯化钡、硫酸钠和碳酸钠溶液中的某一种。试根据以下实验结果,写出四种溶液中溶质的化学式:
A+B→白色沉淀,A+C→无变化,A+D→无变化,B+C→白色沉淀,B+D→无变化,C+D→有气泡生成。试推断:A______B______C______D______
(四)推断混合物组成题 例:有一固体混合物,可能含有Na2CO3、Na2SO4、CuSO4、CaCl2、
NaCl等物质。为了鉴定它们,做了如下实验:(1)将固体混合物溶于水,得到无色溶液;(2)在此溶液中滴加硝酸钡溶液,有白色沉淀产生(3)过滤,然后在白色沉淀中加入足量稀硝酸,沉淀全部溶解。由此推断:固体混合物中肯定有__________;肯定没有_____;
可能有________。怎样确定可能有的物质是否存在_________________________________。
二、解题方法:
(一)顺推法 例:有一蓝色晶体A,加热时能逐渐变成白色粉末B,取少量B溶于水可得到蓝色溶液;将此溶液分成两份,一份滴入Ba(NO3)2溶液后可得到不溶于稀硝酸的白色沉淀C。另一份加入少量的NaOH溶液后生成蓝色沉淀D;将蓝色沉淀滤出后加热可得到黑色粉末E,若将E与另一黑色粉末共热可得到种新的粉末F。试推断A、B、C、D、E、F各是什么物质?根据上述实验,写出A→B、B→D、D→E、E→F的化学方程式。
(二)反推法 例:将A溶液分成两份,一份中滴入硝酸银溶液,能生成白色沉淀B,此沉淀不溶于硝酸;另一份中加入碳酸钠溶液,生成白色沉淀C,取一部分C加足量稀盐酸,产生无色气体D,此气体通入澄清石灰水出现浑浊;把点燃的蜡烛放在盛有D的集气瓶中,蜡烛很快地熄灭。若取一部分C加稀硫酸也有气体D产生,但仍有白色沉淀E,且此沉淀不溶于稀硝酸。试根据上述实验现象推断A是什么物质。
(三)齐推法 例:已知某物质A为白色固体,它是一种化肥。加热时,A不断地减少直至消失,并产生B、C、D三种物质,且一分子A生成B、C、D各一分子。其中B为无色无味的气体,通入澄清的石灰水中能产生白色沉淀;C为无色有刺激性气味的气体,它的水溶液能使红色石蕊试纸变蓝;D在常温下为无色液体,加热到1000C时沸腾,降温到00C时变为无色透明的固体。试推断A是什么物质。
(四)论证法 例:有一金属A,不能与盐酸反应,A在氯气里燃烧生成B,B与氢氧化钠溶液反应生成氯化钠和蓝色沉淀C,C受热分解生成水和黑色物质D,D与一氧化碳共热又可得金属A。在B的溶液中加足量的铁粉,可得到A和E的溶液。试推断A、B、C、D、E各是什么物质?并写出上述各步反应的化学方程式。
(五)淘汰法 例:有核电荷数在1-20之间的A、B两种元素,它们能形成BA型化合物,A元素在化合物BA里显负价,且A原子和B原子的核外电子总数分别等于它们各自占有的电子层数的四倍,试推断A、B元素的名称。
(六)计算推理法 例:有A、B、C、D、E五种元素,A与E形成化合物AE2,E的第二电子层为最外层,且第二层有6个电子时为中性微粒,在AE2中A元素的质量分数为27.2%,且A原子核内质子数和中子数相等;B原子核内质子数比A原子核外电子数多6个;C-离子与Ar原子结构相同;D3+与Na+电子数相等。试回答:(1)A、B、C、D、E各为什么元素,写出它们的元素名称。(2)画出C-、D3+微粒结构示意图。(3)写出B的单质与C的单质相互形成化合物的化学式。(4)写出D的硫酸盐的电离方程式。
三、巩固练习:
1、有A、B、C三种微粒,A微粒是二价阳离子,核外电子排布和氖原子相同;B微粒是有二个电子层的二价阴离子;C微粒第一电子层上只有一个电子,且呈电中性。试推断A、B、C三种微粒的化学符号,并写出它们之间能形成的化合物的化学式。
2、有一包白色固体,可能含有氯化钙、氯化钾、碳酸钠、硫酸铜,为了鉴别它,现做如下实验:(1)将此白色固体溶于水,有白色沉淀生成,过滤,滤液无色。(2)在滤出的沉淀中加入盐酸,沉淀溶解并放出可使石灰水变浑浊的气体(3)在滤液里滴加硝酸银溶液,生成不溶于稀硝酸的白色沉淀,根据上述事实,该白色固体中一定含有哪些物质?
3、两种黑色粉末A和B,在一定条件下反应可得红色固体M和气体X,气体X和B共热时发生反应生成气体Y,气体Y与黑色物质A加热时发生反应也能得到红色物质M。则A是___,
B是____,X是____,Y是____,M是____。
4、某盐A为含钙元素的白色固体,其中的金属离子的核电荷数不大于20。A在高温下分解为固体B和无色气体C。固体B与水反应生成D。D与C反应生成A,同时有水生成。(1)写出化学式:A____B____C____D____;(2)写出化学反应方程式:A→B+C;B→D;D+C→A。
5、有甲、乙、丙、丁、戊、已六种物质,它们能发生如下反应:(1)甲+乙→丙+水;
(2)丙+NaOH→丁↓(蓝色)+戊;(3)丁→甲+水;(4)戊+BaCl2→已↓(白色)+NaCl
由此确定它们的化学式:甲____乙____丙____丁____戊____已____。
除杂题
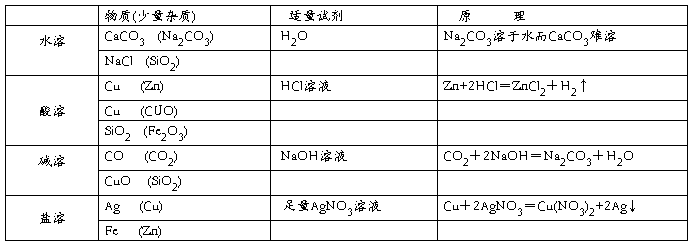
除杂质,就是除去已知物质中混有的少量杂质,使原来不纯的物质变成较纯的物质,因此,除杂质的原则是:既要除掉原来的杂质,又不能生成新的难分离的杂质,即(1)不增──即除杂过程中不增加新杂质; (2)不减──即不减少被提纯物质;(3)易分──被提纯物质与杂质应容易分离;(4)复原──即除杂所用的试剂一般只许跟杂质起反应,若在除杂质过程中被提纯的物质的“主成分”,已转化为其它物质,则应将中间物质转化为“主成分”的纯净物。初中化学通常采用以下几种方法:
一、溶解法:
1、除去CaCl2中混有少量的CaCO3,可将样品溶于适量的蒸馏水中,然后过滤,由于CaCO3不溶,留在滤纸上而被除去,再蒸发滤液,便得到除去CaCO3杂质的CaCl2。
2、除去CuSO4中混有的少量Cu(OH)2,也可采用此法,操作同上。
总结:凡是混和物中的物质一种能溶解而另一种不溶,都可采用此法除杂质。
注意:这里所说的溶解,其实也包括一种物质跟溶剂的反应,因此,常用的溶剂除水外,还可选择酸、碱或盐的溶液。
如(1)铜粉中混有少量的锌粉,操作过程只要加入足量的盐酸溶液, Zn+2HCL=ZnCl2+H2↑,然后过滤、洗涤、烘干即可。
(2)一氧化碳中混有少量的二氧化碳气体,操作过程:将混和气体通入装有氢氧化钠或氢氧化钙溶液的洗气瓶。 CO2+2NaOH=Na2CO3+H2O,然后干燥收集即可。
巩固练习
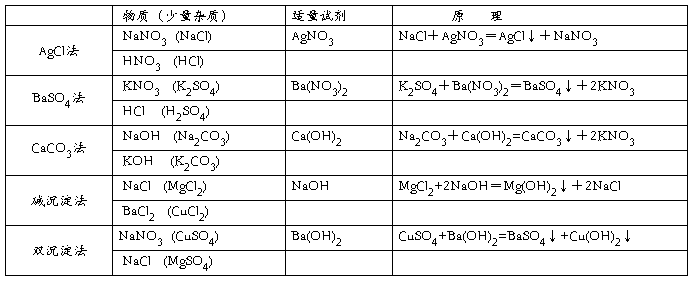
二、沉淀转化法
加入合造的试剂,将杂质离子转变为沉淀而除去, 常用的沉淀剂有可溶性的银盐、钡盐、碳酸盐、碱的溶液 ,使杂质转变成氯化银(AgCl)沉淀,硫酸钡(BaSO4)沉淀,碳酸钙(CaCO3)沉淀或难溶性碱的沉淀, 例如(1)NaOH溶液中混有少量的Na2CO3溶液,操作过程,可在样品中滴入适量的石灰水,直到不再有白色沉淀生成,然后过滤所得的溶液,便足除去Na2CO3杂质的NaOH溶液,反应式为Na2CO3+Ca(OH)2=CaCO3+2NaOH。 (2)同理要除去盐酸中少量的硫酸,滴加适量的BaCl2溶液,然后过滤即可。反应式为:H2SO4+BaCl2=BaSO4↓+2HCl。
巩固练习
三、气体转化法
加入合适的试剂,将杂质离子转化为气体而除去,常见的杂质离子有CO32-、HCO3-一般加入酸转化为二氧化碳除去即可,NH4+一般加入碱液转化为氨气即可除去。
巩固练习

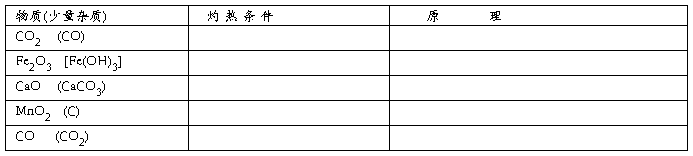
四、加热法
在灼热的条件下使杂质与灼热物质作用或干脆受热分解掉。例(1)除掉H2SO4溶液中混有少量的盐酸,可将样品加热至沸腾即可。(2)除去Na2CO3中混有有少量NaHCO3,可将样品置于干燥试管内加热,直到不再有气体和水生成为止,冷却便得到除去NaHCO3杂质的Na2CO3,反应式为:2NaHCO3=Na2CO3+H2O+CO2↑
巩固练习
总结:以上几种为除杂质的一般途径,当然具体问题还需具体对待,我们一般应采用最方便有效的方法,如除掉一氧化碳中混有的少量二氧化碳气体,可采用(1)灼热法,即将混和气体通过灼热的碳层。(2)碱溶解法,将混和气体通过盛有NaOH溶液的洗气瓶。通过比较。(1)法更方便装置,操作均较简单,效果也较理想。
另外一些除杂问题比较少见,应采用一些特殊的方法,如除硝酸钾中混有的少量氯化钠,可采用结晶或重结晶法,除去酒精中混有的少量的水,可用蒸馏或加无水硫酸铜等,这里不再一一列举了。
课后练习:请用一种试剂除去括号中的杂质(1)HNO3(H2SO4) (2)ZnSO4(CuSO4) (3)Na2SO4(CuSO4) (4)KCl(CaCl2) (5)NaOH(Na2CO3)
一些重要元素化合物的制备方法
物质的制备有实验室制法和工业制法两种.实验室制法,要求装置简便,易于操作,速度快,选用于少量物质的制取.工业制法则要求反应物易于取得,价格低廉,设备投资合理,可用于大批量生产.
初中化学中,典型物质的实验室制法有氧气、氢气、二氧化碳气体。工业上制备的物质仅介绍氧气的制取,炼铁及炼铜以及石灰的制取。
一、几咱气体的实验室制取方法
氧气:
氢气:
二氧化碳:
二、工业制氧气:
高炉炼铁:
湿法炼铜:
三、石灰的制取
制取生石灰:
制取熟石灰:
物质的制备原理是依据物质转化的相互关系,根据单质、氧化物、酸、碱、盐的相互转化可以制备所需要的物质在方法上要求能分离出该物质不引入其他杂质。在实验操作上简便可行。工业上制备方法还需考虑原料来源、成本等多种因素。
例题分析:
1、 实验室制取氢气时,选用的药品为( )
A、锌和浓硫酸B、镁和浓盐酸C、锌和稀硫酸D、锌和浓盐酸
2、上海天原化工厂以食盐、水为主要原料生产多种化工产品。
(1)以食盐和水为反应物,经过电解获得氯气、氢气和氢氧化钠。该反应的化学方程式是_________________________________。
(2)将氯气溶于水时,有一部分氯气跟水发生以下反应:Cl2+H2O=HCl+HClO。写出氯气通入澄清石灰水溶液中发生反应的化学方程式:________________________________。
3、从铜、氧化铜、水、氢氧化钠溶液、硫酸溶液中选择合适的物质通过必要的反应,并经过滤,得到氢氧化铜,写出有关反应的化学方程式。
4、用石灰石、天然碱溶液和水为原料可制取重要化工原料烧碱,写出制取过程中发生反应的化学方程式,并指出反应类型。
5、以氧化铜、铁钉、稀硫酸为原料,用两种不同的方法制备铜,写出有关化学方程式:
巩固练习:
1、我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合后加热到8000C左右,得到一种外观像金子的合金(黄铜是铜和锌的合金),写出有关的化学方程式。
2、氯气是一种有毒的气体,与氢氧化钠溶液反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O
工业上用此方法制取漂白粉[含CaCl+Ca(ClO)2],试回答:
(1)写出制取漂白粉的化学方程式:________________________________。
(2)为保护环境,用某试剂吸收废气中的氯气,写出反应的化学方程式:______________。
1、D 2、NaOH、浓硫酸 3、B 4、A
5、B 6、C
7、A:浓硫酸、NaOH溶液 B:澄清石灰水
C:B端,A端,B端,A端。
8、溶解、过滤、蒸发。 9、略
10、B 11、A 12、A 13、A
14、原理:盐酸与水垢反应生成可溶物质。
15、B、 16、B 17、B 18、A、C 19、D
20、(1)Na+、CO32—、OH—; Ba2+、H+、SO42—
(2)Na2CO3 + BaCI2===BaCO3↓ + 2NaCI
BaCO3 + 2HNO3===Ba(NO3)2 + H2O + CO2↑
(3)CI—
-
生活部学期工作总结
学生会生活部工作总结通过学生会各个部门的努力和配合,我部门本学期各项活动得以有序顺利的完成,回想本学期各项活动,我们的主要职责是:…
-
学校食堂管理工作总结
工作计划“民以食为天”,对于走出家门的学生来说,“吃”比“住”显得更为重要。学校是一个特殊的单位,学生又是一个特殊的消费群体,学校…
-
20xx年采购总监年终总结
我加入加多宝到已经有一段时间了。在这短时间,我感受到加多宝的良好氛围,快速成长的高效率。在王总的领导下,采购部门的工作效率还是比较…
-
何家角村“六打六治”工作总结
何家角村“六打六治”工作总结为进一步深化安全生产领域“打非治违”工作,有效防范和坚决遏制重特大事故,根据镇政府的安排,我村从今年x…
-
06-xx年教务员第一学期工作总结整理
06-xx年教务员第一学期工作总结整理随着新年钟声的临近,紧张而又忙碌的一学期又将结束了。回顾本学期的工作,在王副校长、李主任领导…