实验三 硫酸铜的提纯
实验二 硫酸铜的提纯
实验目的
1、了解化学方法提纯粗硫酸铜的原理和方法。
2、练习无机制备的基本操作。
实验原理
粗硫酸铜中含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3等,不溶性杂质可用过滤法除去,杂质FeSO4需要用氧化剂H2O2或Br2氧化为Fe3+,然后调节溶液的pH值4,使Fe3+水解成Fe(OH)3沉淀而除去,其反应如下:
2FeSO4 + H2SO4 + H2O2= Fe2(SO4)3 + 2H2O
Fe3++ 3H2O → Fe(OH)3↓ + 3H+
除去铁离子之后的滤液,蒸发结晶,其它微量可溶性杂质在硫酸铜结晶时仍留在母液中,过滤时可与硫酸铜分离。
实验步骤
称取5g研细的粗硫酸铜放在100mL小烧杯中,加入20mL蒸馏水,加热搅拌促使溶解.
滴加1 mL 3% H2O2,将溶液加热,同时逐滴加入0.5 mol?L-1NaOH溶液,直到pH≈4,再加热片刻静置使水解生成Fe(OH)3沉淀用倾斜法在普通漏斗上过滤,滤液过滤到洁净的蒸发皿中。
在提纯后的硫酸铜滤液中,滴加1mol?L-1 H2SO4酸化,调节pH至1~2,然后在石棉网上加热,蒸发浓缩至液面出现薄层结晶时,即停止加热。
冷却至室温,结晶在漏斗上过滤,并用一干净的玻璃棒轻压漏斗上的晶体,以除去其中少量的水分。硫酸铜固体再用滤纸吸干水分。
取出晶体,把它夹在两张滤纸中,吸干表面的水分。
在台秤上称出产品质量,计算产率。
硫酸铜回收率 = (精硫酸铜质量/粗硫酸铜质量)×100%
思考题
1、粗硫酸铜溶液中杂质Fe2+为什么要氧化为Fe3+除去?
2、除Fe3+时,为什么要调节到pH≈4左右?pH值太小或太大有什么影响?
注意事项
1、注意各步的pH值控制。
2、蒸发浓缩时,要小火加热。
3、注意滤纸的使用。
第二篇:硫酸铜的提纯1
硫酸铜的提纯
实验目的:
1.了解用重结晶法提纯物质的原理;
2.学习常压过滤、减压过滤、以及称量、加热、溶解、溶液转移、蒸发、浓缩等基本操作。
实验原理:
粗硫酸铜中含有不溶性杂质和可溶性杂质离子Fe2+、Fe3+等,不溶性杂质可用过滤法除去。可溶性杂质离子Fe2+常用氧化剂H2O2或Br2氧化成Fe3+,然后调节溶液的pH值(一般控制在pH=3.5~4),使Fe3+水解成为Fe(OH)3沉淀而除去,反应如下:
2 Fe2+ + H2O2 + 2 H+ = 2 Fe3+ + 2 H2O
Fe3+ + 3 H2O = Fe(OH)3↓十3 H+
除去铁离子后的滤液经蒸发、浓缩,即可制得五水硫酸铜结晶。其它微量杂质在硫酸铜结晶时,留在母液中,过滤时可与硫酸铜分离。
仪器、试剂和材料:
仪器:台秤 漏斗和漏斗架 布氏漏斗 吸滤瓶 蒸发皿
药品:粗CuSO4 H2O2 (3%) H2SO4 (1moI·L-1) , NaOH (2 moI·L-1) ,
其它:滤纸 pH试纸 精密pH试纸(0.5~5.0)
实验步骤:
称取5g由实验室提供的粗CuSO4放在小烧杯中,加入大约30ml蒸馏水,搅拌,促使其溶解。再滴加2m1 3% H2O2,将溶液加热,使Fe2+氧化成Fe3+;用精密pH试纸测试溶液pH值,如果氧化后溶液的pH值很低,这时可在不断搅拌下,逐滴加入0.5~l mol·L-1 NaOH,直到pH=3.5~4,再加热,静置使Fe3+水解生成的Fe(OH)3沉淀,常压过滤,滤液转移到洁净的蒸发皿中。
在精制后的硫酸铜滤液中滴加l mol·l-1 H2SO4酸化,调节pH至l~2,然后加热蒸发 (注意加热时间不要太长),当浓缩至液面出现一层晶膜时,即停止加热,然后冷却至室温,抽滤,当抽至没有水滴时,停止抽滤,取出CuSO4晶体,称量,记录,回收产品。
数据记录与数据处理:

结果与讨论:
思考题:
1.在调节溶液pH值时要注意哪些方面?
2.粗硫酸铜中杂质Fe2+为什么要氧化为Fe3+后再除去? 而除去Fe3+时,为什么要调节溶液的pH值为4左右?pH值太大或太小有什么影响?
3.精制后的硫酸铜溶液为什么要滴几滴l mol·L-1 H2SO4酸化,然后再加热蒸发?
4. KMnO4、K2Cr2O7、Br2、H2O2都可使Fe2+氧化为Fe3+,你认为选用哪种氧化剂较为合适,
为什么?
5. 如何检验CuSO4溶液中少量Fe3+?
注意事项:
粗硫酸铜晶体要充分溶解
pH值的调整
滤纸折叠的方法

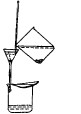
倾泻法过滤操作的要领
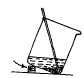

浓缩、结晶程度的掌握
抽滤操作
-
粗硫酸铜提纯实验报告标准模板答案
实验报告课程名称学院化学与化工学院班级实验时间实验报告提交时间教务处制2与在同样条件下显色定容的一系列不同浓度的标准溶液标准色阶进…
-
实验三 硫酸铜的提纯
实验二硫酸铜的提纯实验目的1了解化学方法提纯粗硫酸铜的原理和方法2练习无机制备的基本操作实验原理粗硫酸铜中含有不溶性杂质和可溶性杂…
-
粗硫酸铜提纯实验报告标准模板(20xx.11 2
深圳大学实验报告课程名称学院实验时间实验报告提交时间教务处制2与在同样条件下显色定容的一系列不同浓度的标准溶液标准色阶进行颜色比较…
-
制取硫酸铜大晶体探究实验报告
制取硫酸铜大晶体学校广州大学附属中学班级初三4班组员丘子贞郑康维谢广俊作品名称蓝色妖姬实验探究报告实验名称制取硫酸铜大晶体实验探究…
-
硫酸铜中铜含量的测定(实验报告)
硫酸铜中铜含量的测定摘要本实验利用碘量法测定了硫酸铜中铜的含量最终得到铜的含量为2488003实验的相对标准偏差为009关键词碘量…
-
粗硫酸铜提纯实验报告标准模板(20xx.11 2
深圳大学实验报告课程名称学院实验时间实验报告提交时间教务处制2与在同样条件下显色定容的一系列不同浓度的标准溶液标准色阶进行颜色比较…
-
粗硫酸铜提纯实验报告标准模板答案
实验报告课程名称学院化学与化工学院班级实验时间实验报告提交时间教务处制2与在同样条件下显色定容的一系列不同浓度的标准溶液标准色阶进…
-
高老师无机化学实验 教案五水合硫酸铜结晶水的测定 有实验报告模板
五水合硫酸铜结晶水的测定教案讲授先将沙浴开了总结实验报告对不合格的要求重新写复习分析天平的使用称量方法有那几种一实验目的1了解结晶…
- 化学实验报告 粗苯甲酸提纯
-
硫酸铜晶体中结晶水含量的测定 实验报告
实验二硫酸铜晶体中结晶水含量的测定班级姓名学号实验目的1学习测定晶体中结晶水含量的方法2练习坩埚的使用方法初步学会研磨操作3理解恒…
-
制取硫酸铜大晶体探究实验报告
制取硫酸铜大晶体学校广州大学附属中学班级初三4班组员丘子贞郑康维谢广俊作品名称蓝色妖姬实验探究报告实验名称制取硫酸铜大晶体实验探究…