液体饱和蒸汽压
物 理 化 学 实 验 报 告

实 验 名 称: 液体饱和蒸汽压的测定
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级: 化工12-6班
姓 名:吕博威 学 号 12402010624
指 导 教 师: 王婷婷 邵丹凤
日 期: 20##年3月27日
一、实验目的
1.掌握用等位计测定乙醇的在不同温度下的饱和蒸汽压。
2.学会用图法求乙醇解在实验室温度范围内平均摩尔蒸发含与沸点正常。
二、实验原理
纯物质的蒸气压随温度的变化可用克拉贝龙方程表示:
dp/dT = △vapHm/T△Vm (1)
设蒸气为理想气体,在实验温度范围内摩尔蒸发焓△vapHm可视为常数,并略去液体的体积,将(1)式积分得克劳修斯—克拉贝龙方程:
㏑(P/Pa) = (-△vapHm/R)×(1/T)+ C (2)
由(2)式可见,实验测定不同温度T下的饱和蒸汽压p,以㏑(P/kPa)对1/(T/K)作图,得一直线,求得直线的斜率m和截距C,则乙醇的平均摩尔蒸发焓为:
△vapHm = -m×(R/[R]) ×[△H ] (3)
习惯上把液体的蒸气压等于101.325kPa时的沸腾温度定义为液体的正常沸点,由(2)式还可以求乙醇的正常沸点。
三、实验仪器、试剂
仪器:DPCY-2C型饱和蒸气压教学实验仪1套,HK-1D型恒温水槽1套,WYB-1型真空稳压包1个,稳压瓶1个,安全瓶1个。
试剂:无水乙醇(A.R)
四、实验步骤
1.读取室温和大气压
2.装样
在等温计内装入适量待测液体乙醇。球管中约2/3体积,U型管两边各1/2体积,然后连接好装置。
3.教学实验仪置零
打开试验仪电源,预热5分钟,选择开关打到kPa,按下面板上的置零键,显示00.00数值。
5.排除球管上方空间的空气
打开恒温水槽电源,设定温度为25℃,接通冷凝水,同时调节搅拌器匀速搅拌,使等温计内外温度平衡,用真空稳压包控制抽气速度,抽气减压气泡逸出的速度以一个一个的逸出为宜,至液体轻微沸腾,沸腾3-5分钟,可认为空气被排尽(压力显示-94kPa)。抽气结束后,先关闭真空稳压包上与稳压瓶相连的阀门,再关闭另一侧阀门,打开于真空泵相连的安全瓶活塞,使其通大气,最后关电源。
6.测定饱和蒸汽压
当空气排除干净且体系温度恒定后,旋转稳压瓶上的直通活塞,缓缓放入空气,直至U型管中液面相平,关闭活塞,记录温度与压力。依次测定30℃、35℃、40℃、45℃的压力。
7.结束实验
实验结束后,关闭电源,打开真空稳压包上中间的阀门,将体系放入空气,待等温计内乙醇冷却后,关掉冷凝器中的水。整理好仪器装置。
五、数据记录与处理
室温:24.8℃
大气压(实验前):101.10kPa, 大气压(实验后):101.10kPa
大气压(平均值):101.10kPa
以㏑(P/kPa)—1/(T/K)×103作图,如下所示:
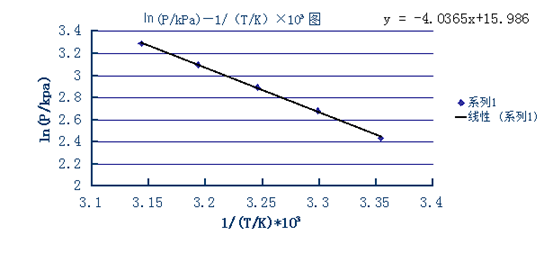
由图可知,直线的斜率为-4.0365,截距为15.986。
故-△vapHm/R=-4.0365,又∵R=8.314,
∴△vapHm = 33.55kJ·mol-1
当液体的蒸气压为101.325 kPa时,代入㏑(P/Pa) = (-△vapHm/R)×(1/T)+ C,
即㏑101.325 = -33.55/8.314×(1/T)*10-3 +15.986
∴T = 355.08K = 81.93℃
六、误差分析
△ vapHm的相对误差=(42.59-33.55)/42.59=0.212
T的相对误差=(78.4-81.93)/78.4= -0.045
由以上数据可得出实验的相对误差较小,仪器较为精确,实验条件较好。
七、思考题
1、要得到较为准确的实验结果,关键在于把空气排尽,控制温度及液面水平
2、当第一次校正的时候时间较长,25℃时的数据测量一定要等液面水平,要是没有排尽空气会使△vapHm 偏大。
3、在放气的时候要缓慢,这样可以避免液体倒灌,若是带入空气实验结果会偏小。
第二篇:液体饱和蒸气压的测定
实验报告不能打印,应该手写。装置图也要画,实验数据的验算(公式)要详细哦!
实验一 液体饱和蒸气压的测定
一、目的要求
1、明确饱和蒸气压的定义,了解纯液体的饱和蒸气压与温度的关系、克劳修斯-克拉贝龙方程式的意义。
2、掌握静态法测定液体饱和蒸气压的原理及操作方法。
3、了解真空泵、恒温槽及气压计的使用及注意事项。
4、学会由图解法求液体的平均摩尔气化热和正常沸点。
二、预习与思考
1.预习基础知识与技巧部分的热效应测量技术及仪器、温度控制技术和压力测量技术及仪器;
2.思考:
(1)汽化热与温度有无关系?克—克方程在什么条件下才能应用?
(2)实验中测定哪些数据?精确度如何?有几位有效数字?作图是怎样选取坐标分度?
(3)用此装置可以很方便地研究各种液体,如苯、乙醇、异丙醇、正丙醇、丙酮、四氯化碳、水和二氯乙烯等,这些液体中很多是易燃的,在加热时应该注意什么问题?
三、实验原理
通常温度下(距离临界温度较远时),密闭真空容器中的纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。恒压条件下蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:

式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,即当作平均摩尔汽化热,将上式积分,得:

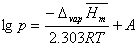
其中A为积分常数,与压力p的单位有关。由此式可以看出,在一定稳定范围内,测定不同温度下的饱和蒸汽压,以lnp对1/T作图,应为一直线,而由直线的斜率可求出实验温度范围的液体平均摩尔汽化热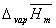 。
。
测定饱和蒸气压的方法:测定饱和蒸气压的方法主要有:
①饱和气流法:在一定温度和压力下,用干燥气体缓慢地通过被测纯液体,使气流为该液体的蒸气所饱和。然后用某种物质将气流中该液体的蒸气吸收,已知一定体积的气流中蒸气的质量,便可计算出蒸气分压,这个分压即该温度下被测纯液体的饱和蒸气压。该法适用于蒸气压 较小的液体。
②动态法:测量沸点随施加的外压力而变化的一种方法。在不同外压下,测定液体的沸点。
③静态法:将待测液体放在一个封闭体系中,在不同温度下,直接测量饱和蒸气压。此法准确性较高,一般适用于具有较大蒸气压的液体。本实验采用静态法测定乙醇在不同温度下的饱和蒸气压。
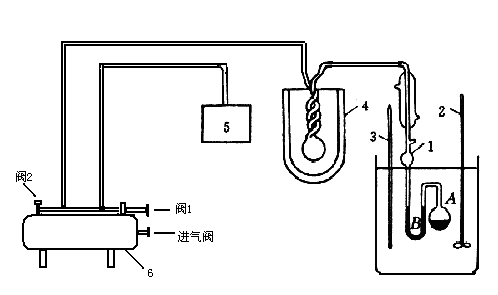
图1静态法测蒸气压装置示意图
1.等位计;2.搅拌器;3.温度计;4.冷阱;5.低真空测压仪;6.缓冲储气罐
静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置,如图1所示:
四、仪器与药品
恒温水浴1套;平衡管1只;气压计1台;等位计1支;真空泵及附件1套;数字式低真空测压仪1台等。
无水乙醇(A.R.)。
五、实验步骤
1 装样:从等位计加料口处加入一定量的液体乙醇(平衡器中已装好)。使A球中装有2/3的液体,“U”形管B的双臂大部分有液体。
2 检漏:
将装有液体的等位计按图1接好,打开冷凝器上水开关(水流不要太大)。关闭平衡阀1,打开精密数字真空测压仪,使单位调为kpa。按调零键置零。打开进气阀,缓慢打开平衡阀2使真空泵与系统连通,对系统缓慢抽气,使真空测压仪上显示压差为4.0-5.3kpa(300-400mmHg)。 关闭进气阀和平衡阀2,并使真空泵与大气连通,停止抽气。注意观察压力测量仪数字的变化。如果系统漏气,则压力测量仪的显示数值逐渐变小。这时应逐段检查,寻找漏气部分,予以消除。
3 饱和蒸气压的测定:
打开恒温水浴开关,打开搅拌开关,调节水浴温度至实验设定温度,对系统缓慢抽气,使A球液体内溶解的空气和A、B管空间内的空气呈气泡状逐个通过B管中的液体排出。如发现气泡成串冒出,关闭平衡阀2,(此时液体已沸腾)缓慢打开平衡阀1,漏人空气,使沸腾缓和。如此抽气3-4分钟,使A球中的空气排除后,关闭进气阀和平衡阀2,并使真空泵与大气连通,停止抽气。调节平衡阀1,使空气缓慢进入测量系统,观察U型管两端液面等高,从压力测量仪上读出压力差。同法再抽气,再调节U型管两端液面等高,重读压力差,直至两次的压力差读数基本相同,则表示使A球液面上的空间已全被乙醇充满,记下压力测量仪上的读数。
用上述方法测定6个不同温度时乙醇的蒸气压(每个温度间隔为5K)。
当六个数测完后,打开平衡阀1,打开平衡阀2,打开进气阀,关闭冷凝水,关闭恒温槽电源,实验结束。
六、实验注意事项
1. 减压系统不能漏气,否则抽气时达不到本实验要求的真空度。
2.整个实验过程中,应保持等压计A球液面上空的空气排净。
3. 抽气速度要合适,必须防止平衡管内液体沸腾过剧,致使B管内液体快速蒸发而被抽尽。
4. 实验过程中,必须充分排除净弯管空间中全部空气,使B管液面上空只含液体的蒸气分子。A球B弯管必须放置于恒温水浴中的水面以下,否则其温度与水浴温度不同。
5. 实验过程中需防止B管液体倒灌入A球内,带入空气,使实验数据偏大。
6. 蒸气压与温度有关,故测定过程中恒温槽的温度波动需控制在±0.1K。
七、数据记录和结果处理
1.自行设计实验数据记录表,既能正确记录全套原始数据,又可填入演算结果。
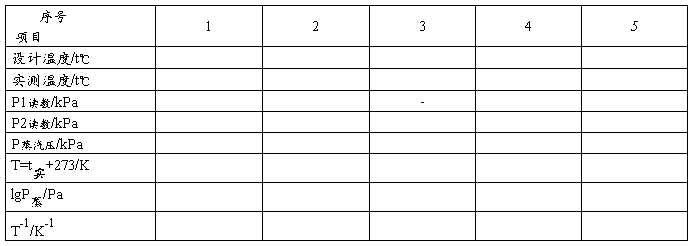
被测液体:无水乙醇 室温:14.7℃ 实验压力:102.38kPa
表1室温、大气压、实验温度及对应的压力差。
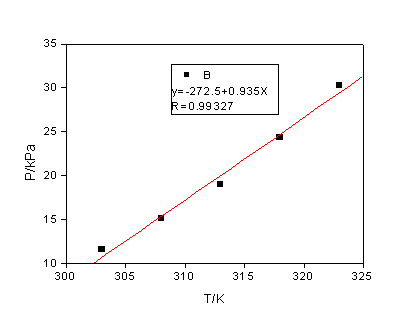 2. 以蒸气压p对温度T作图,在图上均匀读取8个点,并列出相应表格,绘制成lgp~1/T图。
2. 以蒸气压p对温度T作图,在图上均匀读取8个点,并列出相应表格,绘制成lgp~1/T图。

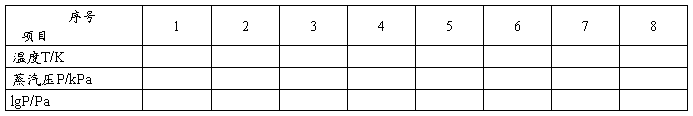
以蒸气压p对温度T作图,在图上均匀读取8个点,并列出相应表格2。.
表2蒸气压p对温度T关系图上所取8个点。
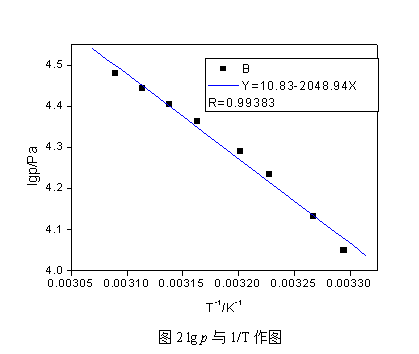 3.从直线lg p~1/T上求出实验温度范围的平均摩尔汽化热,及正常沸点。
3.从直线lg p~1/T上求出实验温度范围的平均摩尔汽化热,及正常沸点。
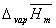 =2.303R×2048.94=39.23KJ/mol. 将压力值代入乙醇蒸气压和温度关系式lg p=10. 83-2048.94/T,求出对应的正常沸点是78.88℃。
=2.303R×2048.94=39.23KJ/mol. 将压力值代入乙醇蒸气压和温度关系式lg p=10. 83-2048.94/T,求出对应的正常沸点是78.88℃。
5.以最小二乘法求出乙醇蒸气压和温度关系式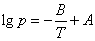 中的A、B值。
中的A、B值。
根据最小二乘法公式,将数值代入以下两式分别求出A、B
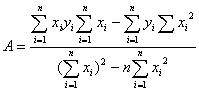
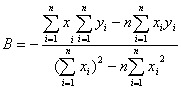
A=10.798,B=2039.65,代入乙醇蒸气压和温度关系式得lg p=10.798-2039.65/T,计算其平均摩尔汽化热为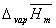 =2.303R×2039.65=39.05KJ/mol.
=2.303R×2039.65=39.05KJ/mol.
八、实验结果与分析
实验值与文献值比较,实验测得的结果乙醇在30-50℃范围的平均摩尔汽化热为39.23KJ/mol,文献值乙醇的平均摩尔汽化热为41.9KJ/mol,相对误差为6%(列式子哦);实验测得的正常沸点是78.88℃,文献值为78.4℃(和大气压有关),相对误差为0.6%(列式子哦)。
八、问题与讨论
1.本实验方法能否用于测定溶液的饱和蒸气压,为什么?
不可以。因为随着实验的进行,A球溶液中的溶剂可能蒸发并在B管冷凝,从而改变了A中溶液的浓度,即随着实验的进行溶液的浓度可能在不断的改变,因此该方法无法准确测定溶液的饱和蒸汽压。
2.按误差传递估算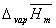 的相对误差;本实验的系统误差是什么?
的相对误差;本实验的系统误差是什么?
3.为什么温度愈高测出的蒸气压误差愈大?
根据克-克方程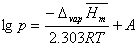 可知,温度越高,测得的饱和蒸汽压越高,测定系统的真空度数越低,由误差传递公式可知测得的数据越小,相对误差越大。
可知,温度越高,测得的饱和蒸汽压越高,测定系统的真空度数越低,由误差传递公式可知测得的数据越小,相对误差越大。
-
液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
4纯液体饱和蒸汽压的测定实验报告
华南师范大学实验报告学生姓名学号专业化学师范年级班级课程名称物理化学实验实验项目纯液体饱和蒸气压的测定静态法实验类型验证设计综合实…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
液体饱和蒸汽压的测定 实验报告
宁波工程学院物理化学实验报告专业班级化工姓名序号同组姓名指导老师胡爱珠杨建平实验日期20xx年3月19日实验名称实验一液体饱和蒸汽…
-
饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定实验报告实验题目液体饱和蒸汽压的测定学院化学与化工学院专业生物工程年级112班学号1108110358学生姓名…
-
给排水顶岗实习总结
顶岗实习总结新景20xx位于厦门市五缘湾片区,建设单位:厦门新景集团有限公司。地下一层(30个防火分区,九个防护单元),地上13懂…
-
业务工作总结(水利站)
业务工作总结——XX县XX镇水利站杜德生本人自一九九X年中专毕业后分配到XX县XX镇水利站工作,一直从事小型水利水电工程的勘测、设…
-
“欢送杯”篮球赛工作总结
20xx-20xx学年“欢送杯”篮球赛工作总结历史文化系学生分会体育部20xx年x月x日光阴似箭,岁月如梭。在这凤凰花开,蝉声四起…
-
年终总结
年终报告各位领导、各位同事:大家好!回首过去一年,内心不禁感慨万千,从我接手出纳一职到现在,学会如何正确的使用各种单据,在每次收到…
-
发货员20xx年工作总结
工作总结时光飞逝,弹指之间,20xx年已接近尾声,回首过去的一年,内心不禁感慨万千……时间如梭,又将跨过一个年度之坎。回想过去,面…