EDTA标准溶液的配制和标定
EDTA标准溶液的标定
一、实验目的
1.学习EDTA标准溶液的配制和标定方法。
2.掌握配位滴定的原理,了解配位滴定的特点。
二、实验原理
EDTA标准溶液的配制一般用间接法先配成近似浓度的溶液,再用基准物质标定。标定EDTA溶液的基准物质有Zn、Cu、ZnO、CaC03、MgS04·7H20、ZnS04·7H2O等。如用CaCO3作基准物质标定EDTA溶液浓度时,调节溶液pH≥12.0,采用钙指示剂,滴定到溶液由酒红色变为纯蓝色为终点。如有Mg2+共存,变色更敏锐。
用钙指示剂(H3Ind)确定终点,在pH≥12时,HInd2-离子(纯蓝色)与Ca2+形成较稳定的CaInd-配离子(酒红色),所以在钙标准溶液中加入钙指示剂时,溶液呈酒红色。当用EDTA溶液滴定时,EDTA与Ca2+形成比CaInd-配离子更稳定的CaY2-配离子,所以在滴定终点附近CaInd-不断转化为CaY2-,而该指示剂被游离出,反应如下:
滴定前: HInd2-+ Ca2+ CaInd- + H+
CaInd- + H+
化学计量点前: Ca2+ + Y4- CaY2-
CaY2-
终点:CaInd- + H2Y2- + OH- CaY2- + HInd2- + H2O
CaY2- + HInd2- + H2O
酒红色 无色 纯蓝色
所以终点时溶液由酒红色转变为纯蓝色。
三、仪器和药品
酸式滴定管,锥形瓶(250 mL),容量瓶(250 mL),移液管(25 mL),FA/JA1004型电子天平,称量瓶;EDTA(0.01 mol/L 左右,待标定),NaOH(2mol/L),HCl(1:1),CaCO3(固体,AR),钙指示剂。
四、实验步骤
1、EDTA标准溶液的配制:在台秤上称取3.8g 左右乙二胺四乙酸钠,溶于300~400 mL温水中后稀释至1L。(已配制)
2、标准溶液的配制:准确称取在110℃干燥至恒重的基准物质CaCO3 0.2~0.3g于烧杯中,加水数滴润湿,盖以表面皿,从烧杯嘴慢慢加入1:1HCl至CaCO 3完全溶解,加热至沸,用蒸馏水把可能溅到表面皿上的溶液洗入杯中,待冷却后移入250mL 容量瓶中,用纯水稀至刻度后摇匀。
3、DTA标准溶液的标定:吸取25.00mL 试样溶液于锥形瓶中, 加水25mL稀释, 10%NaOH溶液5mL调节溶液pH 为12,加入米粒大小(0.01g)的钙指示剂,用EDTA 标准溶液滴定,溶液由酒红色转变为纯蓝色即为终点。平行测定三次。
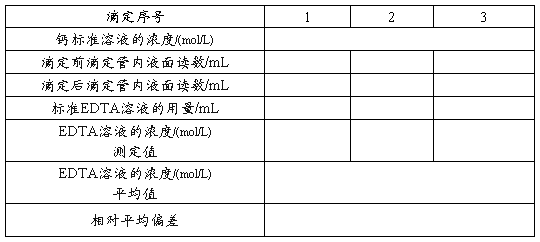
五、数据记录和处理
1、钙标准溶液的配制

2、EDTA标准溶液的标定
六、讨论
思考题
1. 用HCl溶液溶解CaCO3基准物质时,操作中应注意什么?
2. 为什么在用ZnO为基准物质标定EDTA溶液时要加NH3·H2O-NH4Cl缓冲溶液?
3. 如果用HAc-NaAc缓冲溶液,能否用铬黑T作指示剂? 为什么?
注意事项
1.移液管、滴定管、容量瓶、锥形瓶的洗涤方法
2.移液管、滴定管的操作手法
3.容量瓶的查漏及规范使用
4.电子天平的规范使用
5.读数、记数、计算结果的有效数字
6.配位滴定与酸碱滴定的区别,滴定操作注意滴定速度。
配位反应的速度较慢(不像酸碱反应能在瞬间完成),故滴定时加入EDTA的速度不能太快。特别是临近终点时,应逐滴加入,并充分振摇。
第二篇:盐酸标准溶液的配置及标定
实验题目:盐酸溶液浓度的标定
一、 实验目的:
1、掌握酸式滴定管的使用和操作方法;
2、学会酸碱溶液浓度的标定方法;
3、学会使用电子天平“差重法”称量。
二、实验原理:
滴定反应Na2CO3 + 2HC l = 2NaCl + CO2 + H2O
106g 2mol
W(g) (C(HCl)·V/1000)mol
C(HCl) =(2 W×1000)/(106 ×V)=1000W/53V
基准物—硼砂(Na2B4O7·10H2O),Na2CO3(无水,放于干燥器内,本次实验用); 指示剂—甲基橙
终 点:黄色—变为橙色(pH=3.1—4.4)
三、仪器及试剂:
HCl标准溶液,无水Na2CO3,甲基橙,酸式滴定管,烧杯,锥形瓶;电子天平。
四、实验步骤:
1、计算Na2CO3的称量范围;
2、用“差重法”准确称取称量范围的Na2CO3于洁净的锥形瓶中;
3、在锥形瓶中加入约30 cm3纯水,在温水浴中加热,摇动使之完全溶解,并滴加2~3滴甲基橙;
4、用50 cm3的酸式滴定管装入标准盐酸,调节好刻度,记下初读数后,左手控制玻璃塞,右手摇动锥形瓶使锥形瓶中液体作圆周运动,控制好滴速,当黄色—变为橙色(即为滴定终点),停止滴定,取下滴定管,正确读数(终读数)并记下读数,读数结果小数点后保留两位。
5、再分别称取称量范围的Na2CO3于洁净的锥形瓶中,按上述方法重复两次。
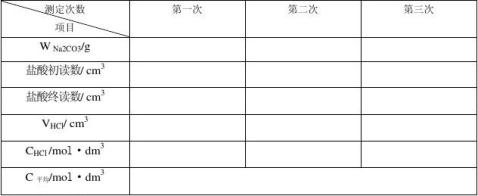
五、数据记录与数据处理:
六、结果与讨论
实验注意事项:
1、计算Na2CO3的称量范围Na2CO3 + 2HC l = 2NaCl + CO2 + H2O
106g 2mol
W(g) 0.2×(20~30)/1000)mol
W =0.2120~0.3180g即称取(0.2~0.3g)
2.用差量法准确称取(0.2~0.3g)Na2CO3于锥形瓶中
(1)将锥形瓶用自来水冲洗,再用纯水淌洗三遍。(2)称量瓶的取放要用纸条,不能用手直接拿。(3)用差量法称一份在称量范围的Na2CO3与锥形瓶中(4)不能有Na2CO3洒在锥形瓶外(5)记录数据(四位有效数字)
3.配制Na2CO3溶液
(1)在锥形瓶中加入30 cm3纯水(2)在温水浴中加热,摇动使之完全溶解
4. 酸式滴定管的准备
(1)检查玻璃塞是否配套,有无橡皮套。
(2)用自来水冲洗,然后装满自来水后放在滴定管架上约2分钟,观察有无漏水,若漏水更换(或重新涂油脂)。
(3)若不漏水用自来水、纯水分别淌洗三遍,再用盐酸标准溶液溶液淌洗三遍(每次5~10 cm3左右)。(三三步骤)
(4)将盐酸标准溶液装入洗好的酸式滴定管中,装到零刻度线以上。
(5)检查滴定管玻璃塞上下有无气泡,若有气泡,把气泡排出。
(6)将盐酸标准溶液弯月面最低点调节到零刻度或零刻度以下。
5. 盐酸标准溶液的标定
(1)往锥形瓶中加入1~2滴甲基橙指示剂
(2)记录滴定前滴定管内盐酸标准溶液体积读数,读数时保持滴定管垂直,数据的小数点后有两位。
(3)左手控制玻璃塞,右手摇动锥形瓶使锥形瓶中液体向一个方向作圆周运动,边滴边摇,刚开始滴定时滴定速度可以较快,当黄色消失较慢时,一滴一滴的滴定,滴一滴摇匀了,观察颜色,直到溶液由红色变为橙色,停止滴定。滴定过程中盐酸标准溶液不能洒到锥形瓶外。
(4)记录滴定后滴定管内盐酸标准溶液体积读数,读数时保持滴定管垂直,记录数据,小数点后有两位。
6、电子天平使用方法及注意事项
注意事项:
(1)FA/JA1004型电子天平最大称量为100g,称量时不能超过此值;
(2)腐蚀物不能与称量盘接触;
(3)不能随意开关电子天平;
(4)其它功能键(RNG UNT INT ASD CAL PRT COU)供维修人员调校天平使用,未经允许,不得使用;
(5)由于天平在使用时需要较长时间预热,故请同学们在使用后不用关机;
使用方法:
(1)轻按一下“ON

2秒后,显示天平的型号
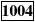

后是称量模式
(2)置称量瓶或容器于称量盘上(最好是正中间)(3)然后
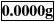
轻按去皮键,显示消隐,随即出现全零状态,容器质量已去除,即“去皮重”:
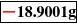
再轻按去皮键,显示器为全零,即天平清零;当从容器中倒出一部分,再把容器放回称量室,就出现一个负值,此负值即为
从容器中倒出的那部分的质量(在实际操作过程中,我们就是这样称量的)
(4)从干燥器中取称量瓶的方法是:左手护着干燥器的主体,右手握住干燥器的盖子,向一个方向平推即打开了干燥器的盖子(不能向上直接提),用一张纸条取出称量瓶(不能用手直接拿称量瓶),然后打开电子天平的门,把称量瓶放到称量室,再把电子天平的门关好,准备称量。
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
厨艺大赛总结
20xx年x月x日经管分院生活部举办了厨艺大赛,活动举办的非常成功,很受同学们的欢迎,一些10级的同学虽然现在已经迈向了学业的紧张…
-
广播站年度工作总结最终版
广播站工作总结院团委广播站是一个有组织,有创新意识的部门,是学院的传播信息的渠道,把学院最新最重要的信息传递给广大师生,同时是完成…
-
银行反假币宣传月工作总结
近日来,长白县农村信用社按照县人民银行的《20xx年反假货币宣传周活动实施方案》精神的要求,认真组织全辖农村信用社系统开展反假货币…
-
关于开展食品药品安全科普宣传活动的工作总结
为进一步宣传药品安全工作对人民群众身体健康和生命安全的重要性,普及药品安全科学知识,提高广大消费者自我保护的能力,营造人人关注、支…
-
工会送温暖活动总结
温宿县克孜勒镇中学工会开展送温暖活动总结我校工会为深入学习贯彻落实党的十七届五中全会精神,把党和政府的关怀和工会组织的温暖送到我校…