大学化学实验——EDTA标准溶液的配制和标定
EDTA标准溶液的配制和标定
一.实验目的
1.了解EDTA标准溶液的配制和标定原理。
2.掌握常用的标定EDTA方法
二.实验原理
Zn2+ + H2Y2- ZnY2- + 2H-
金属指示剂:M2+ + In MIn
颜色甲 颜色乙
滴入EDTA时,金属离子逐步被络和,当达到反应的化学计量点时,已与指示剂络和的金属离子被EDTA夺出,释放出指示剂,这样就引起溶液的颜色变化
缓冲溶液的作用:在络和滴定过程中,随着络合物的生成,不断有H+释出,因此,溶液的酸度不断增大。酸度增大的结果,(1)不仅降低了络和物的条件稳定常数使滴定突跃减少,(2)而且破坏了指示剂变色的最适宜酸度范围,导致产生很大的误差。因此,络和滴定中通常需要加入缓冲溶液来控制溶液的pH值。
三.实验步骤
1.0.01mol·L-1zn2+标准溶液
清洗 烘干 准确称取0.15-0.2g 溶样 定溶 。
2. 0.01mol·L-1EDTA溶液的配制(m=CVM公式计算) 加热
3.EDTA标准溶液浓度的标定
1.以铬黑T为指示剂。 酒红色变为纯蓝色
2.以二甲酚橙为指示剂。 红紫色变为纯黄色
3. 注意滴定速度不宜过快, 平行 滴定三份。
四 实验记录
mZn= CZn=
EDTA浓度的标定

五 思考题
缓冲溶液是对一种溶液的酸度起稳定作用的溶液。向该溶液中加入少量酸或碱;或因化学反应产生少量酸或碱,或将溶液稍加稀释,溶液的酸度能基本维持不变。
滴定误差
在滴定分析中,相对误差应小于0.2%。因此,如何减小滴定分析的误差,提高分析的准确度,是值得我们注意的问题。
1.称量误差
称取的量越大,称量的相对误差越小。为了将误差控制在允许范围内,试样的称取量应大于或等于0.1g。
2.读数误差
在滴定分析中常用滴定管、移液管和容量瓶等来测量溶液的体积,读数不准所引起的误差是滴定分析误差的来源之一。
如:滴定管读数是估计值,常有±0.02ml的绝对误差,因此读数的相对误差的大小取决于滴定剂体积的用量。标准溶液的浓度不能过浓或过稀;过浓时相差一滴就使滴定结果产生较大误差,过稀终点不灵敏,因此浓度应控制在0.01~0.1mol/L为宜。按±0.1%的相对误差计算,消耗标准溶液的总体积应在20ml以上。
所以,在滴定中标准溶液用量应控制在20ml~30ml之间,对于同一实验的平行测定应尽量用同一段滴定管。
3.终点误差
由滴定终点和化学计量点不一致所引起的误差称为终点误差,用TE表示。一般用相对误差表示,如果用c表示滴定剂换算到终点的浓度,c,表示被滴定物质换算到终点的浓度,V为终点的体积,则终点误差TE为:(可不讲)
TE%=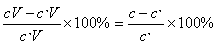
当c>c,时,误差是正值;
当c<c,时,误差是负值;
当c=c,时,误差等于零。
第二篇:PPT-EDTA标准溶液的配制和标定










-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
村级组织换届选举总结
Xx县村级组织换届选举总结根据市委组织部的统一安排部署,从今年x月下旬开始,我县对全县256个农村党组织进行了集中统一换届。目前已…
-
行政审批科工作总结
在局领导的关心和支持下,行政审批科已于今年二月正式成立,原政务分中心的职能也进行了相应调整。今年来,全科同志紧紧围绕“创新国土管理…
-
麦肯锡卓越工作方法总结
在只看到这本书名字的时候,或许我们大家看到的是一样的那就是“工作方法”这四个字,也就是说这本书是在讲一种工作方法,而这种工作方法的…
-
20xx地税半年工作总结
20xx年上半年,我们梅川地税局在市局和梅川镇党委、政府的正确领导下,认真贯彻落实全市地税工作会议精神,坚持用科学发展观统领地税各…
-
20xx个人工作总结-仓库主管
20xx—个人工作总结转眼20xx年即将过去,迎来20xx年新的开始,回想过去,面对眼前,展望未来!有进步的喜悦,亦有工作中失误的…