实验:EDTA标准溶液的配制与标定
配位滴定法:EDTA(0.05mol/L)标准溶液的配制与标定
一、实验目的
1、了解EDTA标准溶液的配制和标定原理。
2、掌握常用的标定EDTA的方法。
3、本实验需16学时。
二、仪器与试剂
仪器:分析天平、托盘天平、烧杯、酸式滴定管(50mL)、玻棒、胶头滴管、量筒、容量瓶、称量瓶、锥形瓶
试剂:固体ZnO、HCl(20%)、氨水溶液(10%)、铬黑T(5g/L)、NH3-NH4Cl缓冲溶液(pH≈10)、蒸馏水
三、实验原理
EDTA:乙二胺四乙酸H4Y(本身是四元酸),由于在水中的溶解度很小,通常把它制成二钠盐(Na2H2Y·2H2O),也称为EDTA或EDTA二钠盐。与金属离子形成螯合物时,络合比皆为1:1。
EDTA因常吸附0.3%的水分且其中含有少量杂质而不能直接配制标准溶液,通常采用标定法制备EDTA标准溶液。
标定EDTA的基准物质有纯的金属:如Cu、Zn、Ni、Pb,以及它们的氧化物及某些盐类:如CaCO3、ZnSO4.7H2O、MgSO4.7H2O。
金属离子指示剂:在络合滴定时,与金属离子生成有色络合物来指示滴定过程中金属离子浓度的变化。
M + In ←→ MIn
颜色甲 颜色乙
滴入EDTA后,金属离子逐步被络合,当达到反应化学计量点时,已与指示剂络合的金属离子被EDTA夺出,释放出指示剂的颜色:
MIn + Y ←→ MY +In
颜色乙 颜色甲
四、实验步骤
1、ZnCl2标准溶液的配制
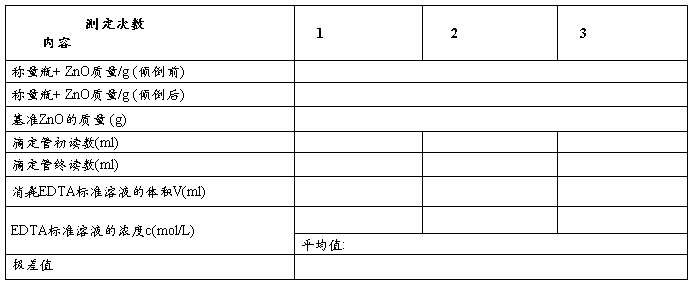
称取1.5g于850±50℃高温炉中灼烧至恒重的工作基准试剂ZnO于100mL小烧杯中,用少量水润湿,加入20 mL HCl(20%)溶解后,定量转移至250mL容量瓶中,用水稀释至刻度,摇匀。
2、EDTA标准滴定溶液的标定
移取25.00mL上述溶液于250mL的锥形瓶中,加75mL水,用氨水溶液(10%)调至溶液pH至7~8,加10mL NH3-NH4Cl缓冲溶液(pH≈10)及5滴铬黑T(5g/L),用待标定的EDTA溶液滴定至溶液由紫色变为纯蓝色,平行测定3次,计算EDTA标准滴定溶液的浓度c(EDTA),单位mol/L。
注: [M(ZnO)=81.39 g/mo1]。
计算公式 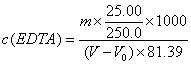
五、数据记录与处理
第二篇:07EDTA标准溶液的配制与标定
一、授课计划

二、课时教学内容

-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验九 EDTA标准溶液的配制与标定
实验七EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定2掌握使用铬黑T指示剂的条件和正确判断终点的方法二实…
-
实验六 EDTA标准溶液的配制与标定(上课)
实验六EDTA标准溶液的配制与标定一实验目的1掌握配位滴定的原理了解配位滴定的特点2学会EDTA标准溶液的配制标定及稀释3学会铬黑…
-
下周实验 EDTA标准溶液的配制与标定
EDTA标准溶液的配制与标定实验目的1掌握EDTA标准溶液的配制与标定方法2学会判断配位络合滴定的终点3了解缓冲溶液的应用4进一步…