EDTA标准溶液的配制和标定
实验十八 EDTA标准溶液的配制和标定
1.实验目的
(1) 掌握络合滴定的原理,了解络合滴定的特点;
(2) 学习EDTA标准溶液的配制和标定方法;
(3) 了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。
2.实验原理
乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配制标准溶液。标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu 、MgSO4·7 H2O等。
用于测定Pb2+、 Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。以二甲酚橙作指示剂,在pH=5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。其变色原理可表达如下:
XO(黄色)+ Zn2+__ZnXO(紫红色)
ZnXO(紫红色)+EDTA__ZnEDTA(无色)+XO(黄色)
EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量及测定水的硬度,最好选用CaCO3做基准物标定。这样基准物和被测组分含有相同的组分,使得测定条件一致,可以减少误差。首先将CaCO3用盐酸溶解后,制成Ca2+标准溶液,调节酸度至pH>12.5时,以钙黄绿素-百里酚酞作混合指示剂,用EDTA标准溶液滴至由绿色荧光色消失。
3.仪器和药品
仪器:电子天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。
药品:
(1)以ZnO为基准物时所用试剂:ZnO(A.R)、乙二胺四乙酸二钠(A.R)、六次甲基四胺:20%(m/v)、二甲酚橙指示剂(0.2%)、盐酸(1+1)。
(2)以CaCO3为基准物时所用试剂:碳酸钙:固体,一级试剂(G.R);盐酸(1+1);钙黄绿素-百里酚酞混合指示剂(1g钙黄绿素和1g百里酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于小广口瓶中);氢氧化钾溶液:20%(m/v);乙二胺四乙酸二钠(A..R);
4.实验步骤
(1)0.015mol/LEDTA标准溶液的配制
称取5.6g乙二胺四乙酸二钠(A.R)置于400ml烧杯中,加入约200mL水及2小片氢氧化钠(A..R)加热溶解(必要时过滤),冷却后,用水稀释至1L,摇匀;
(2)以ZnO为基准物标定EDTA溶液
Zn2+标准溶液的配制 准确称取ZnO基准物0.35~0.5g于150mL烧杯中,用数滴水润湿后,盖上表面皿,从烧杯嘴中滴加10mL1+1盐酸,待完全溶解后冲洗表面皿和烧杯内壁,定量转移至250mL容量瓶中,加水稀释至刻度,摇匀,计算其准确浓度。
EDTA标准溶液的标定 用移液管移取Zn2+标准溶液25.00mL于250mL锥形瓶中,加水20mL,加两滴二甲酚橙指示剂,然后滴加六次甲基四胺溶液直至溶液呈现稳定的紫红色,再多加3mL,用EDTA 溶液滴至溶液由紫红色刚变为亮黄色即达到终点。
(3)以CaCO3为基准物标定EDTA溶液
钙标准溶液的配制 准确称取105~110℃干燥过的约0.6g CaCO3于150mL烧杯中,加水50mL,盖上表面皿,从烧杯嘴滴加5mL1+1盐酸,待CaCO3完全溶解后,加热近沸,冷却后淋洗表面皿 ,再定量转入250mL容量瓶中,稀释定容,摇匀。
②EDTA标准溶液的标定 用移液管移取25.00mL钙标准溶液于400mL烧杯中,加水150mL,在搅拌下加入10mL20%KOH溶液和适量的钙黄绿素-百里酚酞混合指示剂,此时溶液应呈现绿色荧光,摇匀后用EDTA标准溶液滴至溶液的绿色荧光消失突变为紫红色即为终点。
5.思考题
(1) EDTA标准溶液和锌标准溶液的配制方法有何不同?
(2) 在配制EDTA溶液时,为什么要在溶液中加入两小片氢氧化钠?
(3) 为什么不能将热溶液直接转移至溶量瓶中?
(4) 用ZnO标定EDTA溶液时,为什么要加20%六次甲基四胺溶液?
实验十四 水的硬度测定
1. 实验目的
(1)进一步掌握络合滴定法测定的原理和方法
(2)了解测定水的硬度的意义和硬度的表示方法
2. 实验原理
硬水是指含有钙镁盐类的水。硬度有暂时硬度和永久硬度之分。
暂时硬度是指水中含有钙、镁的酸式碳酸盐,遇热既成碳酸盐沉淀而失去其硬度。反应如下:
Δ
 Ca(HCO3)2 CaCO3+H2O +CO2↑
Ca(HCO3)2 CaCO3+H2O +CO2↑

 Mg(HCO3)2 MgCO3
Mg(HCO3)2 MgCO3 + H2O +CO2 ↑
+ H2O +CO2 ↑
永久硬度—水中含有钙、镁的硫酸盐、氯化物、硝酸盐。在加热时也不沉淀,但在锅炉运行温度下,溶解度低的可析出成为锅垢。
暂时硬度和永久硬度的和称为水的总硬度。由镁离子形成的硬度称为“镁硬”,由钙离子形成的硬度称为“钙硬”。
水的硬度是饮用水、工业水指标之一,测定水硬的标准方法是络合滴定法。钙硬测定原理与用碳酸钙标定EDTA浓度相同。总硬则以铬黑T为指示剂,控制溶液的浓度为pH≈10,以EDTA 标准溶液滴定之,由EDTA溶液的浓度和用量,可算出水的总硬,由总碱减去钙硬即为镁硬。
水的硬度有多种表示方法,随各国的习惯而有所不同。我国国家标准(GB12145-89)规定水的硬度以“mmol?L-1”表示,它是以1/2 CaO 或(1/2CaCO3)为基本单元,1L水中氧化钙(或碳酸钙)的物质的量。因此水的硬度应该按下式计算:
X=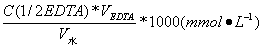 (1)
(1)
式中 X——水的总硬度;
C(1/2EDTA)——以1/2EDTA为基本单元的EDTA标准溶液的浓度;mol?L-1;
VEDTA——滴定消耗的EDTA 溶液的体积,m L;
V水——所取水样的体积,mL。
钙硬为
Y= (2)
(2)
式中 M(1/2CaO)——以1/2CaO为基本单元的摩尔质量,g?mol-1;
VEDTA’——滴定钙硬时消耗的EDTA 溶液体积,ml ;
其余符号与式(1)相同。
镁硬为
Z=
式中 M(1/2MgO)是以1/2MgO为基本单元的摩尔质量(mg?L-1),其余符号与式(1)式(2相同。
3. 仪器与试剂
仪器:移液管,锥形瓶,酸式滴定管
药品:
(1) EDTA标准溶液:C(1/2EDTA)=0.02mol?L-1 。配制与标定参考前一个实验;
(2) 氢氧化钾溶液:20%(m/v);
(3) 氨-氯化铵缓冲溶液:pH≈10;
(4) 钙黄绿素——百里酚酞混合指示剂:(见前EDTA的标定);
(5) 铬黑T指示剂:1g指示剂溶于75ml三乙醇胺和25ml无水乙醇中。
4. 实验步骤
(1) 总硬的测定:量取澄清的水样100ml,(用什么量器?为什么?)放入250ml或500ml锥形瓶中,加入5ml氨——氯化铵缓冲溶液,摇匀,再加入1-2滴铬黑T指示剂,再摇匀,此时溶液呈酒红色,以0.01mol?L-1标准溶液滴定至纯兰色,即为终点。
(2) 钙硬的测定:量取澄清水样100ml ,放入250ml 烧杯中,加4ml 20%氢氧化钾溶液和适量钙黄绿素——百里酚酞指示剂,此时溶液应出现绿色荧光,立即用0.01mol?LEDTA溶液滴定到溶液的绿色荧光消失并突变为紫红色,即为终点。
(3) 镁硬的测定:由总硬减去钙硬即算做镁硬。
5. 注释
①此取样量适于硬度按碳酸钙计算为10~250mg?L-1的水样。若硬度大于250 mg?L-1碳酸钙,则取样量相应减少;若水样不是澄清的,则必须过滤之。过滤所用的仪器和滤纸必须是干燥的。最初和最终的滤液宜弃取,非属必要,一般不用纯水稀释水样。 如果水中有铜、锌、锰等离子存在,则会影响测定结果。铜离子存在时会使滴定终点不明显;锌离子参与反应,使结果偏高;锰离子存在时,加入指示剂后马上变成灰色,影响滴定。遇此情况,可在水样中加入1ml2%硫化钠溶液,使铜离子成硫化铜沉淀,过滤之;锰的影响可借加盐酸羟胺溶液消除;若有Fe3+ 、Al3+离子存在,可用三乙醇胺掩蔽。
②硬度较大的水样,在加缓冲液后常析出碳酸钙、碱式碳酸镁微粒,使滴定终点不稳定。遇此情况,可于水样中加适量稀盐酸溶液,摇匀后再调至近中性,然后加缓冲液,则终点稳定。
6. 思考题
(1) 如果对硬度测定中的数据要求保留两位有效数字,应如何量取100ml水样?
(2) 用EDTA 法测定水硬时,哪些离子的存在有干扰?如何消除?
实验报告十八
EDTA标准溶液的配制和标定
班级 学号 姓名
一、实验目的
二、实验原理
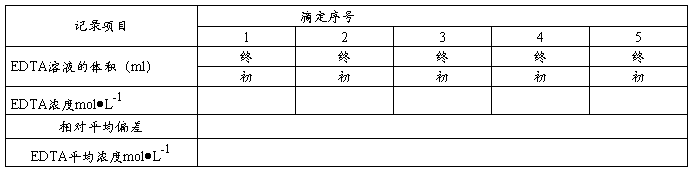
三、数据处理
基准物 质量
四、 问题与讨论
实验报告十四
水的硬度测定
班级 学号 姓名
一、 实验目的
二、 实验原理
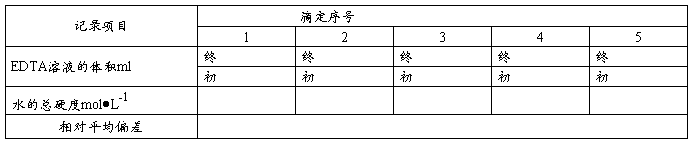
三、 数据处理
C(EDTA)=

四、问题与讨论
第二篇:EDTA标准溶液配制、标定(方便操作版)
EDTA标准滴定溶液标定及水硬度测定
一、目的要求
1.了解EDTA标准溶液标定的原理。
2.掌握配制和标定EDTAB标准溶液的方法。
二.仪器
1.1 50mL 滴定管一支
1.2 50mL 移液管一支
1.3 250mL 容量瓶一只
1.4 250mL 锥形瓶三只
1.5 25mL 量筒一只
1.6 50mL 烧杯一只
1.7 10cm 表面皿一块
三、原理
乙二胺四乙酸二钠盐(习惯上称EDTA)是一种有机络合剂,能与大多数金属离子形成稳定的1∶1螯合物,常用作配位滴定的标准溶液。
EDTA在水中的溶解度为120g/L,可以配成浓度为0.3mol/L以下的溶液。EDTA标准溶液一般不用直接法配制,而是先配制成大致浓度的溶液,然后标定。用于标定EDTA标准溶液的基准试剂较多,例如Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Ni、Pb等。
用氧化锌作基准物质标定EDTA溶液浓度时,以铬黑T作指示剂,用pH=10的氨缓冲溶液控制滴定时的酸度,滴定到溶液由紫色转变为纯蓝色,即为终点。
四、试剂
1. 称取3.7g乙二胺四乙酸二钠盐(Na2H2Y·2H2O,相对分子量372.2)加热溶解后稀释至1升,储于聚乙烯塑料瓶中。
2.氨水-氯化铵缓冲液(pH=10):称取5.4g氯化铵,加适量水溶解后,加入35mL氨水,再加水稀释至100mL。
3.铬黑T指示剂:称取0.1g铬黑T,加入10g氯化钠,研磨混合。
4.40%氨水溶液:量取40mL氨水,加水稀释至100mL。
5.氧化锌(基准试剂)。
6.盐酸
五、步骤
1. 0.01mol·L-1EDTA溶液的配制
称取乙二胺四乙酸二钠盐(Na2H2Y·2H2O)4g,加入1000mL水,加热使之溶解,冷却后摇匀,如混浊应过滤后使用。置于玻璃瓶中,避免与橡皮塞、橡皮管接触。贴上标签。
2. 锌标准溶液的配制
准确称取约0.16g于800℃灼烧至恒量的基准ZnO,置于小烧杯中,加入0.4mL盐酸,溶解后移入200mL容量瓶,加水稀释至刻度,混匀。
EDTA溶液浓度的标定
用移液管移取25.00mLZn2+溶液于锥形瓶中,滴加甲基红指示剂1滴,用(1+2)氨水调节Zn2+溶液至微黄色。再加20mL水和10mLNH3-NH4CI缓冲溶液,摇匀。加3滴铬黑T指示剂,用EDTA标准滴定溶液滴定至溶液由紫红色变为纯蓝色,即为终点。平行滴定3次。根据滴定用去的EDTA体积和ZnO质量,计算EDTA标准滴定溶液的准确浓度。
六、结果计算
世界各国表示水硬度的方法不尽相同,我国采用m moll-1或mg L-1(CaCO3)为单位表示水的硬度。
水的总硬度= 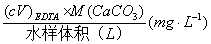
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
20xx年骨科护士年终总结
一、全科人员在政治上认真学习邓小平理论和******三个代表精神,树立正确的世界观、人生观、价值观,发扬党的优良传统,牢固树立一切…
-
《阳光体育冬季长跑活动》总结
根据教育部、国家体育总局、共青团中央《关于开展第八届亿万学生阳光体育冬季长跑活动的通知》精神,我校于20xx年x月x日至20xx年…
-
联通公司20xx年员工个人工作总结
时光飞逝,不知不觉中又迎来了新的一年,在即将过去的20xx年里,我在公司领导及各位同事的关心与帮助下,顺利的完成了相应的工作,现对…
-
党员集中教育培训工作总结
赫章县国土资源局党员集中教育培训及民主评议党员工作总结根据县委组织部和机关党委20xx年度党员集中教育培训及民主评议党员工作安排意…
-
20xx年水务局应急管理工作总结
20xx年度我局应急管理工作,在市委、市政府的直接领导和市应急办、上级主管部门的具体指导下,全面贯彻安全第一,常备不懈,以防为主,…