EDTA标准溶液的配制和标定
EDTA标准溶液的配制和标定
1 实验目的
1.1 学习EDTA标准溶液的配制和标定方法。
1.2 掌握络合滴定的原理,了解络合滴定的特点。
1.3 熟悉钙指示剂或二甲酚橙指示剂的使用及其终点的变化。
2 实验原理
2.1 乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,常温下其溶解度为0.2g·L-1,在分析中不适用,通常使用其二钠盐配制标准溶液。乙二胺四乙酸二钠盐的溶解度为120g·L,可配成0.3mol·L以上的溶液,其水溶液pH=4.8,通常采用间接法配制标准溶液。
标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Hg、Ni、Pb。等。通常选用其中与被测组分相同的物质作基准物,这样滴定条件较一致。
EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量,则宜用CaCO3为基准物。首先可加HCl溶液与之作用,其反应如下:
CaCO3+2HCl═CaCl2+H2O+CO2↑
然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。吸取一定量钙标准溶液,调节酸度至pH≥12,用钙指示剂作指示剂以EDTA滴定至溶液从酒红色变为纯蓝色,即为终点,其变色原理如下:钙指示剂(常以H2Ind表示)在溶液中按下式电离:
H3Ind═2H++HInd2-
在pH≥12溶液中,HInd与Ca离子形成比较稳定的络离子,反应如下:
HInd2-+Ca2+═CaInd-+H+ 2-2+-1-1
纯蓝色 酒红色
所以在钙标准溶液中加入钙指示剂,溶液呈酒红色,当用EDTA溶液滴定时,由于EDTA与Ca2+离子形成CaInd-络离子更稳定的络离子,因此在滴定终点附近,CaInd-络离子不断转化为较稳定的CaY2-络离子,而钙指示剂则被游离了出来,其反应可表示如下:
CaInd-+H2Y2-═CaY2-+ HInd2-+H2O
由于CaY离子无色,所以到达终点时溶液由酒红色变成纯蓝色。
用此法测定钙,若Mg2+离子共存(在调节溶液酸度为pH≥12时,Mg2+离子将形成Mg(OH)2沉淀),此共存的少量Mg2+离子不仅不干扰钙的测定,而且会使终点比Ca2+离子单独存在时更敏锐。当Ca2+、Mg2+离子共存时,终点由酒红色变到纯蓝色,当Ca2+离子单独存在时则由酒红色变紫蓝色,所以测定单独存在的Ca2+离子时,常常加入少量Mg2+离子溶液。
EDTA若用于测定Pb、Bi离子,则宜以ZnO或金属锌为基准物,以二甲酚橙为指示剂,在pH=5~6的溶液中,二甲酚橙为指示剂本身显黄色,与Zn离子的络合物呈紫红色。EDTA与Zn离子形成更稳定的络合物,因此用EDTA溶液滴定至近终点时,二甲酚橙被游离出来,溶液由紫红色变成黄色。
络合滴定中所用的蒸馏水,应不含Fe、Al、Cu、Ca、Mg等杂质离子。
3 器皿和试剂
酸式滴定管;乙二胺四乙酸二钠,CaCO3,氨水(1:1),镁溶液(溶解1克MgSO4·7H2O于水中,稀释至200mL),NaOH溶液(10%溶液),钙指示剂(固体指示剂),二甲酚橙指示剂(0.2%水溶液)
4 实验步骤
4.1 0.02mol·LEDTA溶液的配制:
在台称上称取乙二胺四乙酸二钠7.6克,溶解于300~400mL温水中,稀释至1升,如混浊,应过滤,转移至1000mL细口瓶中,摇匀,贴上标签,注明试剂名称、配制日期、配制人。 -13+3+2+2+2+2+2+2+3+2-
4.2 以CaCO3为基准物标定EDTA溶液
4.2.1 0.02mol·L-1钙标准溶液的配制:
置碳酸钙基准物于称量瓶中,在110?C干燥2小时,冷却后,准确称取0.2~0.25g碳酸钙于250mL烧杯中,盖上表面皿,加水润湿,再从杯嘴边逐滴加入数毫升淋洗入杯中,待冷却后转移至250mL容量瓶中,稀释至刻度,摇匀,贴上标签,注明试剂名称、配制日期、配制人。
4.2.2 用钙标准溶液标定EDTA溶液:
用移液管移取25.00mL标准钙溶液于250mL锥形瓶中,加入约25 mL水,2mL镁溶液,10mL10%NaOH溶液及约10mg(米粒大小)钙指示剂,摇匀后,用EDTA溶液滴定至溶液从红色变为蓝色,即为终点。
4.3 以ZnO为基准物标定EDTA溶液
4.3.1 锌标准溶液的配制:
准确称取在800?C~1000?C灼烧(需20min以上)过的基准物ZnO 0.5~0.6g于100mL烧杯中,用少量水润湿,然后逐滴加
-1入6mol·LHCl,边加边搅至完全溶解为止,然后,定量转移入250mL容量瓶中,稀释至刻度并摇匀,贴上标签,注明试剂名称、配制日期、配制人。
4.3.2 用锌标准溶液标定EDTA溶液:
移取25.00mL锌标准溶液于250mL锥形瓶中,加约30mL水,2~3滴二甲酚橙为指示剂,先加1:1氨水至溶液由黄色刚变为橙色,然后滴加20%六次甲基四胺至溶液呈稳定的紫红色再多加3mL,用EDTA溶液滴定至溶液由红紫色变成亮黄色,即为终点。
5 思考题
5.1 为什么通常使用乙二胺四乙酸二钠盐配制EDTA标准溶液,而不用乙二胺四乙酸?
5.2 以HCl溶液溶解CaCO3基准物时,操作中应注意些什么?
5.3 以CaCO3为基准物标定EDTA溶液时,加入镁溶液的目的是什么?
第二篇:实验九 EDTA标准溶液的配制与标定
实验七 EDTA标准溶液的配制与标定
一、实验目的
1、掌握EDTA标准溶液的配制与标定
2、掌握使用铬黑T指示剂的条件和正确判断终点的方法
二、实验原理
EDTA是常用的螯合滴定剂,常用Zn,ZnO,CaCO3等基准物来标定其准确浓度。为了减少测定误差提高分析结果的准确度,尽可能使标定条件与测定条件一致。如测定Ca2+、Mg2+,可用CaCO3为基准物标定,指示剂用铬黑T,在pH为10的氨性缓冲液中进行标定。为提高滴定终点变色的敏锐性,在氨性缓冲液中加入一定量的MgY2-。滴定过程如下:
滴 定 前:Ca2+ + MgY2- = CaY2- + Mg2+
Mg2+ + EBT = Mg-EBT (酒红色)
滴 定 中:Ca2+ + H2Y2- + 2OH- = CaY2- + 2H2O
滴定终点:Mg-EBT + H2Y2- + 2OH- = MgY2- + 2H2O + EBT (纯蓝色)
当溶液颜色由酒红色恰好变为纯蓝色时,表示滴定终点到达。加入的MgY2-,最后还是生成等量的MgY2-,对滴定的结果无影响。
三、试剂
Na2H2Y?2H2O;CaCO3(A.R)120℃干燥2h,置干燥器备用;EBT指示剂:0.5g铬黑T加75 ml三乙醇胺,25ml乙醇溶解而成;1﹕1HCl溶液;氨性缓冲液(pH≈10):54g的NH4Cl溶于少量水中,加394ml浓氨水,加入按下法配好的MgY溶液,加水稀释至1升。
MgY盐的配制:称0.25g的MgCl2?6H2O于烧杯中,用少量水溶解后转移入100ml容量瓶,加水至刻度,摇匀。准确吸取50.00ml于锥瓶,加5ml NH3-NH4Cl缓冲液,4~5d EBT指示剂,用0.02mol/L的EDTA溶液滴定至溶液由酒红色变为纯蓝色,记下所消耗的EDTA体积V。取Vml EDTA加入容量瓶剩余的镁溶液中,摇匀,即MgY溶液。将此溶液全部倒入上述缓冲液中。
四、实验步骤
1、0.01 mol/L EDTA溶液的配制 称取2g的EDTA于小烧杯中,加入少量水,加热溶解后,稀释至500ml,贮于塑料瓶中。
2、EDTA溶液的标定 准确称取CaCO3约0.25~0.30g一份,于250ml烧杯中,用少量水润湿,盖上表面皿,从烧杯嘴慢慢滴入10ml 1﹕1的HCl溶液,轻摇,待完全溶解后,小心加热至沸1min,置冷,用少量水清洗表面皿底部和烧杯内壁。完全移入250ml容量瓶中,定容,摇匀,备用。
用移液管准确吸取20.00ml Ca2+溶液三份,各于250ml的锥瓶中,一一加20ml水,10ml氨性缓冲液,4~5d EBT,用EDTA溶液滴定之,终点颜色:酒红色恰好变为纯蓝色。记下消耗的EDTA体积V,按下式求出其浓度。
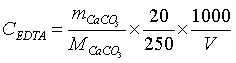
三次测定结果相对平均偏差应小于0.2%。
五、思考题
1、本次实验为什么要加入氨性缓冲液?NH3-NH4Cl起什么作用?MgY盐起什么作用?能否用HAc-NaAc代替NH3-NH4Cl?
2、用1﹕1的HCl溶液溶解固体CaCO3时,为什么要盖上表面皿?之后为什么要用水清洗表面皿底部和烧杯内壁?
实验八 水样的总硬度测定
一、实验目的
1、学习Ca2+、Mg2+共存时分别测定Ca2+、Mg2+含量的方法。
2、学习利用配位滴定原理测定水样的总硬度的方法。
3、进一步熟悉配位滴定的过程和指示剂的应用条件及终点变化。
二、实验原理
水中Ca2+、Mg2+含量是计算水硬度的主要指标。测定水样的总硬度,就是测定水样中Ca2+、Mg2+的总含量。一般先用盐酸酸化并加热,使水样中的HCO3-分解,防止在后面加入碱时生成碳酸盐沉淀而使测量结果偏低。然后再在pH=10的氨性缓冲液中,以铬黑T(EBT)为指示剂,用EDTA标准溶液滴定至终点。
滴 定 前:Mg2+ + EBT(纯蓝色)→ Mg-EBT (酒红色)
滴定过程:Ca2+ +H2Y2- + 2OH-→ CaY2- + 2H2O
Mg2+ + H2Y2- + 2OH-→ MgY2- + 2H2O
滴定终点:Mg-EBT(酒红色)+ H2Y2- + 2OH- = MgY2- + 2H2O + EBT(纯蓝色)
其中稳定性关系:CaY2- > MgY2- > Mg-EBT > Ca-EBT
水的总硬度常以“度(°)”或“ppm”表示。1度(1°)表示在每升水中含有的Ca2+、Mg2+的总量相当于10mg CaO;1ppm 表示在每升水中含有Ca2+、Mg2+的总含量相当于1mgCaCO3。
滴定时水中微量Al3+、Fe3+的干扰可加三乙醇胺掩蔽;Cu2+、Zn2+等重金属离子的干扰可加Na2S或KCN掩蔽。
Ca2+、Mg2+共存时分别测定Ca2+、Mg2+的含量,先将水样用NaOH溶液调节pH>12(pH=12~14),此时Mg2+完全转为Mg(OH)2沉淀,但Ca2+不沉淀,加钙指示剂(NN)用EDTA标准溶液滴定至终点。
滴 定 前:Ca2+ + NN(蓝色) → Ca-NN(红色)
滴定过程:Ca2+ + H2Y2- + 2OH-→ CaY2- + 2H2O
滴定终点:Ca-NN(红色)+ H2Y2- + 2OH-→ CaY2- + 2H2O + NN(蓝色)
从EDTA标准溶液的浓度和用量计算Ca2+、Mg2+的总含量和Ca2+含量,从而求出Mg2+的含量
三、试剂
1:1HCl溶液;0.01 mol/L EDTA标准液;20%三乙醇胺水溶液;2%Na2S溶液;NH3-NH4C l缓冲液(pH=10):20g的NH4Cl溶于少量水,加100ml浓氨水(15mol/L),加水稀释至1升;0.5%铬黑T指示剂:0.5g铬黑T加75ml三乙醇胺,再加25ml无水乙醇;钙指示剂(NN):与无水Na2SO4以1﹕100比例或与NaCl以1﹕100比例混合,研磨均匀混合,贮于棕色瓶中,置干燥器。
四、实验步骤
1、水样的总硬度:水中Ca2+、Mg2+的总量测定
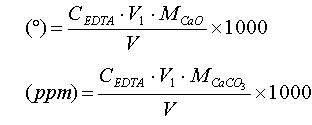 用50ml移液管吸取水样100.00ml两份于两只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化(用刚果红试纸试验,由红变蓝),微沸2min,冷却后加20%三乙醇胺溶液5ml和NH3-NH4Cl缓冲液10ml及2%Na2S溶液1ml,再加4~5d铬黑T指示剂,在相同的条件下以EDTA标准溶液滴定至溶液由酒红色恰好变为纯蓝色,即为滴定终点。记录用去的EDTA体积V1,水的总硬度按下面的式子计算:
用50ml移液管吸取水样100.00ml两份于两只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化(用刚果红试纸试验,由红变蓝),微沸2min,冷却后加20%三乙醇胺溶液5ml和NH3-NH4Cl缓冲液10ml及2%Na2S溶液1ml,再加4~5d铬黑T指示剂,在相同的条件下以EDTA标准溶液滴定至溶液由酒红色恰好变为纯蓝色,即为滴定终点。记录用去的EDTA体积V1,水的总硬度按下面的式子计算:
2、水样中Ca2+、Mg2+的分别测定
另取100.00ml水样二份于二只250ml锥瓶中,各加1﹕1HCl溶液数滴酸化,微沸2min,冷却后加20%三乙醇胺溶液5ml和10% NaOH溶液10ml,使溶液pH值达到12~14,再加约30mg钙指示剂(小心不要加得太多,先加少量,颜色不够红再加),在相同条件下以EDTA标准溶液滴定至溶液由红色恰好变为蓝色,即为滴定终点,记录用去的EDTA体积V2,每升水样中含有的Ca2+或Mg2+的毫克数按下式计算:
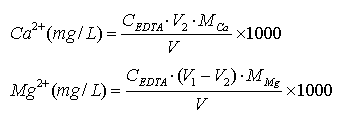
五、注释
1、一般水样的测定因干扰离子浓度很低可以不加掩蔽剂,亦可不必在滴定前酸化处理,直接加缓冲液即可滴定。
2、Mg2+的含量很低时,终点变色不敏锐,可以预先在NH3-NH4Cl缓冲液中加入适量的MgY。
3、三乙醇胺作掩蔽剂掩蔽Fe3+、Al3+,必需在酸性溶液中加入,然后再以碱调节pH值至碱性,否则达不到掩蔽效果。
4、若用KCN掩蔽Cu2+、Zn2+等离子,必须在碱性溶液中使用,若在酸性溶液中使用,则易产生挥发性的HCN剧毒气体,造成空气污染。
5、测定Ca2+时,加NaOH生成Mg(OH)2沉淀,若沉淀量多则可能吸附Ca2+,使Ca2+的测定结果偏低,此时需加入糊精或阿拉伯树胶,以消除吸附现象。糊精浓度为5%,加入约10ml,再以EDTA滴定至指示剂变蓝色。
六、思考题
1、什么叫水的硬度?水的硬度有哪几种表示方法?
2、水样滴定前为何需先用HCl酸化?
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
实验5 盐酸标准溶液的配制和标定
实验五盐酸标准溶液的配制和标定一实验目的1掌握减量法准确称取基准物的方法2掌握滴定操作并学会正确判断滴定终点的方法3学会配制和标定…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
乡镇20xx年上半年服务经济发展环境工作总结
XX镇20xx年上半年服务优化经济发展环境工作总结20xx年上半年,在市纪委监察局的指导下,我镇大力开展“服务环境提升年”活动,为…
-
期中考试总结发言
各位领导、老师、同学们:大家好!今天,学校召开期中考试总结表彰大会,我作为一名普通的年青教师能站在这里发言,感到非常荣幸。在此感谢…
-
健力宝小学教师年度工作总结
一学年很快就过去了,回顾这学年的学习和工作,感受颇多。一年来,我在思想上一直严于律已,时刻用教师的职业道德规范来约束、鞭策自己;在…
-
初中个人工作总结
任职期间工作工作总结自任职以来,我在领导和同事的帮助和指导下,并通过自身的努力,不断克服自己的弱点,摆正自己的位置。在教学上,在其…
-
计算机科学系教学秘书工作总结20xx-20xx第一学期
计算机科学系教学秘书工作总结——20xx-20xx第一学期本学期,我主要承担的是计算机科学系教学秘书工作。对于这个工作,我自始至终…