实验2-5 乙酸乙酯的制备及反应条件探究
实验2-5 乙酸乙酯的制备及反应条件探究
1.实验目标
(1)制取乙酸乙酯,初步体验有机物质的制取过程和特点
(2)探究浓硫酸在生成乙酸乙酯反应中的作用
(3)体验通过实验的方法获取知识的过程
2.预习指导
(1)实验原理
乙酸和乙醇在催化剂存在的条件下加热可以发生酯化反应生成乙酸乙酯。反应方程式为: ,H+可以用作酯化反应的催化剂。由于该反应是可逆反应,为了提高乙酸乙酯的产量,必须尽量使化学反应向有利于生成乙酸乙酯的方向进行,所以乙酸乙酯的制备反应常选用浓硫酸做催化剂,浓硫酸除了做酯化反应的催化剂以外还具有吸水性,可以吸收酯化反应中生成的水,使化学平衡向生成物方向进行,更有利于乙酸乙酯的生成。酯化反应中起催化剂作用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可以,但在实际实验中浓硫酸的用量往往比较多,就是要利用浓硫酸的吸水性。
,H+可以用作酯化反应的催化剂。由于该反应是可逆反应,为了提高乙酸乙酯的产量,必须尽量使化学反应向有利于生成乙酸乙酯的方向进行,所以乙酸乙酯的制备反应常选用浓硫酸做催化剂,浓硫酸除了做酯化反应的催化剂以外还具有吸水性,可以吸收酯化反应中生成的水,使化学平衡向生成物方向进行,更有利于乙酸乙酯的生成。酯化反应中起催化剂作用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可以,但在实际实验中浓硫酸的用量往往比较多,就是要利用浓硫酸的吸水性。
(2)实验技能
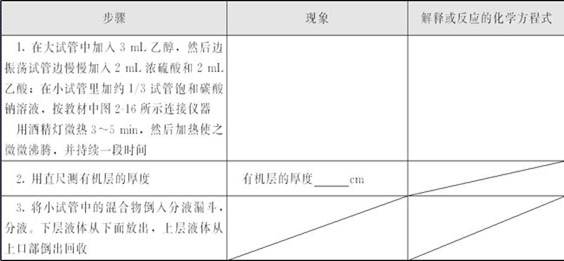
①反应物的混合。加入试剂顺序为乙醇→浓硫酸→乙酸。由于反应物中有浓硫酸,所以加入3 mL乙醇后要边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,防止浓硫酸与乙醇、乙酸混合时放出大量热量,造成液体飞溅。浓硫酸不宜最后滴加,以免在滴加浓硫酸的过程中乙酸与乙醇过早发生反应。
②蒸馏操作。本实验中,制取乙酸乙酯的装置是一种边反应,边蒸馏的简易装置,加热应缓慢,反应温度不宜过高,温度过高时会产生乙醚和亚硫酸等杂质,而且会使过多乙醇、乙酸未经反应就脱离反应体系,降低乙酸乙酯的产率。
③分液操作。反应结束后用直尺测有机层厚度,然后将饱和碳酸钠溶液和蒸出产物导入分液漏斗内分液,取有机层回收。
(3)实验操作要点
①乙酸、乙醇、乙酸乙酯的沸点分别为117.9 ℃,78.5 ℃,77.1 ℃,而乙酸与乙醇反应的温度实际上只有70~80 ℃,因此开始加热时不要加热到沸腾,先用酒精灯微热(约70~80 ℃)3~5 min,使乙酸和乙醇充分反应。然后加热使之微微沸腾,并持续一段时间,将乙酸乙酯蒸出,当加热反应物的试管中液体剩下约1/3时停止加热。
②本实验装置中,收集乙酸乙酯的试管中要预先放入饱和Na2CO3溶液,约占试管容积的1/3。饱和Na2CO3溶液的作用是:冷凝乙酸乙酯;吸收随乙酸乙酯一起蒸发出来的乙酸和乙醇;乙酸乙酯在Na2CO3溶液中的溶解度比在水中更小,容易分层析出,便于分液。
③本实验装置中,导出乙酸乙酯的导气管不要伸到饱和Na2CO3溶液中去,应在饱和Na2CO3溶液上方一点,防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
④“探究浓硫酸在生成乙酸乙酯反应中的作用”实验中,每次实验乙酸和乙醇取用的体积要相同,加热的时间也要相同,这样更有可比性。
⑤比较有、无浓硫酸存在条件下酯化反应的情况时,只取3 mL乙醇和2 mL乙酸加热,用测量的有机层的厚度与乙酸乙酯制备中有机层的厚度比较就行,这样可以节省时间。在相同的时间内,没加浓硫酸的装置几乎没有乙酸乙酯生成。这就证明了浓硫酸在酯化反应中起了催化剂的作用。
⑥比较“在氢离子含量相同的稀硫酸、浓硫酸作用下,酯化反应的快慢”,实验中得到的有机层的厚度明显比没有浓硫酸存在时的厚度大,但是比有浓硫酸存在时得到的有机层的厚度要小,说明H+是酯化反应的催化剂,再结合浓硫酸的特性,可以推测浓硫酸在酯化反应中起了催化、吸水的作用。
3.实验要求
(1)饱和碳酸钠溶液配制:按照室温下的溶解度称取一定质量碳酸钠,溶解在一定的水中配成饱和碳酸钠溶液备用,由教师事先配制好供学生用。
(2)由学生设计并画出乙酸乙酯制取实验的记录表。
参考实验记录表:
(3)由学生画出设计实验的记录表。
参考实验记录表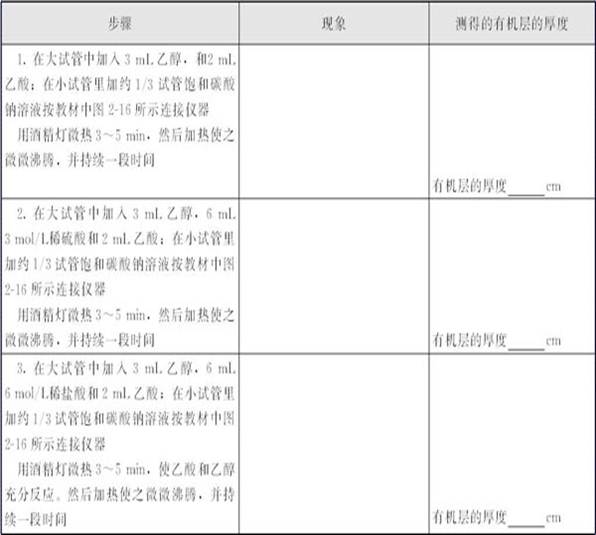
(4)在数据处理上要实事求是,不改动数据。
4.建议与改进
(1)反应前在大试管中预先加入几片干净的碎瓷片,以防溶液暴沸。
(2)为了更好地测量有机层的厚度,可预先向饱和碳酸钠溶液中加入1滴酚酞试液。碳酸钠溶液中加入酚酞后显红色,而上层为无色透明液体,现象非常明显。
(3)本实验最好使用冰醋酸和无水乙醇,尽量不用95%的乙醇,同时采用乙醇过量的办法。

(4)本实验中的导气管选用长一点的好,这样可以更好地冷凝生成物,减少乙酸乙酯的损失。为了减少乙酸乙酯的损失,也可以作如图2-2所示的改进:在球形干燥管下端连接一短玻璃管,将其插入饱和碳酸钠溶液液面下2~3 cm处,这样既可增加冷凝效果,又可洗涤乙酸乙酯,除去乙酸、乙醇、亚硫酸等杂质,同时又能防止由于加热不均匀,造成Na2CO3溶液倒吸入加热反应物的试管中。
(5)在“探究浓硫酸在生成乙酸乙酯反应中的作用”的实验中,由于取用的液体较多,最好选用大一号的试管,以保证加热实验的安全。
5.问题与讨论
(1)物质的量相等的乙酸和乙醇,不能全部转化为乙酸乙酯,因为乙酸和乙醇的酯化反应是可逆反应,当反应达到平衡后,各组分的浓度保持不变,不改变影响化学平衡的条件,乙酸乙酯的含量不会增加。
(2)欲提高生成乙酸乙酯反应的限度,提高乙酸的转化率,可以采取的措施有:增加乙醇的用量,使化学平衡向正反应方向移动,可以提高乙酸的利用率;增加浓硫酸的用量,利用浓硫酸吸水使化学平衡向正反应方向移动;加热将生成的乙酸乙酯及时蒸出,通过减少生成物的浓度使化学平衡向正反应方向移动。
(3)在酯化实验中,三种不同条件下酯化反应进行的快慢不同:没有酸催化时,几乎没有乙酸乙酯生成;浓硫酸催化时生成的乙酸乙酯的量最多,形成相同厚度的有机层时间最短;稀硫酸或稀盐酸催化时,生成少量的乙酸乙酯,形成相同厚度的有机层时间较长,说明浓硫酸在反应 中起了催化剂、吸水剂的作用,而稀硫酸、稀盐酸等无机酸仅起了催化剂的作用,没有促进化学平衡向酯化反应方向移动的作用。由于酯化反应为可逆反应,而稀硫酸、稀盐酸等无机酸催化酯化反应的效果较浓硫酸差,因此探索乙酸乙酯发生水解反应时,不利于酯化反应的稀无机酸催化剂有利于酯的水解。因此,乙酸乙酯的水解用稀无机酸的催化效果比用浓硫酸的效果好;同时由于乙酸乙酯水解生成了乙酸:
中起了催化剂、吸水剂的作用,而稀硫酸、稀盐酸等无机酸仅起了催化剂的作用,没有促进化学平衡向酯化反应方向移动的作用。由于酯化反应为可逆反应,而稀硫酸、稀盐酸等无机酸催化酯化反应的效果较浓硫酸差,因此探索乙酸乙酯发生水解反应时,不利于酯化反应的稀无机酸催化剂有利于酯的水解。因此,乙酸乙酯的水解用稀无机酸的催化效果比用浓硫酸的效果好;同时由于乙酸乙酯水解生成了乙酸: ,如果用无机碱催化乙酸乙酯的水解,会使碱与生成的酸反应,降低生成物乙酸的浓度,从而使化学平衡更容易向水解的方向移动,所以,乙酸乙酯水解的适宜条件为无机酸或无机碱催化,最佳条件是用无机碱催化乙酸乙酯水解。
,如果用无机碱催化乙酸乙酯的水解,会使碱与生成的酸反应,降低生成物乙酸的浓度,从而使化学平衡更容易向水解的方向移动,所以,乙酸乙酯水解的适宜条件为无机酸或无机碱催化,最佳条件是用无机碱催化乙酸乙酯水解。
6.拓展实验
(1)厨房中制胶水
该实验是利用了酪蛋白的性质:酪蛋白不溶于水、酒精及有机溶剂,但溶于碱溶液。在牛奶中酪蛋白约占牛乳总蛋白的80%,室温20 ℃加酸调节脱脂乳的pH值至4.6时酪蛋白就会沉淀,pH升高酪蛋白又会溶解。本实验加醋酸就是为了使酪蛋白沉淀,过滤得到酪蛋白加NaHCO3使pH升高成胶水状。本实验要制得黏合效果好的胶水需注意以下几点:
①最好用白醋,这样制得的胶水为白色黏稠状。②最好用脱脂奶,普通牛奶中有脂类物质,如果用普通牛奶加醋酸,后面过滤的时间较长,而且制得的胶水黏合效果不好。③加小苏打不宜多,否则制得的胶水中小苏打颗粒多。
(2)自制肥皂
本实验可以选用植物油(如花生油、橄榄油、色拉油等),也可以选用猪脂肪加热提炼出来的油脂,具体视原料是否易得、价格是否便宜来决定。
肥皂可按下面方法制取:
称取4~5 g猪油(或8~10 mL植物油),加入10 mL乙醇、5 mL水、2~3 g NaOH固体,放入蒸发皿中加热约5~10 min(期间用玻璃棒取出几滴试样放在试管里,加入4~5 mL水,把试管浸在热水浴中或放在火焰上加热,并不断振荡。如果混合物完全溶解,没有油滴分出,表示皂化已达完全,若还有油滴,需继续加热至没有油滴分出),将蒸发皿放在冷水中水浴冷却,加25 mL饱和NaCl溶液盐析,肥皂因发生凝聚而从混合液中析出,并浮在表面,将混合物倒入烧杯,用纱布滤出固态物质挤干,压成条状晾干即可。
注意:油脂不溶于碱,反应很慢。为了加速皂化的进程,一般都用酒精溶液。酒精既能溶解碱,又能溶解油脂,是油脂和NaOH的共同溶剂,能使反应物融为均一的液体,使皂化反应在均匀的系统中进行并且反应速率加快。NaCl的用量要适中。用量少时,盐析不充分;用量太多时,NaCl混入肥皂中,影响肥皂的固化。
实验2-6 氢氧化铝的制备
1.实验目标
以制备Al(OH)3实验为例,体验制备实验的设计思路、制备条件的选择;学习利用实验室或自然界易得原料设计、制备所需物质,培养自主设计实验的能力。
2.预习指导
(1)实验原理
氢氧化铝是典型的两性氢氧化物,既能与强酸反应又能与强碱反应,反应方程式是:Al(OH)3+3HCl=AlCl3+3H2O;Al(OH)3+NaOH=NaAlO2+2H2O。铝和铝的化合物都可以用来制取氢氧化铝
用较纯净的铝屑制取氢氧化铝有多种方案:
方案一: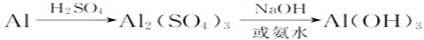
涉及的反应:
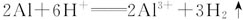 ;
;
 (或
(或 )
)
方案二:
涉及的反应:
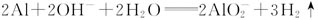 ;
;
 (或
(或 )。
)。
方案三:
涉及的反应: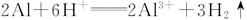 ;
;
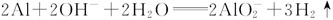 ;
;

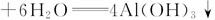
从以上三种方案的试剂用量来看,方案三制备1 mol Al(OH)3需3/4mol H+和3/4 mol OH-,酸与碱的用量少,是最佳方案。
如果选用含Al3+的物质如明矾、Al2(SO4)3等为原料制取氢氧化铝,则可以选用以下方案:或,但是由于氢氧化铝是典型的两性氢氧化物,与强碱会发生反应:,因此选用强碱不好控制,选用弱碱较为理想。
如果选用纯净的氧化铝为原料,可直接用强酸溶解1份氧化铝,用强碱溶解3份氧化铝,然后混合两种溶液,利用盐类水解制备氢氧化铝,与由铝制备氢氧化铝类似,但在实验室该方法效果不理想。
(2)实验技能
①本实验无论采用哪种方法制取氢氧化铝,都要用到过滤操作。提醒学生过滤操作注意事项:过滤时滤纸应大小合适,在漏斗中滤纸的边缘应比漏斗的口稍低,用水湿润滤纸,使滤纸紧贴漏斗的内壁,中间不留气泡,漏斗放置在漏斗架上,调整好高度,使下端紧贴烧杯内壁,下端斜面向外。向漏斗中加入液体须用玻璃棒引流,玻璃棒的下端轻靠在三层滤纸的一边。漏斗中的液体液面要低于滤纸边缘等等。
②复习沉淀洗涤操作。本次实验得到的氢氧化铝需要用热蒸馏水洗涤。洗涤方法:溶液过滤完后,滴加少量热蒸馏水,洗涤原烧杯壁和玻璃棒,再将此溶液倒入漏斗中。待洗涤液过滤完后,再滴加少量热蒸馏水,冲洗滤纸和沉淀。
③复习一定物质的量浓度的氢氧化钠溶液和稀硫酸溶液的配制。本实验中学生如果以铝为原料制取氢氧化铝,需要用到氢氧化钠溶液和稀硫酸溶液,要求学生事先用容量瓶配好所需浓度的溶液。
④掌握测定pH的方法。将pH放在玻璃片或表面皿上,用玻璃棒蘸取溶液点在pH试纸的中部,与标准色卡对比。
(3)实验操作要点
①选用的铝屑需要先除表面上的氧化膜。方法是:在烧杯中加入约50 mL稀NaOH溶液,再放入足量的铝屑。给溶液稍加热,1~2 min后用倾析法倒出稀NaOH溶液,用蒸馏水把铝屑冲洗干净,干燥。称量铝屑的质量,将铝屑分为等质量的四份,备用。
②在盛有1份铝的烧杯中加适量稀硫酸,使铝屑反应至不再有气泡时趁热过滤;在盛有3份铝的烧杯中加入适量浓NaOH溶液,使铝屑反应至不再有气泡时趁热过滤,然后将两次过滤得到的滤液倒在一起反应。
③洗涤沉淀应用热蒸馏水洗涤,反复操作,至溶液的pH为7~8为宜,这样可以最大限度增加杂质的溶解度,制得较纯的Al(OH)3。
④如果时间允许,可以用晾干的办法干燥Al(OH)3。由于Al(OH)3受热分解温度在300 ℃左右,有条件的学校也可以采用低温烘干的办法。
3.实验要求
(1)由学生根据廉价、易得等原则选择原料,确定反应原理;设计可能的反应路径与实验方案,从方法是否简单、经济与安全等方面进行分析和比较,从中选出最佳方案,根据原料特点或最后产物选择合适分离、提纯的方法;列出所需仪器与试剂,写出实验步骤;根据实验的特点,设计实验装置,画出实验装置图。
(2)由学生配制实验所需的溶液,如配制一定物质的量浓度的氢氧化钠溶液和稀硫酸溶液,NaOH溶液的浓度大一点好
(3)如实记录数据,计算出Al(OH)3的产率。
参考实验记录整理与分析表:
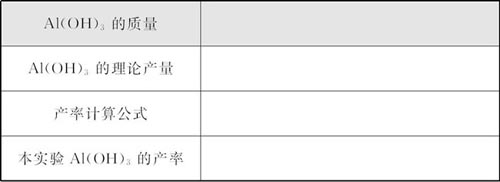
(4)评价该实验主要考虑以下方面:本实验原料获取情况(廉价、易得),实验方案是否为本实验的最佳方案,所需试剂是否经济,分离提纯是否方便,操作是否正确,产率的高低等。
4.建议与改进
(1)由于本实验是自主的开放型实验,建议在实验之前先组织学生进行讨论,让学生比较自己选定的原料和实验方案的优劣,选出几种符合教学实际情况的方案,分成几个小组。有的学生选择的原料虽然容易获得,方案可能也比较完善,但是实际操作时不一定能在两个课时完成,或实验室不能提供所需的条件,不符合学生实验的实际情况。如果完全放开由学生发挥,教师可能无法控制而导致混乱,实际效果不一定好。
(2)建议不要选择Al2O3为原料制取氢氧化铝,因为实验室中的Al2O3很难在稀硫酸和稀NaOH溶液中溶解。教师最好在学生讨论后演示Al2O3与酸、碱反应的情况。
(3)可能会有相当一部分学生选择以铝为原料制取氢氧化铝,但是学生不一定能联想到Al3+与AlO2-的双水解促进反应,故教师应在讲课时充分利用教材第二个实践活动“AlCl3与NaOH反应”,将该知识点告知学生,给学生提示。
(4)学生选择以铝为原料制取氢氧化铝,从理论上各需H+、OH-3/4 mol,但实际操作中H+、OH-各3/4 mol不能将铝恰好完全溶解。建议加入稍过量的酸和碱,尽量使过量的H+和OH-的物质的量相等,但不要过量太多。过滤掉杂质后将溶液混合,完全反应后再过滤。
(5)由于生成的氢氧化铝是胶状沉淀,过滤较慢,为加快过滤速度,可以选用孔隙大的快速滤纸过滤。
5.问题与讨论
(1)原料的选择以原料是否易得,价格是否便宜为原则,可按学生所选原料的来源归类。
(2)制备方案遵循的原则是原料廉价,原理绿色,条件优化,仪器、操作简单,分离方便,实验室容易提供所需的条件。学生可对照以上标准找出自己设计中的优点和缺点。
(3)判断产物是否为Al(OH)3的办法是:一、取产物少许放在蒸发皿里加热,白色胶状固体分解成白色粉末,有水蒸气出现。二、另取产物少许,分成两份,一份滴加氢氧化钠溶液,另一份滴加稀硫酸,沉淀都溶解,说明制得的产品为氢氧化铝。
6.拓展实验
(1)利用废铜屑制备硫酸铜
选用的废铜屑如果比较细小,可放到石棉网上加热,当固体完全变黑后放入稀硫酸中溶解。如果选用的是铜片或废铜丝可直接在酒精灯外焰上灼烧(不可靠近内焰,特别注意不要靠近灯芯),当固体完全变黑后溶解在稀硫酸中。可用Cu(OH)2CO3调节溶液的pH=3。要趁热过滤除去Fe(OH)3,将滤液小火加热到液面有晶膜时冷却结晶,过滤得CuSO4·5H2O。如果要制无水CuSO4,将晶体放入坩埚,小心加热(不能大火加热,否则CuSO4分解),蓝色晶体全部变白后转入干燥器内冷却,称重;然后再加热、冷却称重,两次质量差小于0.1 g即得无水CuSO4。
(2)制金属镀件
本实验不能只用ZnCl2溶液,否则电解时阴极会同时析出氢气;镀件表面要进行去油、去锈处理;电源的电压也会直接影响电镀结果的好坏,合适的电压为1.5~2伏,不宜过高。具体步骤为:
先将镀件放入1 mol/L的NaOH溶液中加热去油,再用20%稀盐酸洗,然后用清水洗净(清洗要快,防止镀件表面氧化),将两电极间隔5 cm垂直放入电镀槽,用2伏低压直流电源或一节1.5伏干电池(1号电池或5号电池均可)通电5~10分钟,镀层呈现浅灰色,取出镀件放入钝化液钝化。
电镀液的配制方法:在1 000 mL的大烧杯中加入约800 mL 60~70 ℃沸腾后的水,加入约250 g NH4Cl,35 g ZnCl2搅拌溶解,加入约20 g硼酸,2 g硫脲,2 g聚乙二醇,搅拌溶解,加入3~4滴洗涤剂,用沸腾后的水稀释到1 000 mL。
钝化液的配制方法:称取250 g CrO3溶于700 mL水中,缓缓加入15 mL浓硫酸,再加入120 mL浓硝酸,加水稀释至1 000 mL
第二篇:乙酸乙酯制备实验的改进
乙酸乙酯制备实验的改进
王永明
(河北廊坊武警学院基础部,河北廊坊065000)
〔摘要〕乙酸乙酯的制备是高校有机化学实验的重要内容之一,目前实验教材中仍采用浓硫酸催化酯化法来制备,易引起腐蚀及炭化,而且反应时间长,能耗大。作者在实验教学中对乙酸乙酯制备实验进行了改进,取得了良好的效果。
〔关键词〕乙酸乙酯;微型化;制备实验
〔中图分类号〕O6-3〔文献标识码〕A〔文章编号〕1008-5149(2009)04-0133-02
1引言
在有机化学实验教学中,乙酸乙酯的制备是基本实验之一。目前教材方法存在浓硫酸的用量多,操作步骤复杂,实验用时长等缺点。文献上也有许多有关乙酸乙酯制备实验改进的报道等改用无水四氯化锡为催化剂,要用到油浴控制反应温度,非常不方便;用固体酸或杂多酸催化,催化剂制备前期工作复杂,时间长,也不适于学生实验。因此,从简化重复步骤、缩短实验时间,节约能源和试剂的角度出发,有必要对现有方法加以改进以满足实验教学改革的需要。
2乙酸乙酯制备实验的微型化
2.1实验仪器的微型化:传统实验采用19#标准磨口有机制备仪,改进后采用BZ14\23标准磨口半微量有机制备仪。
2.2实验药品的微型化:(见表1) 表

1传统实验药品使用量与半微量实验药品使用量对比
3催化剂的改进
传统实验使用浓硫酸做催化剂,主要有以下不足:(1)反应中用浓硫酸做催化剂,容易
发生炭化现象,易生成二氧化硫等有害气体;(2)反应过程中的温度不易控制,易发生副反应生成乙醚。为了解决以上不足,在不影响乙酸乙酯产率的情况下,实验中使用了稀硫酸为催化剂,不仅使浓硫酸用量大大减少,同时也克服了浓硫酸在使用过程中的不足,取得了良好的实验效果。
4加热装置的改进
4.1传统实验采用油浴加热,改进后的实验采用微波炉加热。具体方法是:在三口烧瓶中加入冰醋酸、95%乙醇、催化剂,稍加振动,放在微波炉中安装上回流冷凝管,在一定微波功率下辐射反应一段时间。反应结束后,冰水充分冷却,反应产物用饱和碳酸钠水溶液除去剩余酸;用饱和食盐水溶液洗涤,分出酯层后再用饱和氯化钙水溶液洗涤;最后用去离子水洗涤,以无水碳酸钾干燥酯液,蒸馏,收集73℃-78℃馏分,得到具有果香味的无色透明乙酸乙酯;称重,计算产率。
4.2油浴加热与微波辐射的对比:(见表2)
表2油浴加热与微波辐射的对比

5实验操作的改进
5.1粗产品的制备
在三颈烧瓶中加入冰醋酸和95%乙醇,摇匀后加入H2SO4,再摇动使原料充分混合,然后加入沸石,装上冷凝管安装成回流装置。用微波炉加热反应瓶。停止加热后撤掉回流冷凝管,改成蒸馏装置,在蒸馏瓶中加几粒沸石,接受器外围用冷水冷却。严格控制馏出物沸点在73℃~78℃之间,馏出速度为1~2滴每秒。在蒸馏的最后阶段,73℃以下馏份馏出物很慢甚至停至馏出,这时升温直至馏出液沸点达80℃为止。
5.2产品的精制将含有少量乙醇、乙醚、水和乙酸的馏出液于烧瓶中,分批加入饱和Na2CO3溶液进行洗涤,每次加入后要塞紧瓶口,进行剧烈摇动,使两液充分接触直至无二氧化碳气体逸出为止。静置分层后,用广泛pH试纸检验酯层,呈中性后,即可停止洗涤。将上述混合液转入分液漏斗中,充分振荡后,静置片刻,取上层酯液,先用饱和NaCl溶液洗涤,再用CaCl2溶液洗涤两次。取上层酯液倒入干燥的锥形瓶中,用无水K2CO3干燥。
将干燥后的粗产品倒入干燥的蒸馏瓶中,加入几粒沸石,置热水浴上蒸馏,收集73℃~78℃的馏出液即为乙酸乙酯,称重。
6结语
改进后的实验有以下优点:(1)药品的使用量只有原来的1/3,降低了实验成本;(2)用稀硫酸做为催化剂,有效防止了炭化现象及乙醚等副产物及有害物质的产生,保护了人身安全及周围环境;(3)在回流装置中改用微波炉加热方式,缩短了操作时间,节约了能源,使学生从枯燥的等待中解脱出来;(4)采取分批多次用饱和Na2CO3溶液洗涤,再加上剧烈振摇可使两相充分接触,洗涤彻底,避免了因洗涤不充分而产生絮状沉淀。总之,改进后的乙酸乙酯制备方法克服了原实验方法的缺点,显著的减少了药品的使用量,也减少了副产物的发生,缩短了实验合成时间,获得了较满意的实验效果。
参考文献
〔1〕高占先.有机化学实验(第四版)〔M〕.北京:高等教育出版社,2004.111.
〔2〕北京大学.有机化学实验〔M〕.北京:北京大学出版社,1994.173.
〔3〕兰州大学,复旦大学有机教研室.有机化学实验(第二版)〔M〕.北京:高等教育出版社,1994.160.
〔4〕王党生.乙酸乙酯制备实验的改进〔J〕.实验室研究与探索,1997,(4):70-72.
〔5〕白秀丽,李晓莉.乙酸乙酯合成实验的改进〔J〕.化学工程师,1999,(2):18-19.
〔6〕郑旭东,胡浩斌,胡怀生.对实验教材中乙酸乙酯合成方法的改进〔J〕.甘肃高师学报2002,7(5):79-80.
〔7〕王艳,柯家骏.固体超强酸SO2-4/ZrO2的制备及其催化合成乙酸乙酯的研究〔J〕.石油化工,1995,24(5):324-332.
〔8〕王恩波,段影波,张云峰.杂多酸催化合成乙酸乙酯〔J〕.催化学报,1993,14(2):147-149. 〔9〕王科军,李勋,赵鹭飞.乙酸乙酯制备实验的改进〔J〕.赣南师范学院学报,2000,6:96-97. 〔10〕屈永年,高海涛.乙酸乙酯合成实验方法的改进〔J〕.数理医药学杂志,2004,17(1):64-65.
〔责任校对包国祥〕
-
实验二 乙酰乙酸乙酯的制备
实验二乙酰乙酸乙酯的制备一实验目的1学习制备乙酰乙酸乙酯的原理和方法加深对Claisen酯缩合反应原理的理解和认识2熟悉在酯缩合反…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰乙酸乙酯的制备
理论产量0041301452g产率八问题和讨论1本实验所用仪器未经干燥处理对反应有何影响答一开始要用到纯的金属钠有水会发生局部过热…
-
乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备实验目的1了解通过Claisen缩合反应由乙酸乙酯制备三乙的基本原理和方法2了解和掌握减压蒸馏装置的原理和作用实…
-
乙酰乙酸乙酯的制备.doc1.
乙酰乙酸乙酯的制备作者化工106程鹏摘要含有a氢的酯在碱性催化剂存在下能和另一份子酯发生克莱森酯缩合反应生成酮酸酯乙酰乙酸乙酯就是…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践学生姓名刘弓号148xxxxxx…
- 乙酸乙酯的合成实验报告
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践提交形式在线提交实验报告学生姓名…
-
化学实验报告——乙酸乙酯的合成
乙酸乙酯的合成一实验目的和要求1通过乙酸乙酯的制备加深对酯化反应的理解2了解提高可逆反应转化率的实验方法3熟练蒸馏回流干燥气相色谱…
-
乙酸乙酯的合成实验报告
中国石油大学华东现代远程教育实验报告课程名称有机化学实验名称乙酸乙酯的合成实验形式在线模拟现场实践年级专业层次学习中心上海学习中心…