电导法测定弱电解质的电离平衡常数及数据处理
电导法测定醋酸电离常数
一、实验目的
1.了解溶液电导、电导率和摩尔电导率的概念;
2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。
二、实验原理
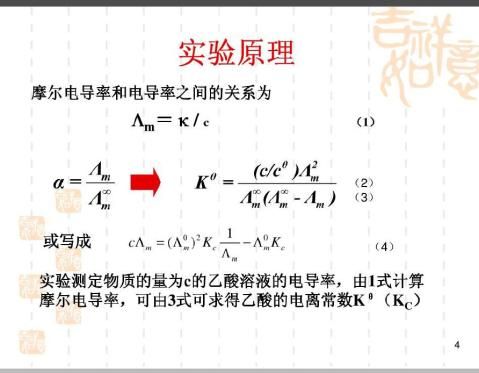
电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞
m,而且可用离子极限摩尔电导率相加而得。
∞一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ这由两m是有差别的。
个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。
Λm/Λ
若U+= U-,U+=U-则
Λm/Λ
式中α为电离度。
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数Ka,起始浓度C0,电离度α有以下关系: AB

A+ + B-
起始浓度mol/L: C0 0 0
平衡浓度mol/L: C0·(1-α) αC0 αC0
Kc=[c(A+)/c][c(B-)/c]/[c(AB)/c]=C0α2/(1-α)=C0Λ
根据离子独立定律,Λ∞∞,∞∞∞m=α(U++ U-)/(U+∞+ U-) ∞m=α ??????2m/[cΛ∞m(Λ∞m-Λm)] Λm可以从电m可以从离子的无限稀释的摩尔电导率计算出来。
?导率的测定求得,然后求出Ka。
ΛmC0/c =Λ
??∞2?mKc/Λm-Λ∞mKc? ∞通过ΛmC0/c ~1/Λm作图,由直线斜率=Λ
三、仪器与试剂 2?mKc,可求出Kc?。
DDS-11A(T)型电导率仪1台;恒温槽1套;0.1000mol/L醋酸溶液。
四、实验步骤
1.调整恒温槽温度为25℃±0.3℃。
2.用洗净、烘干的义形管1支,加入20.00mL的0.1000mol/L醋酸溶液,测其电导率。 3.用吸取醋酸的移液管从电导池中吸出10.00mL醋酸溶液弃去,用另一支移液管取10.00mL电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。
4.倒去醋酸溶液,洗净电导池,最后用电导水淋洗。注入20mL电导水,测其电导率。 五、实验注意事项
1.本实验配制溶液时,均需用电导水。
2.温度对电导有较大影响,所以整个实验必须在同一温度下进行。每次用电导水稀释溶液时,需温度相同。因此可以预先把电导水装入锥形瓶,置于恒温槽中恒温。
六、数据记录及处理
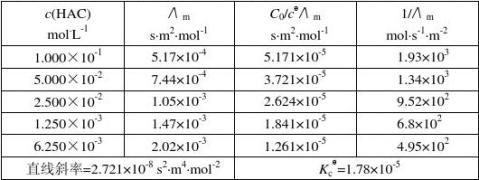
第一次实验:实验温度:25.2℃,电导池常数K(l/A):0.94 m-1,Λ
∞
2-1
m表1 醋酸电离常数的测定

HAC -κHAC -κ
电导水
计算:Λm/s.m2.mol-1=(κ
={(κ
)us.cm-1×10-4/[c(HAC)mol.L-1×103] ) ×10-7/c(HAC)}
电导水
Λm(1)={(0.520×103-2.90)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1 Λm(2)={(0.375×103-2.90)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1 Λm(3)={(0.265×103-2.90)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1 Λm(4)={(0.187×103-2.90)/(1.250×10-3)}×10-7=1.47×10-2s.m2.mol-1 Λm(5)={(0.129×103-2.90)/(6.250×10-4)}×10-7=2.02×10-2s.m2.mol-1 Λ
∞
m(HAC)=Λ
∞
m(H
+
)+Λ
∞
m(AC
-
)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ
∞
m
α(1)= 5.17×10-4/ 3.9072×10-2=0.0142 α(2)= 7.44×10-4 / 3.9072×10-2=0.0199
α(3)= 1.05×10-3 / 3.9072×10-2=0.0275 α(4)= 1.47×10-2 / 3.9072×10-2=0.0397 α(5)= 2.02×10-2/ 3.9072×10-2=0.0545 Kc=C0Λ
???????
2
m/[Λ
∞
m(Λ
∞
m-Λm)
Kc(1)=1.000×10-1×(5.17×10-4)2/[390.72×(390.72-5.17)×10-8]=1.78×10-5 Kc(2)=5.000×10-2×(7.44×10-4)2/[390.72×(390.72-7.44)×10-8]=1.85×10-5 Kc(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.85×10-5 Kc(4)=1.250×10-3×(1.47×10-3)2/[390.72×(390.72-1.47)×10-8]=1.85×10-5 Kc(5)=6.250×10-3×(2.02×10-3)2/[390.72×(390.72-2.02)×10-8]=1.76×10-5 Kc(平均值)= 1.82×10-5
表2 醋酸电离常数的测定
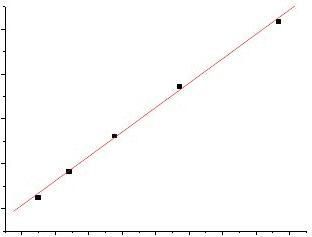
C0/cΛm /S.m.mol
-2o-1
1/Λm/s.m.mol
2
-1
直线斜率=Λ
∞
?2? -8
K=2.721×10,Kmcc
=2.721×10-8/(390.72×10-4)2=1.78×10-5
第二次实验:实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ
∞
2-1
m表1 醋酸电离常数的测定
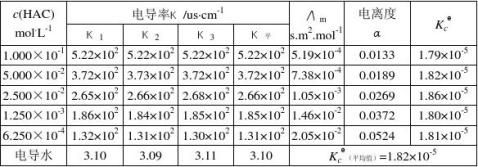
HAC -κHAC -κ
电导水
计算:Λm/s.m2.mol-1=(κ
={(κ
)us.cm-1×10-4/[c(HAC)mol.L-1×103] ) ×10-7/c(HAC)}
电导水
Λm(1)={(0.522×103-3.10)/(1.000×10-1)}×10-7=5.17×10-4s.m2.mol-1 Λm(2)={(0.372×103-3.10)/(5.000×10-2)}×10-7=7.44×10-4s.m2.mol-1 Λm(3)={(0.266×103-3.10)/(2.500×10-2)}×10-7=1.05×10-3s.m2.mol-1 Λm(4)={(0.185×103-3.10)/(1.250×10-3)}×10-7=1.46×10-2s.m2.mol-1 Λm(5)={(0.131×103-3.10)/(6.250×10-4)}×10-7=2.05×10-2s.m2.mol-1 Λ
∞
m(HAC)=Λ
∞
m(H
+
)+Λ
∞
m(AC
-
)=349.82s.cm2.mol-1+40.9s.cm2.mol-1
=390.72 s.cm2/mol=3.9072×10-2s.m2.mol-1
α=Λm/Λ
∞
m
α(1)= 5.19×10-4/ 3.9072×10-2=0.0133 α(2)= 7.38×10-4 / 3.9072×10-2=0.0189 α(3)= 1.05×10-3 / 3.9072×10-2=0.0269 α(4)= 1.46×10-2 / 3.9072×10-2=0.0372 α(5)= 2.05×10-2/ 3.9072×10-2=0.0524 Kc=C0Λ
??????
2
m/[Λ
∞
m(Λ
∞
m-Λm)
Kc(1)=1.000×10-1×(5.19×10-4)2/[390.72×(390.72-5.17)×10-8]=1.79×10-5 Kc(2)=5.000×10-2×(7.38×10-4)2/[390.72×(390.72-7.44)×10-8]=1.82×10-5 Kc(3)=2.500×10-2×(1.05×10-3)2/[390.72×(390.72-1.05)×10-8]=1.86×10-5 Kc(4)=1.250×10-3×(1.46×10-3)2/[390.72×(390.72-1.47)×10-8]=1.80×10-5 Kc(5)=6.250×10-3×(2.05×10-3)2/[390.72×(390.72-2.02)×10-8]=1.81×10-5
Kc(平均值)= 1.82×10-5
?
表2 醋酸电离常数的测定
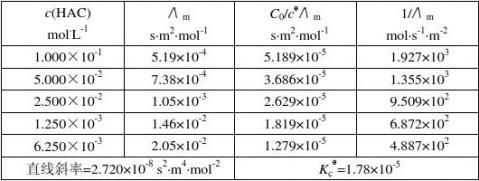
实验温度:24.9℃,电导池常数K(l/A):0.94 m-1,Λ
∞
2-1
m
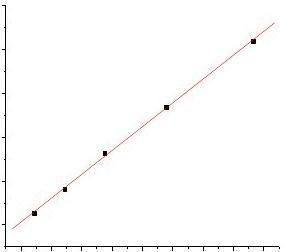
C0/cΛm/S.m.mol
-1
2
o
-1
-2
1/Λm/ S.m.mol
直线斜率=Λ
∞
?2? 10-8,KcmKc=2.720×
=2.720×10-8/(390.72×10-4)2=1.78×10-5
第二篇:电导法测定弱电解质的电离平衡常数






-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
公路工程质量月活动总结
济南至乐陵高速公路工程质量月工作总结报告山东信诚公路工程监理咨询中心济南至乐陵高速公路第四驻地办二0一二年十月八日济南至乐陵高速公…
-
“第二届寝室杯篮球赛”活动总结书
“第二届寝室杯篮球赛”活动总结书为促进宿舍间友谊,提升宿舍团结力,我班班委于20xx年x月x日举办了一场别开生面的宿舍篮球赛,此次…
-
大一上寒假总结
大一上学期学期总结寒假在期盼,等待,守候中到来了。回顾半个学期,经历了很多,已收获了很多,对自己今后要走的路也有了更深的认识。入学…
-
艺术生大一期末总结总结
总结学期的素描学习过程中,我对以前所遇到的很多与术语有关的问题都有了一定的理解,对一些思维方式也有了很大的转变,认识和理解了许多东…
-
寄宿生管理工作总结
张村乡校寄宿生管理本学期对寄宿生管理工作“安全、有序、优质”为管理目标。培养学生行为规范和独立生活的自理能力;团结互助、相互关心的…