环己酮的制备实验报告
??大学实验报告
20##年11月19日
姓名/////////// 系年级2010级应用化学系 组别 30 同组者???
科目有机化学 题目 环己酮的制备 仪器编号 30
一、 实验目的
1、 学习铬酸氧化法制备环己酮的原理和方法。
2、 通过醇转变为酮的实验,进一步了解醇和酮的联系和区别。
二、 实验原理
实验室制备脂环醛酮,最常用的方法是将伯醇和仲醇用铬酸氧化。铬酸是重要的铬酸盐和40%~50%硫酸的混合物。仲醇用铬酸氧化是制备酮最常用的方法。酮对氧化剂比较稳定,不易进一步氧化。铬酸氧化醇是一个放热反应,必须严格控制反应的温度,以免反应过于剧烈。反应方程式为:

三、 主要物料及产物的物理常数
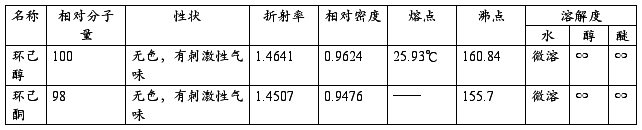
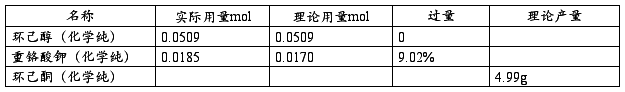
四、 主要物料用量及计算
五、 实验装置
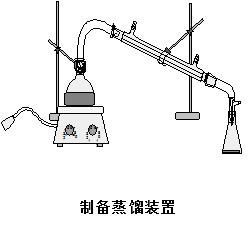
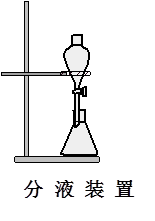
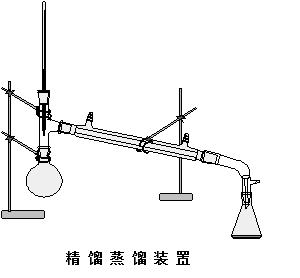
六、 实验步骤
1、配制铬酸溶液:在200mL烧杯中加入30mL水和5.5g重铬酸钠,搅拌使之全部溶解。然后在搅拌下慢慢加入4.5mL浓硫酸,将所得橙红色溶液冷却到30℃以下备用;
2、250mL圆底烧瓶中加入5.3mL环己醇,然后一次加入配制好的铬酸溶液,并充分振摇使之混合均匀。用水浴冷却,控制反应温度在55~60℃。当温度开始下降时移去冷水浴,室温下放置0.5h,其间要间歇振摇反应瓶;
3、反应完毕后在反应瓶中加入30.0mL水和几粒沸石,改成蒸馏装置进行蒸馏。将环己酮和水一起蒸出来,直至馏出液不再浑浊再多蒸8~10mL,约收集馏出液25mL。
4、将馏出液用食盐饱和后转入分液漏斗中,分出有机相。水相用7.5mL乙醚提取一次,将乙醚提取液和有机相合并,用1~2g无水碳酸钾干燥;在水浴上蒸除乙醚,换空气冷凝管,蒸馏收集151~155℃馏分。
5、称量产品。纯粹环己酮沸点155.7℃,d420为0.9476,折射率n420为1.4507.
七、实验记录
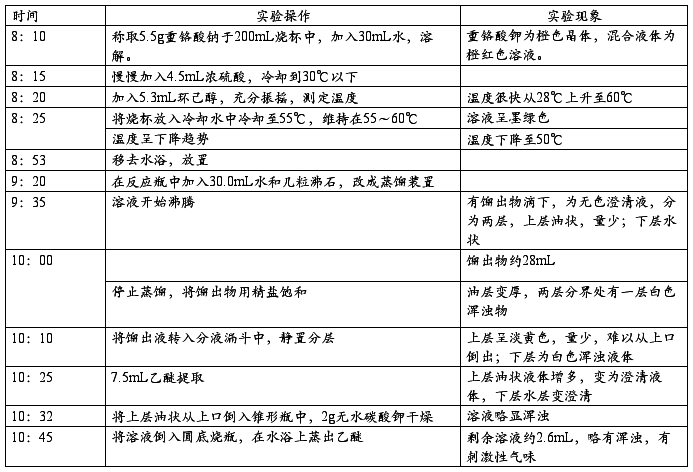
八、产率计算
实际产品质量:2.5g
理论产品质量:4.99g
产率=(实际产品质量/理论产品质量)*100%=(2.5/4.99)*100%=50.1%
九、讨论
本实验中,铬酸氧化醇是一个放热反应,需要严格控制温度以防反应过于剧烈,用冷水和热水来维持;温度过高副反应增多,温度过低反应困难。干燥时时间要充分,否则溶液中含水浑浊,造成蒸馏时达不到预定温度。
第二篇:环己酮的制备实验报告(4)沈杰

有 机 化 学 实 验 报 告

实 验 名 称: 环己酮制备
学 院: 化学工程学院
专 业: 化学工程与工艺
班 级: 化工11-4班
姓 名:沈 杰 学 号11402010417
指 导 教 师: 肖勋文、何炎军
日 期: 2012年10月23日
一、 实验目的
1.学习次氯酸氧化法制环己酮的原理及方法。
2.进一步了解醇和酮之间的联系与区别。
二、 实验原理
用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
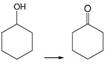 反应式: 副反应:
反应式: 副反应: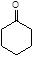
 HOOC—(CH2)4—COOH
HOOC—(CH2)4—COOH
三、 主要试剂及物理性质

四、试剂用量规格
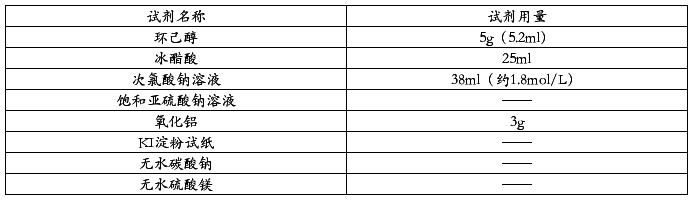
五、仪器装置
(一)实验仪器
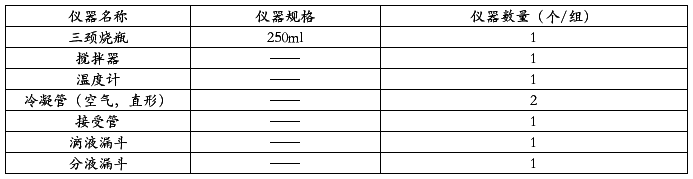
(二)实验装置图
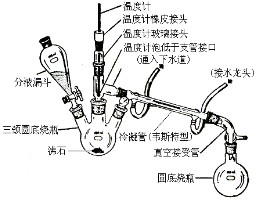

六、实验步骤及现象

七、 实验结果
理论环己酮的质量 m=98.14×(5.2×1.017)/100.16=5.182g
实际得到的环己酮的体积V′=2.80ml
m′=2.80×0.9478=2.654g
产率=(m′/m)×100%=(2.654/5.182) ×100%=51.21%
八、 实验讨论
1.数据分析
实验产率相对较低原因:
a 操作过程不够精细
b 分液静止时间不够长,导致环己酮的损失
c 可能是加热蒸馏不充分,液面上还漂浮着黄棕色的油状小液滴时就停止蒸馏,导致产率较低
d 环己酮的发生过程,用碘化钾检验没有呈蓝色,一方面可能是试纸的质量不过关,一方面可能是在反应过程中出了某些问题导致环己酮生成量较低,使得结果偏低
2.实际操作对实验结果的影响
a 反应温度尽量控制在30℃左右,反应温度过低则不反应,温度过高则易挥发
b 加入次氯酸不宜过多,否则中和时加入较多的亚硫酸氢钠,从而造成蒸馏时间过长
c 加热蒸馏要充分,蒸馏粗产品过程中,由于检验时油状液体较难判断,可以根据气味或蒸馏温度的变化判断蒸馏是否完全,而判断反应的终点
3.问题分析
a 环己酮的沸点为156℃,而在蒸馏得粗产品中,温度为98℃即可蒸出产品的原因分析
答:环己酮的沸点为156℃,但环己酮能与水形成共沸物,从而降低了环己酮的沸点,温度在98℃即可蒸出产物,但含有杂质。通过对粗产品除杂,可以得到较纯的环己酮。此时再蒸馏环己酮,温度即可达到环己酮的沸点156℃
b 加入次氯酸充分反应后,溶液呈乳白色的原因分析
答:加入次氯酸充分反应后,溶液本应是无色透明溶液,而此时溶液仍呈乳白色,是因为加入次氯酸钠过多。次氯酸钠在有机试剂中溶解度比较低,当次氯酸钠过多时,容易析出,从而使溶液呈乳白色。
4.注意点
a 次氯酸钠溶液的浓度可用简接碘量法测定
b 加氯化铝可预防蒸馏时发泡
c 加入精盐是为了降低环己酮的溶解度并有利于环己酮的分层
-
环己酮的制备实验报告
20xx年11月19日姓名系年级20xx级应用化学系组别30同组者科目有机化学题目环己酮的制备仪器编号一实验目的1学习铬酸氧化法制…
-
有机化学实验报告:环己酮的制备
环己酮的制备华南师范cai前言环己酮无色透明液体分子量9814密度09478gmL熔点164C沸点15565C在水中微溶在乙醇中混…
-
有机化学环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工112班名赵应松学号114020xx242教师…
-
环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工124班名王伟杰学号124020xx414教师…
-
环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工106班名严晓晓学号104020xx602教师…
-
环己酮的制有机化学实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1学习次氯酸氧化法制环己酮的原…
-
有机化学实验报告:环己酮的制备
环己酮的制备华南师范cai前言环己酮无色透明液体分子量9814密度09478gmL熔点164C沸点15565C在水中微溶在乙醇中混…
-
聚己内酰胺的制备实验报告
聚己内酰胺的制备三主要试剂和产物的物理常数四实验装置图五实验步骤和现象六实验结果七注意事项八问题与讨论1因为环己酮肟的纯度对反应有…
-
环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工124班名王伟杰学号124020xx414教师…
-
环己酮的制备实验报告
实验学专班姓指导日机化学实验报告名称环己酮的制备院化学工程学院业化学工程与工艺级化工106班名严晓晓学号104020xx602教师…
-
苯亚甲基苯乙酮的制备(期末实验报告)
苯亚甲基苯乙酮的制备一实验的目的和要求1掌握羟醛缩合反应的原理和机理学会苯亚甲基苯乙酮的合成方法2掌握水蒸气蒸馏3掌握反应温度控制…