粘均分子量测试方法
粘度法测定聚合物的粘均分子量
一、 实验目的
1. 掌握使用粘度法测定聚合物分子量的基本原理
2. 掌握乌氏粘度计测定聚合物稀溶液粘度的实验技术及数据处理方法
3. 分析分子量大小对聚合物性能以及聚合物加工性能的关系及影响。
二、基本原理
聚合物稀溶液的粘度主要反映了液体分子之间因流动或相对运动所产生的内摩擦阻力。内摩擦阻力与聚合物的结构、溶剂的性质、溶液的浓度及温度和压力等因素有关,它的数值越大,表明溶液的粘度越大。
聚合物溶液粘度的变化,一般采用下列的粘度量来描述。
相对粘度,又称粘度比,用ηr表示。
它是相同温度条件下,溶液粘度η与纯溶剂粘度η0之比,表示为:
ηr=η/η0 (1)
相对粘度是一个无因次量,随着溶液浓度增加而增加。对于低剪切速率下聚合物溶液,其值一般大于1。
增比粘度(粘度相对增量),用ηsp表示,是相对于溶剂来说,溶液粘度增加的分数: ηsp =(η-η0)/η0 =ηr –1 (2)
3. 比浓粘度(粘数),对于高分子溶液,粘度相对增量往往随溶液浓度的增加而增大,因此常用其与浓度c之比来表示溶液的粘度,称为比浓粘度或粘数,即:
ηsp/c = (ηr-1)/c (3)
粘数的因次是浓度的倒数,一般用 ml/g表示。
比浓对数粘度(对数粘度),其定义是相对粘度(粘度比)的自然对数与浓度之比,即: ( lnηr)/c = /c (4)
单位为浓度的倒数,常用 ml/g表示。
特性粘度(极限粘度),其定义为比浓粘度(粘数)ηsp/c或比浓对数粘度(对数粘度)lnηr/c在无限稀释时的外推值,用表示,即:
= lim(ηsp/c) = lim(lnηr/c) (5)
c→0 c→0
称为特性粘度(或极限粘数),其值与浓度无关,量纲是浓度的倒数。
实验证明,对于给定聚合物,在给定的溶剂和温度下,的数值仅有试样的分子量Mη所决定。和 Mη的关系如下:
=K Mηα (6)
上式称为Mark-Houwink方程。
式中:—— 扩张因子,与溶液中聚合物分子形态有关;
Mη——粘均分子量
(注:一些常用聚合物的K 、α值见附表1所示)
K 、α与温度、聚合物种类和溶剂性质有关,K值受温度影响明显,而α值主要取决于高分子线团在溶剂中舒展的程度,一般介于0.5~1.0之间。在一定温度时,对给定的聚合物-溶剂体系,一定的分子量范围内K 、α为常数,只与分子量大小有关。K 、α值可从有关手册中查到(见附表1),或采用几个标准试样又式(6)进行测定,标准试样的分子量有绝对方法(如渗透压法和光散射法)确定。
在一定温度下,聚合物溶液粘度对浓度有有一定的依赖关系,通常用哈金斯(Huggins)方程描述为:
ηsp/c = – kˊ2c (7)
或用克拉默(Kraemer)方程描述为:
(lnηr)/c = – β2c (8)
对于给定的聚合物,在给定的温度和溶剂时,kˊ、β应为常数,其中kˊ为哈金斯(Huggins)常数,它表示溶液中高分子间和高分子与溶剂分子间的相互作用,kˊ一般说来对分子量并不敏感。对于线形柔性链高分子良溶剂体系,kˊ=0.3 ~ 0.4,kˊ+β=0.5。外推可得到共同的截距,如图1所示,由式(7)和式(8)可得到一点法求的方程:
= (1/c)1/2 (9)
图1用ηsp/c和(lnηr)/c 对c作图 图2 乌氏粘度计
由上可见,用粘度法测定高聚物分子量,关键在于的求得,最为方便的是用毛细管粘度计测定溶液的相对粘度(粘度比)。常用的粘度计为乌氏(Ubbelchde)粘度计(如图2所示),其特点是溶液的体积对测量没有影响,所以可以在粘度计内采取逐步稀释的方法得到不同浓度的溶液。
根据相对粘度(粘度比)定义
η ρt(1-B/At2)
ηr = —— = —————— (10)
η0 ρ0t0(1-B/At02)
式中,ρ、ρ0分别为溶液和溶剂的密度,因溶液很稀,ρ=ρ0;A和B为粘度计常数;t和t0分别为溶液和溶剂在毛细管中的流出时间,即液面经过刻线a和b所需时间。在恒温条件下,用同一支粘度计测定溶液和溶剂的流出时间,如果溶剂在该粘度计中的流出时间大于100秒,则动能校正项B/At2远小于1(有关动能校正,可参考有关资料),因此溶液的粘度比为
ηr=t/t0
试样溶液浓度一般在0.01g/ml以下,使ηr值在1.05~2.5之间较为适宜。最大不应超过3.0。
三、试样与仪器
1. 仪器 如表 1所示。
表1 粘度测定仪器一览表
名称 规格 数量
乌氏粘度计 溶剂流出体积大于100s 1支
恒温水槽 温度波动不大于±0.05℃ 1套
容量瓶 25ml 2只
100ml 2只
玻璃砂芯漏斗 3号 2只
移液管 5ml 1支
10ml 2支
秒表 1/10s 1只
吸球 橡皮 1只
医用乳胶管 φ6*150 1根
附注 恒温水槽包括电动搅拌机1台,加热器1个,继电器1个,水银触点温度计1支,50℃十分之一刻度温度计1支。
测量分子量用的主要仪器是粘度计和恒温槽,其中恒温槽要求具有较高的温度精度和小的温度分布。
2. 药品 ①待测试样聚苯乙烯1g或丁苯橡胶1g;②溶剂:甲苯(AR)100ml,丙酮(CP)100ml。
四、实验步骤
1. 调节恒温槽温度至25±0.05℃。
2. 配制聚合物溶液
准确称取100-500mg试样放入100ml清洁干燥的容量瓶中,倒入约80ml甲苯,使之溶解,待试样完全溶解之后,放入已调节好的恒温槽中,溶量瓶也放入恒温槽中。再加溶剂至刻度,取出摇匀,用3号玻璃砂芯漏斗过滤到另一100ml容量瓶中,放入恒温槽恒温待用,容量瓶及玻璃砂芯漏斗,用后立即洗涤。玻璃砂芯漏斗要用含30%硝酸钠的硫酸溶液洗涤,再用蒸馏水抽滤,烘干待用。
3. 洗涤粘度计
粘度计和待测液体的清洁是决定实验成功的关键之一。若是新的粘度计应先用洗液洗,再用自来水洗三次,蒸馏水洗三次,烘干待用。对已用过的温度计,则先用甲苯(溶剂)灌入粘度计中浸洗除去留在粘度计中的高分子,尤其是毛细管部分要反复用溶剂清洗,洗毕,倾去甲苯液(倒入回收瓶中),再用洗液、自来水、蒸馏水洗涤,最后烘干。
4. 溶剂流出时间的测定
将清洁干燥的乌氏粘度计垂直放入恒温水槽内,使水面完全浸没小球。用移液管吸10ml甲苯,从A管注入E球中,于25℃恒温槽中恒温3分钟,然后进行测定。在C管套一乳胶管,用手捏住,使之不通气。在B管用吸球将E球的溶剂吸起,经毛细管及F球吸入G球,然后先松开吸球,再松开C管橡皮管,让C管通大气,随即,被吸起的溶剂开始流回E球,此时操作者要集中精神,用眼睛水平地注视正在下降的液面,并用秒表准确地测出液面流经a线与b线之间所需的时间,并记录。重复上述操作三次,每次测定相差不大于0.2秒。取三次的平均值为t0,即为溶剂甲苯的流出时间。
5. 溶液流出时间的测定
(1)测定t0后,将粘度计中的甲苯倒入回收瓶,并将粘度计烘干,用干净的移液管吸取已恒温好的被测溶液10ml,移入粘度计(注意尽量不要将溶液沾在管壁上),恒温2分钟,按前面的步骤,测定溶液(浓度c1)的流出时间t1。
(2)用移液管加入5ml预先恒温好的甲苯,对上述溶液进行稀释,稀释后的溶液浓度(c2)即为起始浓度c1的2/3。然后用同样的方法测定浓度为c2的溶液的流出时间t2。与此相同,依次加入甲苯5ml、10ml、10ml,使溶液浓度成为起始浓度的1/2、1/2、1/4,分别测定其流出时间并记录之(注意每次加入纯试剂后,一定要混合均匀,且要等到恒温后再测定)
6. 粘度计洗涤
测量完毕后,取出粘度计,将溶液倒入回收瓶中,用溶剂反复清洗几次,烘干,并用热溶液装满,浸泡数小时后倒去洗液,再用自来水、蒸馏水冲洗,烘干备用。
五、注意事项
1. 粘度计必须保证干净,溶剂、溶液也必须过滤纯净;
2. 粘度计材质为玻璃,容易碰坏,尤其是B、C管,操作要特别小心;
恒温槽温度要严格控制在要求范围内;
粘度计安装要垂直,读数要求精确。
六、数据处理
1. 记录格式如表2所示。
为作图方便,用相对浓度c′来计算和作图。
3. 外推法作图计算Mη
以ηSP/c′、lnηt/ c′对浓度c′作图,得两条直线,外推至c′→0得截距。经换算,就得特性粘度,将代入式(6),即可换算出聚合物的分子量Mη。
4. 用―一点法‖计算聚合物的分子量。
实际工作中,希望简化操作,快速得到产品的分子量。―一点法‖只要在一个浓度下测定粘度
比,用式(9)即可算出其分子量。
七、实验报告要求
1、简述实验原理。
2、明确操作步骤和注意事项。
3、做好原始记录及数据处理。
4、详细记录拉伸过程中观察到的现象,结合学过的理论知识分析现象产生原因(包括变形情况,表面及颜色变化,断裂情况及断面牲等)。
八、预习要求
1、搞清实验原理;
2、了解粘度法测定聚合物的粘均分子量操作步骤及注意事项。
3、写好预习报告,准备记录表格。
附表1 一些常见聚合物的K、α值
聚合物 聚合方法 分子量范围,*103 溶剂 温度(℃) K值,*102 α值
聚苯乙烯 (PS) 溶液聚合 3~1700 甲苯 25 1.7 0.69
1~11 苯 25 4.17 0.60
5.9~5.2 苯 20 1.23 0.72
330~ 甲苯 30 1.1 0.73
聚甲基丙烯酸甲酯 (PMMA) 本体聚合 70~6300 苯 25 0.468 0.77
240~4500 苯 25 0.38 0.70
乳液聚合 410~3400 丙酮 25 0.96 0.69
410~3400 甲苯 25 0.71 0.73
410~3400 氯仿 25 0.34 0.83
丁苯橡胶 (SBR) 乳液聚合 50℃ 25~500 甲苯 25 5.25 0.66
26~1740 甲苯 30 1.65 0.73
5℃ 55~1000 甲苯 30 2.95 0.75
25~1000 苯 25 1.3 0.55
天然橡胶 (NR) 0.4~1500 苯 25 5.02 0.17
顺丁橡胶 (BR) 20~1300 甲苯 25 2.15 0.65
26~660 丁酮 30 4.8 0.55
聚丙烯氰 (PAN) 48~270 二甲基甲酰胺 25 1.66 0.81
3~370 二甲基甲酰胺 25 2.33 0.75
涤纶(PET) 12~28 磷氯代苯 25 3.0 0.77
5~25 酚/四氯乙烷 25 2.1 0.82
聚乙烯醇 (PVA) 11.6~195 水 25 5.95 0.63
44~1100 水 50 5.9 0.67
30~120 水 30 6.6 0.64
第二篇:粘均分子量的统计因子
粘均分子量的统计因子
滕福爱 10042782 理优044
摘要:类比聚合物其他平均分子量统计因子的形式,猜想粘均分子量统计因子的形式,并用数值方法求出了粘均分子量的统计因子。根据粘均分子量测量机理,对数值结果修正,得到了具有实际物理意义的统计因子,即:粘均分子量是分子量对分子链流体力学体积的算术平方根的统计平均。用求得的统计因子统计已知分布的聚合物的粘均分子量并与实验测得的粘均分子量比较,二者十分接近。然后从统计学的角度思考统计因子的意义:每条分子链根据其对结果的影响能力(统计因子),单独对结果产生影响。最后尝试对黏度法测分子量的实验数据处理,说明黏度法测得的确实是粘均分子量。
关键词:粘均分子量 统计因子 流体力学体积 统计权重
l 引言
描述聚合物体系平均分子量的方式有很多,包括数均分子量,重均分子量,粘均分子量,Z均分子量。其中数均分子量是聚合物分子的分子量对分子链数量的统计平均。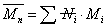 ,统计因子
,统计因子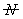 为聚合物分子链的数量分数,即数量分数越大,聚合物分子占的权重越大。重均分子量是分子量对分子链重量的统计平均。
为聚合物分子链的数量分数,即数量分数越大,聚合物分子占的权重越大。重均分子量是分子量对分子链重量的统计平均。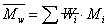 ,统计因子
,统计因子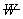 为分子链的重量分数,即重量分数越大,聚合物分子占的权重越大。Z均分子量是分子量对分子链Z量的统计平均。
为分子链的重量分数,即重量分数越大,聚合物分子占的权重越大。Z均分子量是分子量对分子链Z量的统计平均。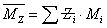 ,统计因子
,统计因子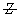 为Z量分数,即分子链的Z量越大,聚合物分子占的权重越大。而对于粘均分子量只能根据MHS方程:
为Z量分数,即分子链的Z量越大,聚合物分子占的权重越大。而对于粘均分子量只能根据MHS方程: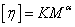 得出
得出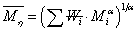 ,并不存在的分子量对某一因子统计平均的意义。聚合物的粘均分子量会不会也存在统计因子呢?
,并不存在的分子量对某一因子统计平均的意义。聚合物的粘均分子量会不会也存在统计因子呢?
从统计学的角度考虑,聚合物体系的平均分子量是根据各分子量在体系中所占的权重作的统计平均。那么粘均分子量也可以理解为分子量对某一因子的统计平均。即从某一个角度考虑分子链的权重,然后以此作统计因子对分子量求统计平均值。
l 粘均分子量统计因子的定义
考察其他分子量的统计因子:
数均分子量: ,
,
重均分子量: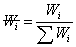 ,
,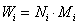
Z均分子量: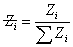 ,
,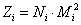
分析以上各分子量统计因子的形式,并根据以知结论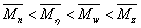 ,
,
定义粘均分子量的统计因子Q: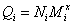
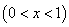 ,
,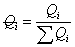 使:
使:

l 统计因子的求解
对于一定分布的多组分聚合物体系,各平均分子量的值是恒定的。如果测定体系的粘均分子量和分子量分布,就可求出统计因子:
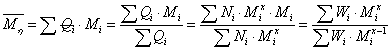
表1列出了某聚合物体系的分子量分布:
表1.  ,
, 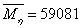
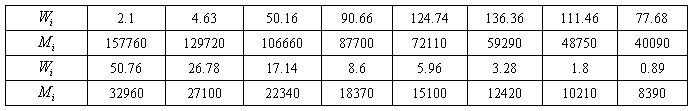
根据分子量分布及测得的粘均分子量可用数值法求出x,(附件)进而求出统计因子。
传统法测聚合物的粘均分子量是根据MHS方程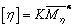 ,测聚合物稀溶液的特性黏度,然后根据方程系数
,测聚合物稀溶液的特性黏度,然后根据方程系数 和K求出
和K求出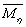 。或者根据聚合物分子量分布,根据公式:
。或者根据聚合物分子量分布,根据公式: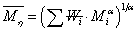 ,求出粘均分子量。但是我们可以看出,得到的粘均分子量与
,求出粘均分子量。但是我们可以看出,得到的粘均分子量与 值有关,
值有关, 是反映聚合物分子链在溶液中所处状态的物理量。即,在不同的溶液体系中测得的粘均分子量的值是不同的。因此,在不同的溶液中粘均分子量统计因子的值也应该不同。统计因子的参数x应该和
是反映聚合物分子链在溶液中所处状态的物理量。即,在不同的溶液体系中测得的粘均分子量的值是不同的。因此,在不同的溶液中粘均分子量统计因子的值也应该不同。统计因子的参数x应该和 一样,也是反映聚合物分子量在溶液中所处状态的物理量,那么x与
一样,也是反映聚合物分子量在溶液中所处状态的物理量,那么x与 之间应该存在某种联系。为找到这种联系,用实验方法求聚合物在不同溶液中的粘均分子量,并求出x,考察x与
之间应该存在某种联系。为找到这种联系,用实验方法求聚合物在不同溶液中的粘均分子量,并求出x,考察x与 之间的关系。
之间的关系。
为找到x与 之间的关系需要一定数量的数据,而寻找不同
之间的关系需要一定数量的数据,而寻找不同 值的聚合物溶剂比较困难。为简化问题,假设公式
值的聚合物溶剂比较困难。为简化问题,假设公式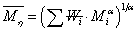 绝对准确,适当改变
绝对准确,适当改变 值即认为溶液性质已经改变,根据方程
值即认为溶液性质已经改变,根据方程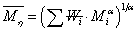 求出
求出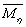 ,并用数值方法求出x值,这样只要已知一组聚合物的分子量分布,然后不断改变
,并用数值方法求出x值,这样只要已知一组聚合物的分子量分布,然后不断改变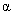 值就可完成实验。
值就可完成实验。
 的通常取值范围在0.5到0.8之间。将
的通常取值范围在0.5到0.8之间。将 从0.5到0.8以0.05为步长变化,根据表1中的聚合物分子量分布求粘均分子量量并求相应的x值列表表示如下:
从0.5到0.8以0.05为步长变化,根据表1中的聚合物分子量分布求粘均分子量量并求相应的x值列表表示如下:
表2.不用实验条件下的实验数据

作图表示x与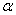 的关系如下:
的关系如下:



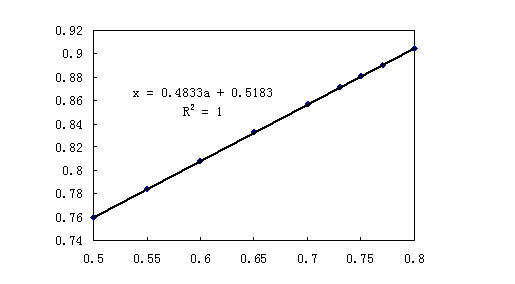
从图1可以看出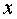 与
与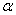 具有很好的线性关系,
具有很好的线性关系, 。求出了
。求出了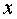 与
与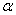 的关系,根据具体的聚合物溶剂,查出
的关系,根据具体的聚合物溶剂,查出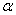 值便可求出写出统计因子,并用统计方法得到聚合物的粘均分子量。
值便可求出写出统计因子,并用统计方法得到聚合物的粘均分子量。

l 统计因子的意义
虽然同数值方法求出了统计因子,但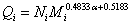 或
或 并无任何实际意义!
并无任何实际意义!
根据Einstein粘度方程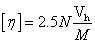 ,以及MHS方程:
,以及MHS方程: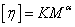 可得出:
可得出:

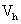 为分子链在溶液中的流体力学体积
为分子链在溶液中的流体力学体积
流体力学体积反映了高聚物分子链在溶液中的舒展状态。稀溶液的特性粘度测的是溶液体系中各种分子的内作用力,与分子链的舒展程度有很大的关系。而传统粘均分子量是根据特性粘度算出的,由此可以推测出粘均分子量与聚合物分子链在溶液中的舒展状态有关系,即与聚合物分子的流体力学体积有关系。从统计学的角度理解,分子的流体力学体积是决定分子在溶液中地位的一个因素,而测特性粘度或计算粘均分子量时这一因素起决定作用。因此在用统计法求粘均分子量时,统计因子中必须包含流体力学体积的作用。
观察数值法得出的结论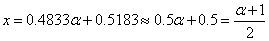
所以: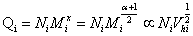 。即统计因子正比于流体力学体积的平方根。
。即统计因子正比于流体力学体积的平方根。
可重新定义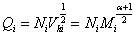

l 粘均分子量统计因子的验证:
(1) 同一组分不同溶剂验证
根据上文的假设实验方法,取一组已知分布的聚合物体系(表1),不断改变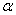 值,利用公式
值,利用公式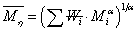 求粘均分子量
求粘均分子量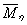 ,
,
利用 求数值法得到的粘均分子量
求数值法得到的粘均分子量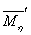 ,利用公式
,利用公式 求有统计意义的粘均分子量
求有统计意义的粘均分子量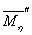 ,以
,以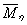 作为标准,计算
作为标准,计算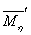 和
和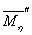 的相对变化:
的相对变化: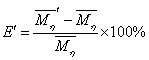 ,
,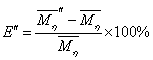 。列表表示如下:
。列表表示如下:
表3.同一组分不同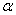 的粘均分子量比较
的粘均分子量比较
从表3中的 一行可以看出用流体力学体积统计出的粘均分子量误差不是很大(小于0.2%),在可以接受的范围之内。
一行可以看出用流体力学体积统计出的粘均分子量误差不是很大(小于0.2%),在可以接受的范围之内。
(2) 取不同聚合物体系验证
另取一组聚合物体系,其分布列表表示如下:
表4. 一组聚合物的分子量分布( =0.73,
=0.73, )
)

分别计算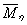 ,
,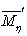 ,
,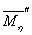 ,
,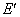 ,
, 列表表示如下:
列表表示如下:
表5.第二组聚合物体系验证结果

从表5可以看出用流体力学体积统计的粘均分子量误差0.92%可以接受。
用两组聚合物体系验证流体力学体积算术平方根作为统计因子的粘均分子量,相对误差很小,在可以接受的范围内。说明本文得出的粘均分子量的统计因子可以作为求聚合物粘均分子量的一种实用方法。
l 统计因子的理解
根据以上的分析,粘均分子量是分子量对分子流体力学体积的算术平方根分数作统计平均。这里是对某组分分子的分子链的流体力学体积求算术平方根以后在该组分所有的分子链数目作加和,而不是将所有分子链的流体力学体积加和之后在开平方。说明分子链流体力学体积的算术平方根是作为求特性粘度时分子链权重的衡量标准,而且每条分子链是独立地对结果产生影响。即:如果聚合物体系中存在N条分子链,且分为n 个组分,每组分分子的数目及分子量分别为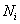 ,
,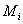 ,则统计因子应该表示为:
,则统计因子应该表示为: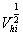 。
。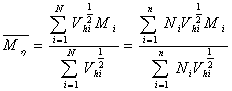 ,通常写的统计因子
,通常写的统计因子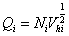 只是相同分子量的分子权重加和的结果,不算真正意义的统计因子。
只是相同分子量的分子权重加和的结果,不算真正意义的统计因子。
从这个角度重新理解其他分子量的统计因子如下:
数均分子量: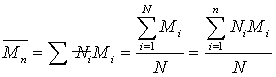 各分子权重相等。相同分子链的权重加和后为通常意义的统计因子:
各分子权重相等。相同分子链的权重加和后为通常意义的统计因子: ,
,
重均分子量: ,各分子链的分子量为其权重的衡量标准。相同分子的权重加和后得重量分数为通常意义的统计因子
,各分子链的分子量为其权重的衡量标准。相同分子的权重加和后得重量分数为通常意义的统计因子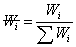 ,
,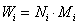
Z均分子量: ,各分子链的Z量为其权重的衡量标准,相同分子的权重加和后的通常意义的统计因子:
,各分子链的Z量为其权重的衡量标准,相同分子的权重加和后的通常意义的统计因子: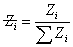 ,
,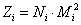
这也可以理解为什么Z均分子量的统计因子是分子链分子量平方与分子数目的乘积,而不是分子量与分子数目乘积后再平方。
仿照Z均分子量,可定义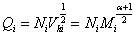 ,粘均分子量也可称为Q均分子量。
,粘均分子量也可称为Q均分子量。
l 粘度法测粘均分子量的实质:
通常用粘度法测聚合物粘均分子量的依据是MHS方程: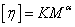 ,对与多组分体系,认为测量的特性粘度对应体系的粘均分子量,而所有分子链反映的特性粘度是各分子链特性粘度对某权重的加和:
,对与多组分体系,认为测量的特性粘度对应体系的粘均分子量,而所有分子链反映的特性粘度是各分子链特性粘度对某权重的加和:
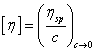
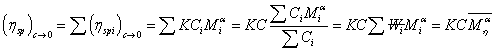
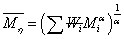
实验证明这样的推倒得出的结论是正确的,而且上文的论证也是在此基础上进行的。
也可以从另一个角度处理MHS方程,并推导多组分聚合物体系的粘均分子量: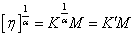 ,对体系的特性黏度处理,将
,对体系的特性黏度处理,将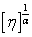 作为考察对象。对于多组分体系,认为本文得出的统计因子有效,各分子链对应的
作为考察对象。对于多组分体系,认为本文得出的统计因子有效,各分子链对应的 按分子链流体力学体积的算术平方根分数
按分子链流体力学体积的算术平方根分数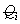 加和得到体系总的
加和得到体系总的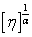 ,而且总的
,而且总的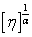 对应体系的粘均分子量:
对应体系的粘均分子量:
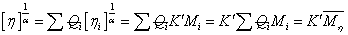
可见,如果以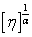 作为考察对象,可以说明黏度法测的确实是粘均分子量,只是为什么各组分的
作为考察对象,可以说明黏度法测的确实是粘均分子量,只是为什么各组分的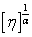 要以分子链流体力学体积的算术平方根作为统计因子,以及为什么粘均分子量是分子量对分子链流体力学体积的算术平方根的统计平均还未能给出理论证明。
要以分子链流体力学体积的算术平方根作为统计因子,以及为什么粘均分子量是分子量对分子链流体力学体积的算术平方根的统计平均还未能给出理论证明。
l 评价与讨论
1. 本文首先用数值方法求出了聚合物粘均分子量统计因子的表达式,然后对其修正,写出了具有实际物理意义的统计因子,并且能够用来比较准确地计算粘均分子量,具有实用性。但是对于统计因子的物理意义,即:分子链流体力学体积的算术平方根,没有给出理论证明,此为不足之处。
2. 从上文验证的结果看,用流体力学体积统计出的粘均分子量都比“实际”值偏少,这可能是修改数值结果时忽略了某些因素所致,可能数值结果 更有实际物理意义。也可能用MHS方程得出的结果偏大,即
更有实际物理意义。也可能用MHS方程得出的结果偏大,即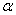 值偏大,即以前的测量不精确所致。
值偏大,即以前的测量不精确所致。
3. 如果以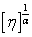 作为考察对象,可以说明粘度法测得的确实是粘均分子量。前提是各组分的
作为考察对象,可以说明粘度法测得的确实是粘均分子量。前提是各组分的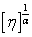 以粘均分子量的统计因子作统计平均。可是
以粘均分子量的统计因子作统计平均。可是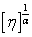 没有实际物理意义,并且特性黏度
没有实际物理意义,并且特性黏度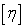 也无多大意义。MHS方程的参数
也无多大意义。MHS方程的参数 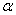 虽然反映分子链与溶剂间的相互作用关系,但只是通过实验得到的统计参数,未能从理论上推导出相互作用关系的确切形式,这就给粘均分子量统计因子的理论推导带来了困难。
虽然反映分子链与溶剂间的相互作用关系,但只是通过实验得到的统计参数,未能从理论上推导出相互作用关系的确切形式,这就给粘均分子量统计因子的理论推导带来了困难。
l 参考文献
[1].郑昌仁,高聚物分子量及其分布,化学工业出版社,北京,1986
[2].韩哲文,高分子科学教程,华东理工出版社,上海,2001
l 附件:
#include<stdio.h>
#include<math.h>
#define N 16 //实验的次数
#define M 59081 //实验测得的分子量
#define jindu 100 //计算精度
double data[N][2]={
15.776*10000,2.1,
12.792*10000,4.36,
10.666*10000,50.16,
8.710*10000,90.66,
7.211*10000,124.74,
5.929*10000,136.36,
4.875*10000,111.46,
4.009*10000,77.68,
3.296*10000,50.76,
2.71*10000,26.78,
2.234*10000,17.14,
1.837*10000,8.6,
1.51*10000,5.96,
1.242*10000,3.28,
1.021*10000,1.8,
0.839*10000,0.89
};
double function(double x) //用于计算每个x的Mη
{
int i;
double son=0,mother=0,m;
for(i=0;i<N;i++)
{
son+=data[i][1]*pow(data[i][0],x);
mother+=data[i][1]*pow(data[i][0],x-1);
}
m=son/mother;
return m;
}
int main()
{
double x1=0.0,x2=1.0,x,b;
while(1)
{
x=x1+(x2-x1)*0.618;
b=function(x)-M;
if(b<jindu&&b>-jindu)
break;
if(b<0)
x1=x;
else
x2=x;
}
printf("%lf %lf",x,function(x));
return 0;
}
说明:本程序为杨科大同学所编.
-
软件测试方案模板范文
项目名称测试方案仅供参考文档版本控制1概述软件的错误是不可避免的所以必须经过严格的测试通过对本软件的测试尽可能的发现软件中的错误借…
-
_软件测试计划范例
测试计划目录1概述111121314产品简介1范围1限制条件1参考文档12约定2212223测试目标2接收标准2资源和工具2资源2…
-
软件测试计划范例
测试计划目录1概述111121314产品简介1范围1限制条件1参考文档12约定2212223测试目标2接收标准2资源和工具2资源2…
-
软件测试案例
案例释疑案例11终点线前的遗憾说明课堂上讲述该案例目的是让学员明白软件在现代科学中的地位是非常重要的丝毫软件缺陷都可能带来严重后果…
-
软件测试经典案例
软件测试测试用例的经典例子一等价类划分问某程序规定quot输入三个整数abc分别作为三边的边长构成三角形通过程序判定所构成的三角形…
-
地窝堡乡“宪法、法律宣传月”活动总结
地窝堡乡“宪法、法律宣传月”活动总结今年四月是自治区第七个“宪法、法律宣传月”,在宣传月活动中,我们在按照区委宣传部、司法局、依法…
-
20xx排球训练总结
Xxx年度学期校排球队训练总结转眼一个学期即将过去了,排球队的训练也随着放假的临近而停止训练,纵观这个学期的训练情况,开学初,为了…
-
维修电工总结2
维修电工总结一、自觉加强理论学习。没有坚定真确的政治方向就不会有积极向上的指导思想。为了不时提高自己的政治思想素质。这几年来我一直…
-
店庆总结—得与失.doc20xx
店庆总结—得与失大福源购物广场一周年庆,一场精心准备的活动已经结束,在近半个月的活动中我们收获了很多:激情、感动、信心、友爱;而且…
-
宣传委员工作总结
作为班级的宣传委员,我的职责是受班长,团支书领导,对其负责,受其监督,并向其汇报工作,我有信心做好我的本职工作。首先,我协助团支书…