山东大学 生物化学实验七 蛋白质浓度测定
实验七 蛋白质浓度测定(Folin-酚试剂法)
13生物基地 201300140059 刘洋 20##-05-19
同组者:张奕
一、实验目的
1.学习分光光度计的原理和使用方法。
2.熟悉并掌握福林(Folin)—酚法测定蛋白质浓度的原理和方法。
3.进一步掌握比色法或分光光度法,准确测定未知样品。
4.学习并掌握移液枪的使用方法。
5.学会绘制标准曲线图。
二、实验原理
蛋白质或多肽分子中有带酚基酪氨酸或色氨酸,在碱性条件下,可使酚试剂中的磷钼酸化合物还原成蓝色(生成钼蓝和钨蓝化合物)。蓝色的深浅与蛋白质的含量成正比,可用比色法测定
蛋白质浓度从它们的物理化学性质,如折射率,比重,紫外吸收测定而得知,或化学方法,如定氮,双缩脲反应。Folin—酚法是一般实验室中经常使用的方法。Folin—酚法是双缩脲法的发展,反应的第一步涉及碱性溶液中铜一蛋白质复合物的形成,然后这个复合物去还磷钼酸—磷钨酸试剂(Folin试剂),产生深蓝色(钼蓝和钨蓝混合物)。Folin—酚法灵敏度高,较双缩脲法灵敏100倍。
Folin—酚试剂法最早由Lowry确定了蛋白质浓度测定的基本步骤。以后在生物化学领域得到广泛的应用。这个测定法的优点是灵敏度高,比双缩脲法灵敏得多。缺点是费时间较长,要精确控制操作时间,标准曲线也不是严格的直线形式,且专一性较差,干扰物质较多。所测蛋白质样品中若含酚类及柠檬酸均有干扰作用,浓度较低的尿素(约0.5%左右),胍(0.5%左右),硫酸钠(1%),硝酸钠(1%),三氯乙酸(0.5%),乙醇(5%)乙醚(5%),丙酮(0.5%)等溶液对显色反应影响,这些物质浓度高时必须做校正曲线。含硫酸铵的溶液只须加浓碳酸钠—氢氧化钠溶液即可显色测定。若样品酸度较高,显色后色浅。则必须提高碳酸钠—氢氧化钠溶液的浓度1—2倍。
进行测定时,加Folin—酚试剂时要特别小心,因为该试剂仅在酸性pH条件下稳定,但上述还原反应只在pH=10的情况下发生,故当Folin一酚试剂加到碱性的铜—蛋白质溶液中时,必须立即混匀,以便在磷钼酸—磷钨酸试剂被破坏之前,还原反应即能发生。
此法也适用于酪氨酸和色氨酸的定量测定。此法可检测的最低蛋白质量达5μg。通常测定范围是5~100μg。
三、实验器材
1.材料
血清(使用前稀释200倍)
2.试剂
1.标准酪蛋白溶液:200μg/ml。
2.Folin-酚试剂甲液:(碱性铜溶液)
A液:4%Na2CO3:0.2M NaOH=1:1
B液:1%CuSO4:2%酒石酸钠=1:1
临用时,按甲:乙=50:1混合使用。混合后的溶液一日内有效,即现用现配。
3.Folin-酚试剂乙液:
将100g钨酸钠、25g钼酸钠、700ml蒸馏水、50ml85%磷酸以及100ml浓盐酸置于1500ml的磨口圆底烧瓶中,充分混匀后,接上磨口冷凝管,回流10小时。再加入硫酸锂150g,蒸馏水50ml及液溴数滴,开口煮沸15分钟,在通风橱内驱除过量的溴。冷却,稀释至1000ml,过滤,滤液成微绿色,贮于棕色瓶中。临用时,用标准氢氧化钠溶液滴定,用酚酞作指示剂(由于试剂微绿,影响滴定终点的观察,可以将试剂稀释100倍再滴定)。根据滴定结果,将试剂稀释至相当于1mol/L的酸(稀释一倍左右)。贮于冰箱中可以长期保存。
4.去离子水。
3.器具
试管及试管架、移液枪以及塑料枪头、722型分光光度计、烧杯、标签纸等。
四、实验步骤
1.标准曲线的制作。
取6支洗净并试管,分别加入0, 0.2 , 0.4, 0.6, 0.8, 1.0毫升标准酪蛋白溶液(500微克/毫升),然后用水补足到1.0毫升,并用标签纸做好标记,编号依次为0、1、2、3、4、5,不要混淆试管。接着按顺序向各管分别加入5毫升Folin—酚试剂甲液,混匀(使用专门混匀液体的仪器),30℃水浴保温10分钟。保温结束后取出,再依次向各管加入0.5毫升Folin—酚试剂乙液,立即混匀(使用专门混匀液体的仪器),30℃水浴保温30分钟。保温结束后取出,于640nm处比色。每次测定前,要先润洗比色管。记录每个试管中溶液的比色值,然后以光密度(0.D)为纵坐标,以酪蛋白溶液浓度为横坐标,绘制酪蛋白的标准曲线。
2.血清样品的测定。
取3支试管,分别加入0.2ml的血清稀释液(稀释的目的是使其蛋白质含量在酪蛋白标准曲线范围之内),再分别加0.8ml的去离子水使使试管中样品液体积达到1.0ml。然后分别贴上标签纸,编号为7、8、9。 接着按顺序向各管分别加入5毫升Folin—酚试剂甲液,混匀(使用专门混匀液体的仪器),30℃水浴保温10分钟。保温结束后取出,再依次向各管加入0.5毫升Folin—酚试剂乙液,立即混匀(使用专门混匀液体的仪器),30℃水浴保温30分钟。保温结束后取出,于640nm处比色。每次测定前,要先润洗比色管。记录每个试管中溶液的比色值。或者,先将三支样品试管的比色值取平均数,然后再去标准曲线查找相对的蛋白质浓度值。
3.计算。
依据记录的3支试管中的血清样品的比色值读数在标准曲线上分别查出相应对应的酪蛋白溶液浓度,再折算成每毫升血清稀释液含蛋白质的微克数。然后乘以稀释倍数,得出每毫升未稀释血清蛋白质的微克数,最后计算出每100毫升血清样品中所含的蛋白质的克数。这样会有四个结果,然后取平均值,即为最后结果数据。
五、实验结果
1、实验数据记录表:
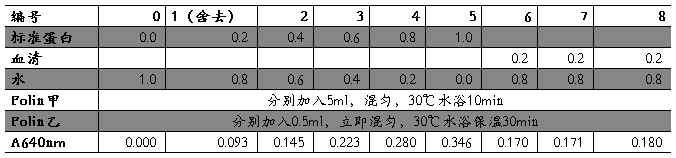
2、标准曲线的绘制
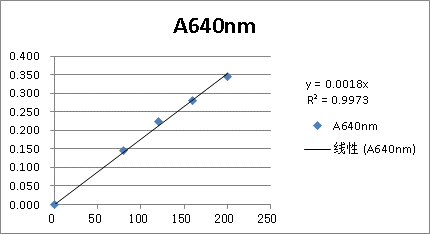
(注意:因为酪蛋白溶液和样品溶液都加入5mlFolin-酚试剂甲液和0.5mlFolin-酚试剂乙液然后再去测比色值,所以在绘制标准曲线时,直接使用标准酪蛋白溶液加水配成的1ml酪蛋白溶液的浓度即可,这样方便在全测定完后计算样品溶液浓度。)
3、计算样品中蛋白浓度:
(1)对于四支试管中样品溶液的比色值,取平均数:
(0.170+0.171)/2=0.1705
(2)对比标准曲线:
根据六支试管测定的数值,绘制标准曲线,曲线即此处的直线,是根据六个数据拟合的直线。由OD值=0.1705读出对应的酪蛋白溶液浓度为94.722μg/ml。
(3)样品溶液中蛋白质含量的计算公式:
样品溶液中的蛋白质含量=(X*5*200)/(10^6)=94722mg/mL=94.7g/L
(样品溶液稀释了200倍,再加入试管测比色值;10^6μg=1g)
六、结果分析
1.我们小组本次实验顺利完成。对于实验结果,可以看到4支平行试管中样品溶液的比色值基本一致,说明平行性好,更是说明实验成功完成,前面的操作没有失误。
2.在没有大失误的前提下,对于结果同真实值有差距的误差进行分析,误差可能有如下来源:
(1)使用移液枪加试剂时,移液枪中残留一些液体使得加入的变少,或者移液枪的枪头外侧沾有液体并一起加入试管中使得加入的变多。
(2)使用分光光度计测比色值时,比色管润洗的不重分。
第二篇:浙江大学生物化学实验甲 蛋白质浓度的测定








-
蛋白质的定量测定实验报告
显问题其次回顾全部过程的原理我们猜测可能存在的造成结果低的情况为在室温冷却后实验室没有空余的分光光度计排队时间应该是全部小组中最长…
-
蛋白质浓度的测定实验报告
一试验原理蛋白质浓度的测定考马斯亮蓝能与蛋白质的疏水微区相结合这种结合具有高敏感性考马斯亮蓝G250的磷酸溶液呈棕红色最大吸收峰在…
-
福林(Folin)-酚试剂法测定蛋白质的浓度实验报告完整版
福林Folin酚试剂法测定蛋白质的浓度一原理蛋白质或多肽分子中有带酚基酪氨酸或色氨酸在碱性条件下可使酚试剂中的磷钼酸化合物还原成蓝…
-
紫外分光光度法测定蛋白质含量实验报告
紫外分光光度法测定蛋白质含量一实验目的1学习紫外光度法测定蛋白质含量的原理2掌握紫外分光光度法测蛋白质含量的实验技术二实验原理1测…
-
蛋白质测定实验报告
蛋白质测定方法化学报告蛋白质的检测酚试剂法灵敏度较高20250mg费时蛋白质在碱性溶酚类柠檬液中其肽键与酸硫酸铵Cu2螯合形成tr…
-
蛋白质测定实验报告
蛋白质测定方法化学报告蛋白质的检测酚试剂法灵敏度较高20250mg费时蛋白质在碱性溶酚类柠檬液中其肽键与酸硫酸铵Cu2螯合形成tr…
-
蛋白质功能性质的检测实验报告
华南农业大学实验报告专业班次组别题目蛋白质功能性质的检测姓名黄俊怡日期20xx0711一实验目的通过本实验定性地了解蛋白质的主要功…
-
SCAU实验报告蛋白质功能性质的检测
蛋白质功能性质的检测一实验目的通过本实验定性地了解蛋白质的主要功能性质二实验原理蛋白质的功能性质一般是指能使蛋白质成为人们所需要的…
-
实验报告 蛋白质分子的测定
实验一蛋白质分子的测定凝胶层析法一实验原理凝胶层析法即凝胶过滤法gelfiltration是利用凝胶把分子大小不同的物质分离开的一…
-
蛋白质的定量测定实验报告
显问题其次回顾全部过程的原理我们猜测可能存在的造成结果低的情况为在室温冷却后实验室没有空余的分光光度计排队时间应该是全部小组中最长…
-
板书6 实验六 考马斯亮兰G250染色法测定人体血清蛋白含量
板书实验六考马斯亮兰G250染色法测定人体血清蛋白含量实验目的1熟练掌握分光光度仪的规范化操作程序和注意事项2掌握考马斯亮兰染色法…