pH计的使用及溶液pH的测定实验报告
pH计的使用及溶液pH的测定
一、实验目的
1、熟悉pH构造和测定原理
2、掌握用pH计测定溶液pH步骤
二、实验原理
1、pH计内部构造,如图所示:

2、pH计原理:
玻璃电极使用前,必须在水溶液中浸泡,使之生成一个三层结构,即中间的干玻璃层和两边的水化硅胶层。浸泡后的玻璃膜示意图:
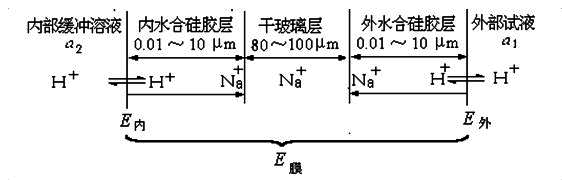
水化硅胶层具有界面,构成单独的一相,厚度一般为0.01~10 μm。在水化层,玻璃上的Na+与H+发生离子交换而产生相界电位。
水化层表面可视作阳离子交换剂。溶液中H+经水化层扩散至干玻璃层,干玻璃层的阳离子向外扩散以补偿溶出的离子,离子的相对移动产生扩散电位。两者之和构成膜电位。
将浸泡后的玻璃电极放入待测溶液,水合硅胶层表面与溶液中的H+活度不同,形成活度差,H+由活度大的一方向活度小的一方迁移, 平衡时:
H+溶液== H+硅胶
E内 = k1 + 0.059 lg( a2 / a2’)
E外 = k2 + 0.059 lg(a1 / a1’)
a1 、 a2 分别表示外部试液和电极内参比溶液的H+活度;
a’1 、 a’2 分别表示玻璃膜外、内水合硅胶层表面的H+活度;
k1 、 k2 则是由玻璃膜外、内表面性质决定的常数。
由于玻璃膜内、外表面的性质基本相同,则k1=k2 , a’1 = a’2
E膜 = E外 - E内 = 0.059 lg( a1 / a2)
由于内参比溶液中的H+活度( a2)是固定的,则:
E膜 = K´ + 0.059 lg a1 = K´ - 0.059 pH试液

用电位法测定溶液的pH值时,E电池=K+0.059 pH。由于K是无法测量的,我们可以利用在相同条件下测pH值与之相近的标准缓冲溶液Es=K+0.592 pH,再通过两式来消除K,从而求得pHx= pHs+(Es-Ex)/ 0.0592V
三、实验步骤
1、调零 先用蒸馏水冲洗电极,并用滤纸粘干,将其插入pH=6.864的标准缓冲溶液中,待读数稳定后按“定位”键,当pH计显示pH=6.86时,按“确认”键。若读数不为6.86时,在标定一次,知道读数为6.86为止。
2、测酸样 将电极清洗后插入到pH=4.003的缓冲溶液中,待读数稳定后,当pH计显示pH=4.00时,按“确认”键。清洗电极并用滤纸粘干,插入待测酸液中,待pH计读数稳定时,读数并记录。
3、测碱样 将电极清洗后插入到pH=9.182的缓冲溶液中,待读数稳定后,当pH计显示pH=9.18时,按“确认”键。清洗电极并用滤纸粘干,插入待测酸液中,待pH计读数稳定时,读数并记录。
四、 数据处理

第二篇:用PH计测定溶液PH值





-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
化学实验 pH计的使用
pH计的使用pH计工作原理测定pH时把指示电极与参比电极组成电池测定电池电动势因为参比电极的电极电位保持不变所以溶液pH的变化引起…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
-
化学-电解质溶液-同离子效应”实验报告
中国石油大学华东现代远程教育实验报告课程名称普通化学化学原理1实验名称电解质溶液同离子效应实验形式在线模拟现场实践学生姓名号年级专…
-
《水溶液中的解离平衡》实验报告
二实验步骤一同离子效应取两只小试管01molLHAc溶液及滴甲基橙混合均匀溶液呈红色在一试管中加入少量NaAcs观察指示剂颜色变化…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…