4缓冲溶液的配制与pH值的测定
实验三 缓冲溶液的配制与pH值的测定
1.实验目的
(1)掌握缓冲溶液的配制原理和方法;
(2)熟悉有关缓冲溶液配制的计算公式;
(3)了解缓冲溶液的有关性质;
(4)学习用pH计测定溶液的pH值;
2.实验原理
在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH值基本不变的作用称为缓冲作用。具有缓冲作用的溶液称为缓冲溶液。
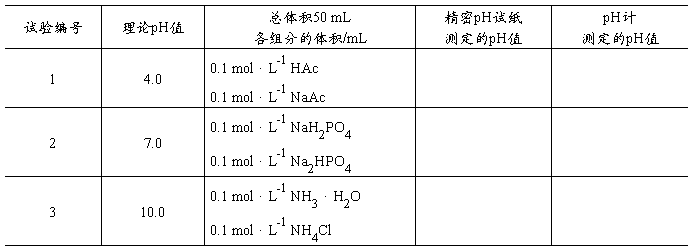
缓冲溶液一般是由共轭酸碱对组成的,例如弱酸及其盐,或弱碱及其盐,以及多元弱酸的酸式盐及其次级盐。如果缓冲溶液由弱酸及其盐(例如HAc-NaAc)组成,则
HAc ? ????????H+ + Ac-
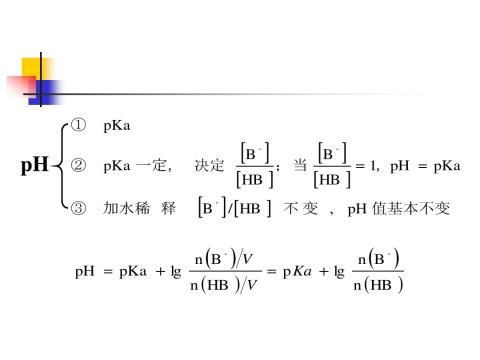
当加入少量酸时,平衡左移,氢离子浓度几乎不变;同样,当加入少量碱时,平衡右移,氢离子浓度也几乎不变。在缓冲溶液中,氢离子浓度与pH值的计算公式可表示为:
[H+]»Ka´c酸/c盐
pH=pKa-lg c酸/c盐
可以看出,溶液稀释时,质子酸及其盐的浓度等同地变小,其比值不变,氢离子浓度也不变。因此,由于缓冲溶液中具有抗酸成分和抗碱成分,所以加入少量强酸或强碱,或被稀释时,其溶液的pH值基本上是不变的。
缓冲容量是衡量缓冲溶液缓冲能力大小的尺度。缓冲容量的大小与缓冲组分浓度和缓冲组分的比值有关。缓冲组分浓度越大,缓冲容量越大;缓冲组分比值为1:1时,缓冲容量最大。使用缓冲溶液时,常选用质子酸的pKa与所配pH值接近的缓冲体系,质子酸及其盐的总浓度在0.01~0.1 mol·L-1,质子酸及其盐的浓度比值在0.1~10范围。
在实际工作中,常常需要配制一定pH值的缓冲溶液。
3.实验仪器与试剂
Delta-320pH计,试管,量筒(100 mL,10mL),烧杯(100 mL,500 mL),吸量管(10 mL)等。
HAc(0.1 mol·L-1,1 mol·L-1),NaAc(0.1 mol·L-1,1 mol·L-1),NaH2PO4(0.1 mol·L-1),Na2HPO4(0.1 mol·L-1),NH3·H2O(0.1 mol·L-1),NH4Cl(0.1 mol·L-1),HCl(0.1 mol·L-1),NaOH(0.1 mol·L-1,1 mol·L-1),pH=4的HCl,pH=10的NaOH,pH=4.00标准缓冲溶液,pH=6.86标准缓冲溶液, pH=9.18标准缓冲溶液,甲基红溶液,广泛pH试纸,精密pH试纸,吸水纸等。
4.实验步骤
(1)缓冲溶液的配制与pH值的测定
按照表3.3-1,通过计算配制三种不同pH值的缓冲溶液。然后用精密pH试纸和pH计分别测定它们的pH值。比较理论计算值与两种测定方法实验值是否相符(溶液留作后面实验用)。
(2)缓冲溶液的性质
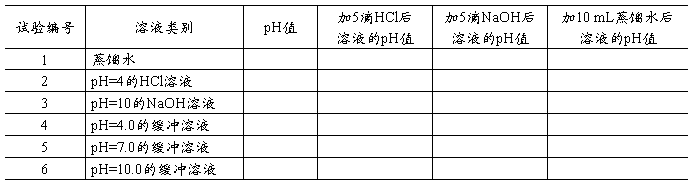
①取3支试管,依次加入蒸馏水,pH=4的HCl溶液,pH=10的NaOH溶液各3 mL,用pH试纸测其pH值。然后向各管加入5滴0.1 mol·L-1 HCl,再测其pH值。用相同的方法,试验5滴0.1 mol·L-1 NaOH对上述三种溶液pH值的影响。
将结果记录在表1.3-1中。
②取3支试管,依次加入自己配制的pH=4.0、pH=7.0、pH=10.0的缓冲溶液各3 mL。然后向各管加入5滴0.1 mol·L-1 HCl,测其pH值。用相同的方法,试验5滴0.1mol·L-1 NaOH对上述三种缓冲溶液pH值的影响。将实验结果记录在表3.3-1中。
表3.3-1 缓冲溶液的配置与pH值的测定
③取4支试管,依次加入pH=4.0的缓冲溶液,pH=4的HCl溶液,pH=10.0的缓冲溶液,pH=10的NaOH溶液各l mL,用精密pH试纸测定各管中溶液的pH值。然后向各管中加10 mL水,混匀后再用精密pH试纸测其pH值,考查稀释对上述四种溶液pH值的影响。将实验结果记录于表3.3-2中。
通过以上实验结果,说明缓冲溶液的什么性质?
表3.3-2 缓冲溶液的性质
(3)缓冲溶液的缓冲能力
①缓冲容量与缓冲组分浓度的关系
取两支大试管,在一管中加入0.1 mol·L-1 HAC和0.1 mol·L-1 NaAc各3 mL,另一管中加入1 mol·L-1 HAc和1 mol·L-1 NaAc各3 mL,混匀后测定两管内溶液的pH值(是否相同)?在两管中分别滴人2滴甲基红指示剂,溶液呈何色?(甲基红在pH<4.2时呈红色,pH>6.3时呈黄色=。然后在两管中分别逐滴加入l mol·L-1 NaOH溶液(每加入1滴NaOH均需摇匀),直至溶液的颜色变成黄色。记录各管所滴人NaOH的滴数,说明哪一管中缓冲溶液的缓冲容量大。
②缓冲容量与缓冲组分比值的关系
取两支大试管,用吸量管在一管中加人0.1 mol·L-1 NaH2PO4和Na2HPO4各10 mL,另一管中加入2 mL 0.1 mol·L-1 NaH2PO4和18 mL 0.1 mol·L-1 Na2HPO4,混匀后用精密pH试纸分别测量两管中溶液的pH值。然后在每管中各加入1.8 mL 0.1 mol·L-1 NaOH,混匀后再用精密pH试纸分别测量两管中溶液的pH值。说明哪一管中缓冲溶液的缓冲容量大。
5.思考题
(1)在NH3 ·H2O-NH4 Cl溶液中加入少量的强酸或强碱,为什么溶液的pH值基本上保持不变?
(2)根据你实验的结果,欲配制一定体积pH=3.20的缓冲溶液,选择下列三对缓冲对中的那一对为最佳?HCOOH-HCOONa、HAc-NaAc、NaH2PO4-H3PO4。(假定每种溶液的浓度均为0.1mol·L-1.)
(3)硼砂(Na2B4O5(OH)4 ·8H2O)溶液是否具有缓冲作用,为什么?
(李志强编)
第二篇:缓冲溶液pH值的计算







-
缓冲溶液配制实验
第1页共2页实验报告二缓冲溶液的配制和PH的测定区县学号姓名成绩实验内容1HAcNaAc缓冲溶液的配制注意百里酚蓝指示剂的变色范围…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
分析化学实验-常用缓冲溶液的配制及原理-北理工
分析化学实验缓冲溶液配制原理amp常用缓冲溶液的配制一缓冲溶液与缓冲作用原理一缓冲作用与缓冲溶液纯水在25时PH值为70但只要与空…
-
生物化学实验常用试剂、缓冲溶液的配制
生物化学实验常用试剂缓冲溶液的配制方法httpvokbiocomnewsviewaspid9105molL氢氧化钠溶液组份浓度05…
-
矿井维修电工技师工作总结
电工技师工作总结我于20xx年参加“金蓝领”电工技师培训班,通过学习获得技师职业资格,现就几年来的工作做一下总结。几年来,在我矿领…
-
Hatwsx20xx年财务工作总结
|||生活|一个人总要走陌生的路,看陌生的风景,听陌生的歌,然后在某个不经意的瞬间,你会发现,原本费尽心机想要忘记的事情真的就这么…
-
列 检 技 师 个 人 技 术 总 结
我叫bbb,今年bb岁,中专文化,现担任bbb列检四班检车员,自19xx年参加工作以来,从事了xx年的检车工作。在工作中经师傅的指…
-
20xx年工作总结及20xx年工作计划
“金龙欢庆公司创辉煌、银蛇舞动全员迎新年”。20xx年财务部的工作紧紧围绕年初领导提出的20xx年工作重点和20xx年财务科工作计…
-
团委学生支部工作总结
转眼间一年的时光飞逝,在过去的年当中,我院分团委学生部不仅出色地完成了各项基本工作,而且在工作中积极响应学校各种号召,开展形式多样…