保健食品配方、配方依据及研发报告
保健食品配方、配方依据及研发报告
一、保健食品的概念和分类:
(一)概念:
《保健食品注册管理办法》中规定,保健食品是指声称具有特定保健功能或者以补充维生素、矿物质为目的的食品。即适宜于特定人群食用,具有调节机体功能,不以治疗疾病为目的,并且对人体不产生任何急性、亚急性或者慢性危害的食品。
(二)分类:
调节功能类:具有调节机体功能的保健食品(中医理论或/和现代研究指导组方保健食品通多属于此类)。
国家药监局公布的27项保健功能中都有此类产品,涉及的保健食品类别具体为:增强免疫力、辅助降脂、辅助降糖、抗氧化、辅助改善记忆力、缓解视疲劳、促进排铅、清咽功能、辅助降血压、改善睡眠、促进泌乳、缓解体力疲劳、提高缺氧耐受力、对辐射危害有辅助保护功能、减肥、改善生长发育、改善营养性贫血、对化学性肝损伤有辅助保护、祛痤疮、祛黄褐斑、改善皮肤水分、改善皮肤油分、通便功能、对胃粘膜损伤有辅助保护功能、调节肠道菌群、促进消化。 补充营养素类:以补充维生素、矿物质为目的, 不以提供能量为目的的保健产品。
二、调节功能类保健食品要求:
多数功能类保健食品是以天然药物及其提取物为主要原料辅以食物辅料制成(除部分补充营养素类保健食品外)。
1、组方合理,中医药理论或/和现代研究的科学依据充分。
2、具有一定的保健功能;
3、可长期安全使用。
三、原料和辅料:
1
(一)概念:
原料:是指与保健食品功能相关的初始物料。
辅料:是指生产保健食品时所用的赋形剂及其他附加物料。
(二)原辅料选用的范围和依据:
1、范围:
国家食品药品监督管理局公布的可用于保健食品的原辅料;
卫生部公布或者批准可以食用的原辅料;
生产普通食品所使用的原辅料。
2、依据:
《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号)、 《中国食物成分表》、
《营养强化剂卫生标准》(GB14880)、
《关于印发《营养素补充剂申报与审评规定(试行)》等8个相关规定的通告》:
《营养素补充剂申报与审评规定(试行)》
《真菌类保健食品申报与审评规定(试行)》
《益生菌类保健食品申报与审评规定(试行)》
《核酸类保健食品申报与审评规定(试行)》
《野生动植物类保健食品申报与审评规定(试行)》
《氨基酸螯合物等保健食品申报与审评规定(试行)》
《应用大孔吸附树脂分离纯化工艺产品的保健食品申报与审评规定(试行)》 《保健食品申报与审评补充规定(试行)》
《卫生部关于限制以野生动植物及其产品为原料生产保健食品的通知》(卫法监发〔2001〕160号)、
《卫生部关于限制以甘草、麻黄草、苁蓉和雪莲及其产品为原料生产保健食品的通知》(卫法监发〔2001〕188号)、
《卫生部关于不再审批以熊胆粉和肌酸为原料生产的保健食品的通告》(卫法监发〔2001〕267号)等。
《食品添加剂使用卫生标准》(GB2760)
(三)物料:
2
1、常用品种:
(1) 原料:
1)普通食品(中国食物成分表):
北京大学医学出版社于20xx年6月出版了由中国疾病预防控制中心营养与食品安全所编著《中国食物成分表2004》包括了757条食物的近5万个最新数据。该书除包含《中国食物成分表2002》(书中所列食物以原料为主,共包括1506条食物的31项营养成分(含胆固醇)数据、657条食物的18项氨基酸数据等,附录中收录了208条食物的血糖生成指数数据)内容外,还补充了食物样品描述信息,便于使用者了解食物的具体信息和寻找对应的食物,增加了总膳食纤维、可溶性膳食纤维、不溶性膳食纤维、维生素B6、维生素B12、维生素K1、生物素、泛酸、胆碱、叶酸等对健康有益的成分数据。
2)卫生部关于进一步规范保健食品原料管理的通知(卫法监发[2002]51号)对保健品中可添加的中药成分规定如下:
卫生部关于进一步规范保健食品原料管理的通知
(卫法监发[2002]51号)
表1 药食两用品种(87种)
(按笔划顺序排列)
丁香、八角茴香、刀豆、小茴香、小蓟、山药、山楂、马齿苋、乌梢蛇、乌梅、木瓜、火麻仁、代代花、玉竹、甘草、白芷、白果、白扁豆、白扁豆花、龙眼肉(桂圆)、决明子、百合、肉豆蔻、肉桂、余甘子、佛手、杏仁(甜、苦)、沙棘、牡蛎、芡实、花椒、赤小豆、阿胶、鸡内金、麦芽、昆布、枣(大枣、酸枣、黑枣)、罗汉果、郁李仁、金银花、青果、鱼腥草、姜(生姜、干姜)、枳椇子、枸杞子、栀子、砂仁、胖大海、茯苓、香橼、香薷、桃仁、桑叶、桑椹、桔红、桔梗、益智仁、荷叶、莱菔子、莲子、高良姜、淡竹叶、淡豆豉、菊花、菊苣、黄芥子、黄精、紫苏、紫苏籽、葛根、黑芝麻、黑胡椒、槐米、槐花、蒲公英、蜂蜜、榧子、酸枣仁、鲜白茅根、鲜芦根、蝮蛇、橘皮、薄荷、薏苡仁、薤白、覆盆子、藿香。
表2 可用品种(114种)
(按笔划顺序排列)
人参、人参叶、人参果、三七、土茯苓、大蓟、女贞子、山茱萸、川牛膝、川贝 3
母、川芎、马鹿胎、马鹿茸、马鹿骨、丹参、五加皮、五味子、升麻、天门冬、天麻、太子参、巴戟天、木香、木贼、牛蒡子、牛蒡根、车前子、车前草、北沙参、平贝母、玄参、生地黄、生何首乌、白及、白术、白芍、白豆蔻、石决明、石斛、地骨皮、当归、竹茹、红花、红景天、西洋参、吴茱萸、怀牛膝、杜仲、杜仲叶、沙苑子、牡丹皮、芦荟、苍术、补骨脂、诃子、赤芍、远志、麦门冬、龟甲、佩兰、侧柏叶、制大黄、制何首乌、刺五加、刺玫果、泽兰、泽泻、玫瑰花、玫瑰茄、知母、罗布麻、苦丁茶、金荞麦、金樱子、青皮、厚朴、厚朴花、姜黄、枳壳、枳实、柏子仁、珍珠、绞股蓝、胡芦巴、茜草、荜茇、韭菜子、首乌藤、香附、骨碎补、党参、桑白皮、桑枝、浙贝母、益母草、积雪草、淫羊藿、菟丝子、野菊花、银杏叶、黄芪、湖北贝母、番泻叶、蛤蚧、越橘、槐实、蒲黄、蒺藜、蜂胶、酸角、墨旱莲、熟大黄、熟地黄、鳖甲。
3)《关于印发《营养素补充剂申报与审评规定(试行)》等8个相关规定的通告》中可选用品种:
① 营养素补充剂:
具体参照《营养素补充剂申报与审评规定(试行)》(种类见后表《营养素补充剂申报与审评规定(试行)》表1维生素、矿物质的种类和用量)。
②真菌类:
《真菌类保健食品申报与审评规定(试行)》中可用于生产保健食品的真菌菌种有11种:
酿酒酵母 Saccharomyces cerevisiae
产朊假丝酵母 Candida utilis
乳酸克鲁维酵母 Kluyveromyces lactis
卡氏酵母 Saccharomyces carlsbergensis
蝙蝠蛾拟青霉 Paecilomyces hepialid Chen et Dai, sp. Nov 蝙蝠蛾被毛孢 Hirsutella hepialid Chen et Shen
灵芝 Ganoderma lucidum
紫芝 Ganoderma sinensis
松杉灵芝 Ganoderma tsugae
红曲霉 Monacus anka
紫红曲霉 Monacus purpureus
4
③益生菌类:
《益生菌类保健食品申报与审评规定(试行)》可用于生产保健食品的益生菌有10种:
两岐双岐杆菌 Bifidobacterium bifidum
婴儿双岐杆菌 Bifidobacterium infantis
长双岐杆菌 Bifidobacterium longum
短双岐杆菌 Bifidobacterium breve
青春双岐杆菌 Bifidobacterium adolescentis
德氏乳杆菌保加利亚种 Lactobacillus delbrueckii subsp. bulgaricus 嗜酸乳杆菌 Lactobacillus acidophilus
干酪乳杆菌干酪亚种 Lactobacillus casei subsp. Casei
嗜热链球菌 Streptococcus thermophilus
罗伊氏乳杆菌 Lactobacillus reuteri
④核酸:
⑤野生动植物:
人工驯养繁殖或人工栽培的国家二级保护野生动植物及其产品;国家保护的有益的或者有重要经济、科学研究价值的陆生野生动植物及其产品;中华人民共和国林业植物新品种保护名录中植物及其产品;人工栽培的甘草、苁蓉和雪莲及其产品;
⑥氨基酸螯合物等:
氨基酸螯合物;微生物发酵物;褪黑素、大豆磷脂、芦荟、蚂蚁、甲壳素、超氧化物歧化酶(SOD)、动物性原料(包括胎盘、骨等)、植物原料(红景天、花粉、石斛等)、螺旋藻;酒;不饱和脂肪酸;
4)新资源食品:
原(辅)料不在规定范围的,亦不在禁用品的新研制、新发现、新引进的无食用习惯或仅在个别地区有食用习惯的,须按照新资源食品的要求进行安全性独立学评价并提供相关资料后使用。
(2)辅料:
1)用途:
赋型剂、填充剂、成型剂、甜味剂、着色剂及包衣剂、胶囊皮的组分。 5
2)分类:
食品添加剂、药用辅料、其他。
3)范围:
《食品添加剂使用卫生标准》(GB2760)、
卫生部公告的食品添加剂新品种名单中的品种、
药用辅料、
食品。
2、禁用品种:
(1)有毒物品:
卫生部关于进一步规范保健食品原料管理的通知(卫法监发[2002]51号)
表3 保健食品禁用物品名单
八角莲、八里麻、千金子、土青木香、山莨菪、川乌、广防已、马桑叶、马钱子、六角莲、天仙子、巴豆、水银、长春花、甘遂、生天南星、生半夏、生白附子、生狼毒、白降丹、石蒜、关木通、农吉痢、夹竹桃、朱砂、米壳(罂粟壳)、红升丹、红豆杉、红茴香、红粉、羊角拗、羊踯躅、丽江山慈姑、京大戟、昆明山海棠、河豚、闹羊花、青娘虫、鱼藤、洋地黄、洋金花、牵牛子、砒石(白砒、红砒、砒霜)、草乌、香加皮(杠柳皮)、骆驼蓬、鬼臼、莽草、铁棒槌、铃兰、雪上一枝蒿、黄花夹竹桃、斑蝥、硫磺、雄黄、雷公藤、颠茄、藜芦、蟾酥。
(2)其他物品:
1)濒危药材:
国家一级和二级保护野生动植物及其产品;人工驯养繁殖或人工栽培的国家一级保护野生动植物及其产品;
野生甘草、苁蓉、雪莲及其产品;
2)经过基因修饰的菌种;
3)单一DAN或RNA;
4)肌酸、熊胆粉;
5)金属硫蛋白(暂不受理和审批)。
(四)用量:
1、普通食品:
6
可参考中国营养学会公布的《中国居民膳食营养素参考摄入量(DRI)》与《中国食物成分表2004》等确定具体用量。 2、中药:
以《中华人民共和国药典》的记载为主,其用量建议应在《药典》记载药物的常用量1/2-1/3范围内(与汤剂、丸剂相比,提取后可以增效,故减少使用剂量)。
性味偏烈的动植物物品用量原则上不应超过国家相关标准规定下限剂量的1/2;性味平和的动植物物品用量不宜超过国家相关标准规定的上限剂量。超过上述计量应提供食用剂量的安全依据。 3、营养素补充剂:
《营养素补充剂申报与审评规定(试行)》等8个相关规定的通告”中《营养素补充剂申报与评审规定(试行)》对营养素补充剂的用量作出以下要求:
1)适宜人群为成人的,其维生素、矿物质的每日摄入量应符合以下规定:
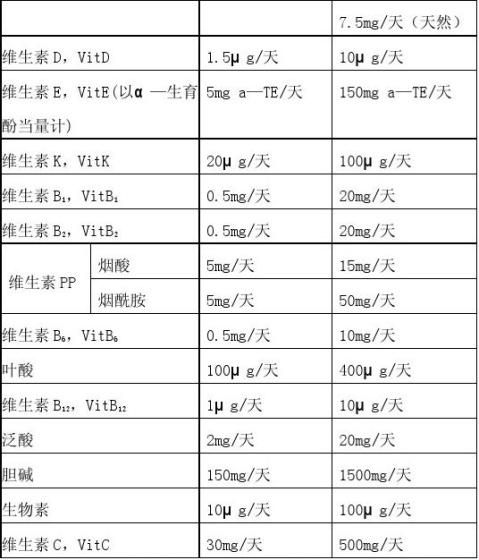
《营养素补充剂申报与审评规定(试行)》 表1 维生素、矿物质的种类和用量
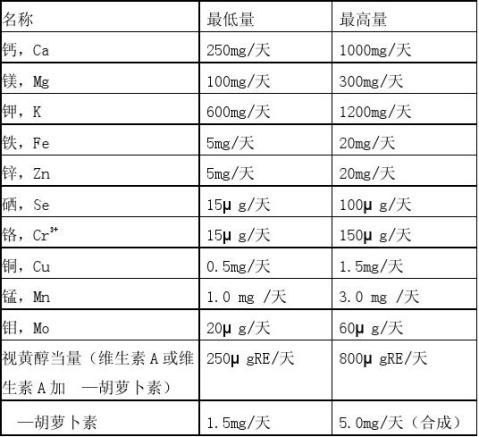
7
入量应控制在我国该人群该种营养素摄入量(RNIs或AIs)的1/3~2/3。
3)产品每日摄入的总量:颗粒剂每日食用量不得超过20g,口服液每日食用量不得超过30mL。 4、特殊原(辅)料用量:
核酸类保健食品,其核酸的每日推荐食用量为0.6g-1.2g。 以褪黑素为原料的保健食品,褪黑素的推荐食用量为1~3mg/日。 以芦荟为原料的保健食品,芦荟的食用量控制在2g以下(以原料干品计),以芦荟凝胶为原料的除外。
以酒为载体的保健食品,产品酒精度不得超过38度,每日食用量不超过100mL。
不饱和脂肪酸为原料的保健食品,每日推荐用量不超过20mL,不得加热烹
8
调。
(五)要求:
1、符合国家标准和卫生要求(如无国家标准,须符合行业标准或自行制定的质量标准)。
2、对人体健康安全无害。有限量要求的物质,其用量不得超过国家的有关规定。
3、辅料应当仅以满足产品工艺需要或改善产品色、香、味为目的,并且应当符合相应得国家标准。
4、特殊物料的具体要求:
(1)营养素补充剂:
a.仅限于补充维生素和矿物质.维生素和矿物质的种类应当符合(维生素,矿物质种类和用量)的规定。
b.《维生素、矿物质化合物名单》中的物品可作为营养素补充剂的原料来源,从食物的可食部分提取的维生素和矿物质,不得含有达到作用剂量的其他生物活性物质。
c.辅料应当仅以满足产品工艺需要或改善产品色、香、味为目的,并且应当符合相应的国家标准。
(2)真菌类:
申请真菌类保健食品,除按保健食品注册管理的有关规定提交资料外,还应提供以下资料:
a.产品配方及配方依据中应包括确定的菌种属名、种名及菌株号。菌种的属名、种名应有对应的拉丁学名。
b.菌种的培养条件(培养基、培养温度等)。
c.菌种来源及国内外安全食用资料。
d.国家食品药品监督管理局确定的鉴定机构出具的菌种鉴定报告。
e.菌种的安全性评价资料(包括毒力试验)。菌种及其代谢产物必须无毒无害,不得在生产用培养基内加入有毒有害物质和致敏性物质。有可能产生抗菌素、真菌毒素或其他活性物质的菌种还应包括有关抗菌素、真菌毒素或其他活性物质的检测报告。
f.菌种的保藏方法、复壮方法及传代次数,防止菌种变异方法。 9
g.对经过驯化、诱变的菌种,应提供驯化、诱变的方法及驯化剂、诱变剂等资料。
h.生产的技术规范和技术保证。
i.生产条件符合《保健食品生产良好规范》的证明文件。
申请使用《可用于保健食品的真菌菌种名单》之外的真菌菌种研制、开发和生产保健食品,还应提供菌种具有功效作用的研究报告、相关文献资料和菌种及其代谢产物不产生任何有毒有害作用的资料。
(3)益生菌类:
申请益生菌类保健食品,除按保健食品注册管理有关规定提交申报资料外,还应提供以下资料:
a.产品配方及配方依据中应包括确定的菌种属名、种名及菌株号。菌种的属名、种名应有对应的拉丁学名。
b.菌种的培养条件(培养基、培养温度等)。
c.菌种来源及国内外安全食用资料。
d.国家食品药品监督管理局确定的鉴定机构出具的菌种鉴定报告。 e.菌种的安全性评价资料(包括毒力试验)。
f.菌种的保藏方法。
g.对经过驯化、诱变的菌种,应提供驯化、诱变的方法及驯化剂、诱变剂等资料。
h.以死菌和/或其代谢产物为主要功能因子的保健食品应提供功能因子或特征成分的名称和检测方法。
i.生产的技术规范和技术保证。
j.生产条件符合《保健食品生产良好规范》的证明文件。
使用《可用于保健食品的益生菌菌种名单》之外的益生菌菌种的,还应当提供菌种具有功效作用的研究报告、相关文献资料和菌种及其代谢产物不产生任何有毒有害作用的资料。
(4)核酸类:
申请核酸类保健食品,除须按保健食品的要求提交资料外,还应当提供以下资料:
a.产品配方及配方依据中应明确所用核酸的具体成分名称、来源、含量; 10
b.与所申报功能直接相关的科学文献依据;
c.企业标准中应明确标出所用核酸各成分的含量、纯度和相应的定性、定量检测方法以及质量标准;
d.提供所用核酸原料的详细生产工艺(包括加工助剂名称、用量);
e.国家食品药品监督管理局确定的检验机构出具的核酸原料的纯度检测报告。
f.不得以单一的DNA或RNA作为原料申报保健食品;保健食品中所使用核酸,其单一原料纯度应大于80%。
(5)野生动植物类:
使用人工驯养繁殖或人工栽培的国家二级保护野生动植物及其产品作为保健食品原料的,应提供省级以上农业(渔业)、林业行政主管部门出具的允许开发利用的证明文件。
使用国家保护的有益的或者有重要经济、科学研究价值的陆生野生动植物及其产品作为保健食品原料的,应提供省级以上农业(渔业)、林业行政主管部门依据管理职能出具的允许开发利用的证明文件。
使用中华人民共和国林业植物新品种保护名录中植物及其产品作为保健食品原料的,如果该种植物已获“品种权”,应提供该种植物品种权所有人许可使用的证明;如该种植物尚未取得品种权,应提供国务院林业主管部门出具的该种品种尚未取得品种权的证明。
对于进口保健食品中使用《濒危野生动植物种国际贸易公约》名录中动植物及其产品的,应提供国务院农业(渔业)、林业行政主管部门准许其进口的批准证明文件、进出口许可证及海关的证明文件。
使用人工栽培的甘草、苁蓉和雪莲及其产品作为保健食品原料的,应提供原料来源、购销合同以及原料供应商出具的收购许可证(复印件)。
(6)氨基酸螯合物等:
1申请注册使用氨基酸螯合物生产的保健食品,○除按保健食品注册管理有关规定提交有关资料外,还应提供如下资料:
a.提供明确的产品化学结构式、物理化学性质,配体与金属离子之比、游离元素和总元素之比。
b.提供氨基酸螯合物定性、定量的检测方法(包括原料和产品)以及国家食 11
品药品监督管理局确定的检验机构出具的验证报告。
c.国家食品药品监督管理局确定的检验机构出具的急性毒性试验加做停食16小时后空腹一次灌胃试验(分别在灌胃2小时、4小时后重点观察消化道大体解剖和病理变化情况)和30天喂养试验[肝、肾、胃肠(包括十二指肠、空肠、回肠)的组织病理报告。
d.国内外该氨基酸螯合物食用的文献资料。
2申请注册使用微生物发酵直接生产的保健食品,○除按保健食品有关规定提交相关资料外,还需提供下列资料:
a.菌种来源及国家食品药品监督管理局确定的检验机构出具的菌种鉴定报告。
b.菌种的毒力试验报告。
c.菌种的安全性评价报告。
e.国内外该菌种用于食品生产的文献资料。
f.发酵终产物的质量标准(包括纯度、杂质成分及含量)。
3申请注册以褪黑素为原料生产的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.产品配方中除褪黑素和必要的辅料(赋形剂)外,不得添加其他成分(维生素B6除外)。
b.申请人应提供褪黑素原料的检测报告,其纯度应达到99.5%以上。 c.申报的保健功能暂限定为改善睡眠。
d.注意事项中应注明从事驾驶、机械作业或危险操作者,不要在操作前或操作中食用和自身免疫症(类风湿等)及甲亢患者慎用。
4申请注册以大豆磷脂为原料生产的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.申请人应提供大豆磷脂原料的丙酮不溶物和乙醚不溶物含量检测报告。 b.使用的大豆磷脂原料应符合《磷脂通用技术条件》(SB/T10206)中一级品的要求。
5申请注册以芦荟为原料生产的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.申请人须提供省级以上专业鉴定机构出具的芦荟品种鉴定报告。 12
b.可作为保健食品原料的芦荟品种为库拉索芦荟和好望角芦荟。其他芦荟品种应按有关规定,提供该品种原料的安全性毒理学评价试验报告及相关的食用安全的文献资料。
c芦荟原料应符合《食用芦荟制品》(QB/T2489)的要求。
d. 不适宜人群须标明孕产妇、乳母及慢性腹泻者。
e. 注意事项须注明食用本品后如出现明显腹泻者,请立即停止食用。
6申请注册以蚂蚁为原料生产的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.申请人应提供省级以上专业鉴定机构出具的蚁种鉴定报告,并需提供蚂蚁原料来源证明。
b.可作为保健食品原料的蚂蚁品种为拟黑多刺蚁、双齿多刺蚁、黑翅土白蚁、黄翅大白蚁、台湾乳白蚁。其他蚂蚁品种应按有关规定,提供该品种原料的安全性毒理学评价试验报告及相关的食用安全的文献资料。
c.产品生产加工过程中,温度一般不超过80℃。
e.提供蚁酸含量测定报告。
f.注意事项须注明过敏体质者慎用。
7申请注册以酒为载体的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.不得申报辅助降血脂和对化学性肝损伤有辅助保护功能。
8申请注册不饱和脂肪酸类保健食品应符合下列要求: ○
a.食用方法不得加热烹调。
b.产品以每日食用量定量包装。
9申请注册以甲壳素为原料生产的保健食品, ○除按照保健食品注册有关规定提交资料外,还需提供下列资料,并符合下列要求:
a.申请人应提供甲壳素原料的脱乙酰度检测报告。
b.甲壳素原料的脱乙酰度应大于85%。
10申请注册以超氧化物歧化酶 ○(SOD)为原料生产的保健食品应符合下列要求:
a.超氧化物歧化酶(SOD)应从天然食品的可食部分提取,其提取加工过程符合食品生产加工要求。
13
b.以超氧化物歧化酶(SOD)为原料生产的保健食品,申报的保健功能暂限定为抗氧化。
c.以超氧化物歧化酶(SOD)单一原料申请保健食品时,应提供超氧化物歧化酶(SOD)在人体内口服吸收利用率、体内代谢等的国内外研究资料,证明超氧化物歧化酶(SOD)可经口服吸收。
d.以超氧化物歧化酶(SOD)组合其他功能原料申请保健食品时,加入的功能原料应具有抗氧化作用。产品不得以超氧化物歧化酶(SOD)命名,不得宣传超氧化物歧化酶(SOD)的作用。
11申请注册以下原料生产的保健食品,除按保健食品规定提交申报资料外, ○
还应提供:
使用动物性原料(包括胎盘、骨等)的,应提供原料来源证明及县级以上畜牧检疫机构出具的检疫证明。
使用红景天、花粉、螺旋藻等有不同品种植物原料的,应提供省级以上专业鉴定机构出具的品种鉴定报告。
使用石斛的,应提供省级以上专业鉴定机构出具的石斛品种鉴定报告和省级食品药品监督管理部门出具的人工栽培现场考察报告。
(六)来源:
1、可直接使用的:
食品厂、药厂
2、须提供有关证明的:
化工厂、饲料厂添加剂厂、其他厂
3、进口的:
(1)符合国内原料要求
(2)对于进口保健食品中使用《濒危野生动植物种国际贸易公约》名录中动植物及其产品的,应提供国务院农业(渔业)、林业行政主管部门准许其进口的批准证明文件、进出口许可证及海关的证明文件。
四、配方要求、配伍原理及依据:
(一)配方要求:
14
1、原料应符合有关规定。
2、原料个数:
总个数不得超过14个;表1之外的动植物物品(或原料),个数不得超过4个;使用表1和表2之外的动植物物品(或原料),个数不得超过1个,且该物品(或原料)应参照《食品安全性毒理学评价程序》(GB15193.1-1994)中对食品新资源和新资源食品的有关要求进行安全性毒理学评价。以普通食品作为原料生产保健食品的,不受本条规定的限制。
《卫生部关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号)中规定。
3、配伍应科学、合理。
(二)配伍原理:(配伍的组成及用量应有科学性、必要性、合理性)
1、按传统中医药理论研制的,是否已提供配方的依据及配方中所用原料及多种原料配合的依据,并尽可能提供现代医学理论的支持或补充的科学文献资料。
2、按现代医学理论研制的,是否应用现代医学理论及研究成果,进行配方依据的描述,并提供了充足的相关科学文献资料。
3、配伍合理性:首先应注意审查原料间有无配伍禁忌,对人体安全性是否产生影响;其次应审查原料配伍后所具有申报功能的依据,以中药复方为主原料者应阐述配伍规律
(三)配伍依据
1、文献依据:
文献要求:
专业期刊、原始文献、法规性文献,具有参考价值(能说明安全性、功能性)。
2、研究依据:
实验研究证明配伍的合理性,实验设计科学合理,实验结果可重复,结论可靠、能说明问题。
五、研发报告:
(一)思路:(产品研发思路应具有科学性和合理性)
15
1、立项依据应具有科学性、合理性:
立项依据应符合现代医学理论和中医传统养生理论,预期达到的保健功能和科学水平客观及产品研发具有可行性。
2、背景:
对适宜人群的健康状况和国内外市场需求及现有产品情况进行全面的调查分析。
3、特色:
对国内外同类产品或相似产品的数量和所占比例等基本状况进行统计分析,与同类产品比较,应具备配方、资源、工艺、剂型等特点与优势。
(二)功能筛选:
保健功能筛选应具有科学性、安全性、可行性,主要从配方筛选、原料功效与安全性、功效成分的确定等几个方面确定。
1、配方筛选方法、结果和筛选依据的科学性:
配方应根据保健食品法规要求、申报功能与配伍依据、生产企业特点、市场需求状况及资源优势等方面进行筛选。
2、所选原料的功效作用、用量、安全性及配伍关系:
原料与保健功能应相符,原料来源真实,质理可控,用量安全可靠、配伍合理。
3、功效成分或标志性成分确定应具有合理性:
功效成分/标志性成分有充足的科学研究及科学文献支持,具有与保健功能基本一致的功效作用,或有合理的质控指标,标测方法成熟、稳定、便于质控,新建立的检测方法应提供方法学考察研究资料。
六、配方、配方依据及研发报告存在的问题:
(一)材料(原料、辅料):
1、来源:
(1)不明;
(2)生产企业不符合要求;
(3)生产过程不符合要求(不清、不妥);
16
(4)质量标准缺乏或不符合有关要求。
2、品种:
(1)不合法(法律、规定);
(2)数量过多。
3、用量:
(1)过大/过小/无依据;
(2)食品添加剂作原料,用量过大(添加剂用量很小)。
(二)配方要求、配伍原理及依据:
1、配伍原理:
(1)不合理;
(2)依据不足。
2、配方书写:
(1)总量不对(应1000单位);
(2)名称不对(药材、提取物、化学类别或化合物);
(3)完整性不对(原料保密或只有主药、特别是辅料缺或不全或缺量);
(4)不规范。
3、配方依据:
(1)叙述不妥、不全(意义、原理 、基本没有叙述);
(2)缺乏依据(没有提供足够依据、没有依据)。
(三)研发报告:
1、立项依据的科学性、合理性不够,研发背景不详、产品优势不突出;
2、配方不筛选或筛选方法不妥,原料用量依据不足(安全和功能);
3、功效成分确定缺乏依据。
17
-
保健食品配方、配方依据及研发报告
保健食品配方配方依据及研发报告一保健食品的概念和分类一概念保健食品注册管理办法中规定保健食品是指声称具有特定保健功能或者以补充维生…
-
中药保健品研制报告
Xx软胶囊研制报告07资源姚晓一产品研发报告1产品开发思路1预期产品预期达到保健功能和科学水平延缓衰老增强免疫力功能包括抗癌抗疲劳…
-
研发可行性报告参考模板 - 注册保健食品
健脾八珍糕注册保健食品可行性研究报告项目名称保健食品健脾八珍糕注册类别保健食品批准证书立项人邹昶20xx年9月15日第一章项目概况…
-
β-葡聚糖保健食品批文申报研发报告
产品研发报告一产品的研发思路葡聚糖是禾谷类植物籽粒胚乳和糊粉层细胞壁的主要成分近20年来围绕着从禾谷类植物中提取的葡聚糖国内外学者…
-
蚂蚁类保健食品开发可行性研究报告
蚂蚁类保健食品开发可行性研究报告昆虫是地球上最大的生物类群分布广泛种类繁多生命繁殖能力强食用昆虫营养价值也逐渐被公认其共同特点是蛋…
-
20xx-20xx年中国动物保健品行业市场竞争态势分析及标杆企业调查研究报告
中国行业研究报告咨询系列基本信息行业市场研究属于企业战略研究范畴作为当前应用最为广泛的咨询服务其研究成果以报告形式呈现通常包含以下…
-
鲨鱼保健食品项目可行性研究报告(技术工艺+设备选型+财务概算+厂区规划)方案设计
鲨鱼保健食品项目可行性研究报告技术工艺设备选型财务概算厂区规划方案设计编制机构博思远略咨询360投资情报研究中心研究思路关键词识别…
-
保健品行业研究分析报告及未来发展
目录第一章保健品行业现状211保健品概念及分类212世界保健食品行业的发展阶段与国外保健食品的概况313中国保健品行业的发展历程5…
-
保健产品市场调查研究报告
南京市保健品市场调查研究报告说明1本研究结论适用于南京地区其它区域市场有类似之处但在某些方面可能有较大的差异2本研究结论具有时间性…
-
中国老年人保健品行业市场分析与发展策略研究报告(20xx-20xx)
中国老年人保健品行业市场分析与发展策略研究报告20xx20xx出版时间20xx年正文目前中国65岁及以上老人近12亿约占全国总人口…