化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告
1.概述
化学反应速率用符号J或ξ表示,其定义为:
J=dξ/dt (3-1)
ξ为反应进度,单位是mol,t为时间,单位是s。所以单位时间的反应进度即为反应速率。
dξ=v-1BdnB (3-2)
将式(3-2)代入式(3-1)得:
J=v-1BdnB/dt
式中nB为物质B的物质的量,dnB/dt是物质B的物质的量对时间的变化率,vB为物质B的化学计量数(对反应物vB取负值,产物vB取正值)。反应速率J总为正值。J的单位是mol·s-1。

根据质量作用定律,若A与B按下式反应:
aA+bB→cC+dD
其反应速率方程为:
J=kca(A)cb(B)
k为反应速率常数。
a+b=n
n为反应级数。n=1称为一级反应,n=2为二级反应,三级反应较少。反应级数有时不能从方程式判定,如:
2HI→I2+H2
看起来是二级反应。实际上是一级反应,因为
HI→H+I(慢)
HI+H→H2+I(快)
I+I→I2(快)
反应决定于第一步慢反应,是一级反应。从上述可知,反应级数应由实验测定。
反应速率的测定
测定反应速率的方法很多,可直接分析反应物或产物浓度的变化,也可利用反应前后颜色的改变、导电性的变化等来测定,如:
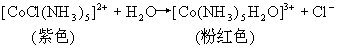
可通过分析溶液中Cl-离子浓度的增加,确定反应速率,也可利用反应物和产物颜色不同,所导致的光学性质的差异进行测定。从上式还可以看到,反应前后离子个数和离子电荷数都有所改变,溶液的导电性有变化,所以也可用导电性的改变测定反应速率。概括地说,任何性质只要它与反应物(或产物)的浓度有函数关系,便可用来测定反应速率。但对于反应速率很快的
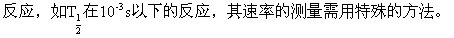
本实验测定(NH4)2S2O8(过二硫酸铵)和KI反应的速率是利用一个
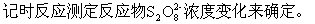
在水溶液中,(NH4)2S2O8和KI发生以下反应:
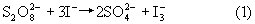
这个反应的平均反应速率可用下式表示
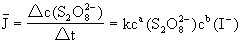
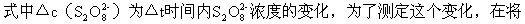
(NH4)2S2O8溶液和KI溶液混合时,同时加入一定体积的已知浓度的Na2S2O3
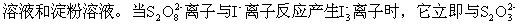
反应:
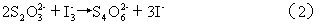


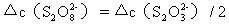
记录从反应开始到溶液出现蓝色所需要的时间Δt。由于在Δt时间内

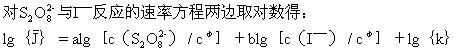
式中,{k}代表量k的数值。

可求得反应速率常数k。
根据阿伦尼乌斯公式:

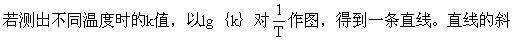
率等于-Ea/2.303R,通过计算求出活化能Ea。
2.实验目的
(1)掌握浓度、温度及催化剂对化学反应速率的影响。
(2)测定过二硫酸铵与碘化钾反应的反应速率,并计算反应级数、反应速率常数及反应的活化能。
(3)初步练习用计算机进行数据处理。
3.实验内容
(1)实验浓度对化学反应速率的影响
在室温下,取3个量筒分别量取20ml 0.20mol·L-1 KI溶液、8.0ml 0.010 mol· L-1 Na2S2O3溶液和 4.0mL 0.2%淀粉溶液,均加到150mL烧杯中,混合均匀。再用另一个量筒取 20mL0.20mol· L-1(NH4)2S2O8溶液,快速加到烧杯中,同时开动秒表,并不断搅拌。当溶液刚出现蓝色时,立即停秒表,记下时间及室温。
用同样的方法按照表3-1中的用量进行另外4次实验。为了使每次实验中的溶液的离子强度和总体积保持不变,不足的量分别用0.20mol·L-1 KNO3溶液和0.20mol·L-1(NH4)2SO4溶液补足。
表3-1 不同浓度时平均反应速率

用表中实验Ⅰ,Ⅱ,Ⅲ的数据作图求出a,用实验Ⅰ,Ⅳ,Ⅴ的数据作图求出b,然后再计算出反应速率常数k。
(2)温度对化学反应速率的影响
按表3-1实验Ⅳ中的用量,把KI,Na2S2O3,KNO3和淀粉的混合溶液加到150mL烧杯中,把(NH4)2S2O8溶液加到另一个烧杯中,并将两个烧杯放入冰水浴中冷却。等烧杯中的溶液都冷到O℃时,把(NH4)2S2O8溶液加到KI混合溶液中,同时开动秒表,并不断搅拌,当溶液刚出现蓝色时,记下反应时间。
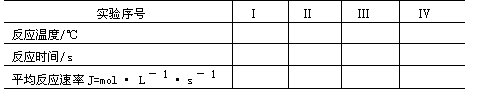
在10℃,20℃和30℃的条件下,重复上述实验。将结果填于表3-2中。用表3.2的数据,以lg{k}对1/T作图,求出反应(1)的活化能。
表3-2不同温度时平均反应速率
(3)催化剂对反应速率的影响
在 150mL烧杯中加入10mL 0.20mol·L-1KI溶液,4.0mL淀粉溶液,8.0mL 0.010mol·L-1 Na2S2O3溶液和10mL 0.20mol·L-1 KNO3溶液,再加入1滴0.02mol·L-1 Cu(NO3)2溶液。搅拌均匀,然后迅速加入20mL 0.20mol·L-1(NH4)2S2O8溶液,搅拌,记下反应时间,并与前面不加催化剂的实验进行比较。
4.思考题
(1)通过上述实验总结温度、浓度、催化剂对反应速率的影响。
(2)上述反应中,溶液出现蓝色是否反应终止?
另外,实验数据的处理,除了用方格纸作图并进行计算外,还可以利用计算机进行数据处理。计算机处理实验数据的程序及使用说明如下:
帮助文件
使用说明:
1.打开与选择菜单
(1)按F10键即可激活顶层菜单,然后使用方向键(→,←)选择顶层菜单项,按回车(Enter)键即可打开所选择的菜单。使用热键(Alt+菜单上加亮的字母)即可快速地打开该字母所对应的菜单。
(2)打开菜单后即可使用方向键(↑,↓)选择菜单项,选中后按回车键即可执行此菜单项。打开菜单后,按菜单项中加亮的字母也可以执行该菜单项。使用热键(菜单项后部提示的组合键)即可快速地执行对应的菜单项。
(3)当一个菜单项处于灰色时,表示该菜单项当前不可使用,必须进行一些前备工作后才可以使用。
(4)任何时候当选择“OK”或“确认”即表示确认本次操作。选择Cancel或“取消”即表示取消本次操作。
第二篇:2-1-1化学反应速率
第六章化学反应速率化学平衡
第一节 化学反应速率
【教学目的】
1、了解化学反应速率的概念及表示方法;
2、、初步学会用化学反应速率的简单计算;
3、了解影响化学反应速率的条件。
【教学重点】
化学反应速率的概念及表示方法。
【教学难点】
化学反应速率的概念的理解。
【学法指导】
化学反应速率要求学生掌握速率计算,速率的影响因素,其中影响因素建议同学通过实验探究达到掌握的目的。改变固体、纯液体的量不能影响反应速率。
【教学过程】
[引入]各种化学反应进行的快慢不同。有的反应进行得极快,如炸药爆炸;有的反应进行得很慢,如石灰石溶洞形成的反应;有的反应不用催化剂也进行得很快,如酸碱中和反应,有的不作用催化剂则进行得非常慢,如氮气和氢气合成氨气。
[观察与思考]进行下列实验,观察并比较两个反应放出氢气的快慢。
取两支试管,各加入5mL 0.5mol/L盐酸,再剪取相同大小的镁条和铁片,用砂纸打磨后,分别放入两支试管中。
[小结]上述实验中,镁与盐酸反应放出氢气显然比铁要快,我们如何来表示化学反应的快慢呢?
[板书]一、化学反应速率
1、概念:是衡量化学反应快慢的物理量。
2、表示方法:用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
单位:mol·(L·s)-1 或mol·(L·min) -1。
3、公式:
【例1】在一定条件下,一份双氧水样品经过2h,H2O2的浓度从5×10-2mol·L-1下降到3×10-2mol·L-1。双氧水样品在这2h中分解的平均速率是多少?
[解析] v(H2O2) =(5×10-2mol·L-1-3×10-2mol·L-1)/120min = 1.67×10-4 mol·(L·min) -1
【例2】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A + 2B = 3C 。反应经2min后,A的浓度从开始时的1.0mol·L-1下降到0.8mol·L-1。 已知反应开始时B的浓度是1.2mol·L-1,求:
(1)2min末B、C的的浓度。
(2)以单位时间内A的浓度的减小来2min内该反应的平均速率。
[活动与探究]完成下列实验,分析影响过氧化氢分解反应速率的因素。
【实验1】取两支大试管,各加入5mL4%的过氧化氢溶液(即双氧水),分别滴入几滴洗涤剂,将其中一支用水浴加热,观察并比较两支试管中发生的变化。
【实验2】取两支大试管,各加入5mL4%的过氧化氢溶液,用药匙向其中一支试管内加入少量二氧化锰粉末,分别滴入几滴洗涤剂,观察发生的变化。
【实验3】取两支大试管,分别加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1氯化铁溶液,观察气泡产生的快慢。

[板书]二、影响化学反应速率的因素:
1、内因:化学反应速率的大小首先取决于反应物的性质(这是最本质的原因)。
2、外因:外界条件(即反应物的浓度、反应的温度和压强、加入催化剂等)。
(1)反应的温度越高,反应速率越大;
(2)反应物的浓度越大,反应速率越大;
(3)加入催化剂能显著增大反应速率;
(4)其它……。
[问题解决]应用化学反应速率有有关知识解释下列问题。
(1)氢气能在氧气中安静地燃烧,点燃氢气和氧气的混合气体为什么会发生爆炸?
(2)燃烧含硫矿石(如黄铁矿)制备SO2气体时,要把矿石粉碎成颗粒状,在沸腾炉中鼓入强大空气流,把矿粒吹得剧烈沸腾。
(3)一小块白磷露置于空气中,一段时间后会突然燃烧。
(4)工业上用氮气和氢气合成氨要使用催化剂。
2、为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过测定反应中生成的CO2气体体积随时间变化的情况,绘制出图2-1所示的曲线。请分析讨论以下问题。
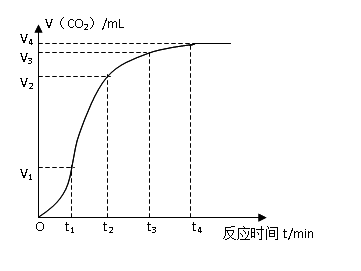
(1)在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是 时间段,收集到气体最多的是 时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加。
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系:化学化工学院班级:化学061学号:13姓名:实验名称:燃烧热的测定日期:20XX.5.20同组者姓名:室温气…