2-实验-化学反应速率和化学平衡
化学20(杭州学军中学陈进前编制)
实验 化学反应速率和化学平衡
[教学目标]
1.知识目标
(1)巩固浓度、温度和催化剂对化学反应速率的影响等基本知识,加深浓度、温度对化学平衡影响等基础知识的理解。
(2)通过实验,体会用定量方法研究化学反应速率、化学平衡规律基本程序,掌握相关的实验操作规范。
(3)掌握“Na2S2O3+H2SO4=Na2SO4+S+H2O、FeCl3+3KSCN Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
2.能力和方法目标
(1)定量实验中数据采集、记录和处理方法。
(2)通过从实验现象、实验数据推测理论规律,提高推理分析能力。
3.情感和价值观目标
本实验中的实验现象生动有趣、实验操作简便、推理和分析过程引人入胜,所以可以通过本实验来提高学生学习化学的兴趣,引发学生探究规律、研究自然现象的乐趣。
[实验内容和实验要点]
本学生实验共包含浓度对化学反应速率的影响、温度对化学反应速率的影响、催化剂对化学反应速率的影响、浓度对化学平衡的影响、温度对化学平衡的影响等5个内容,实验过程中既有定性研究要求、又有定量研究要求,要求学生用定性和定量两方面的综合思维来分析和研究。实验中应要求带着研究的观点、在探究的层面上去思考。本实验的各个内容中所涉及的实验技能、实验注意事项等列表如下:
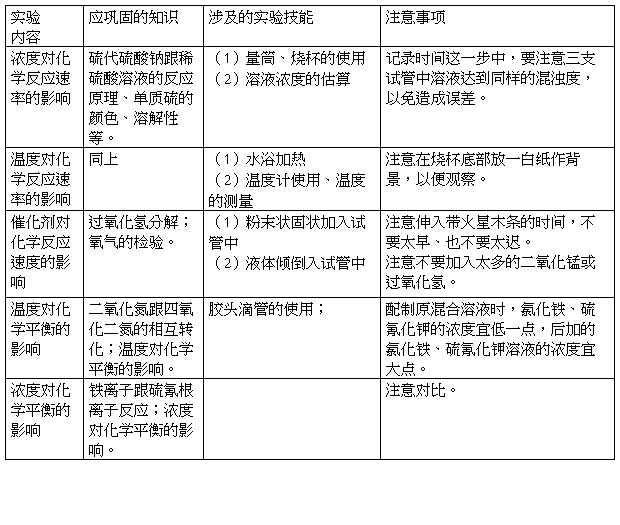
教师在学生做实验前,应把以上各要点向学生交待清楚。使学生有所准备。
实验过程要求学生观察实验现象、记录实验现象,最后完成实验报告。
第二篇:化学反应速率 化学平衡实验
实验二十二 化学反应速率 化学平衡
实验日期:__年__月__日 星期:___
[实验用品]
1. 试管、试管架、胶头滴管、NO2平衡仪,
2. 0.01 mol/L KMnO4溶液、0.1 mol/L H2C2O4溶液、0.2 mol/L H2C2O4溶液、3 mol/L H2SO4溶液、0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、3%的H2O2溶液、家用洗涤剂、MnO2粉末、0.1 mol/L K2Cr2O7溶液、浓H2SO4溶液、6 mol/L NaOH溶液、冰水、热水。
[实验操作]
1. 影响化学反应速率的因素
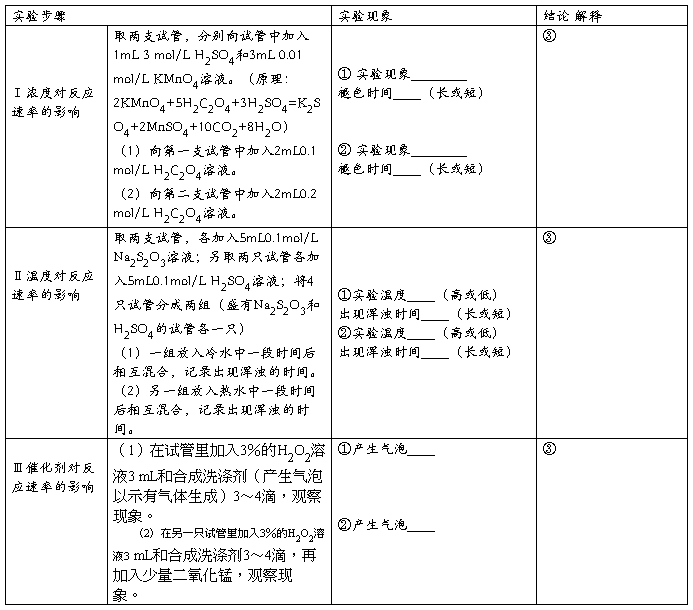
2. 化学平衡的移动

[实验习题]
1.影响化学反应速率的内部因素是____,外部因素有____、____、____、____以及光辐照,放射线辐照,超声波,电弧,强磁场,高速研磨等等。
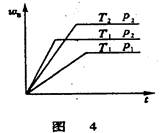 2. 已知某可逆反应aA(气)+bB(气)
2. 已知某可逆反应aA(气)+bB(气) cC(气)+Q在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气中B的质量分数(wB)与反应时间(t)的关系如图4所示。下列判断正确的是( )。
cC(气)+Q在密闭容器中进行,在不同温度(T1和T2)及压强(p1和p2)下,混合气中B的质量分数(wB)与反应时间(t)的关系如图4所示。下列判断正确的是( )。
A.T1<T2, P1<P2, a+b >c, Q<0
B.T1>T2, P1<P2, a+b <c, Q<0
C. T1<T2, P1>P2, a+b <c, Q<0
D. T1>T2, P1>P2, a+b >c, Q>0
3.对于反应:N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( )
2NO,在密闭容器中进行,下列条件能加快反应速率的是 ( )
A、缩小体积使压强增大 B、体积不变充入氮气使压强增大
C、体积不变充入惰性气体 D、使总压强不变,充入惰性气体
4.在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(固)+3B(气)  2C(气)+D(气)已达平衡状态的是 ( )
2C(气)+D(气)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.A的物质的量浓度 D.气体的总物质的量
5.如何应用平衡移动原理判断浓度、温度的变化对化学平衡移动方向的影响?
[参考答案]
[实验操作]
1.Ⅰ①KMnO4溶液的紫色褪去,长 ②KMnO4溶液的紫色褪去,短③增大浓度化学反应速率加快 Ⅱ①低(以实验时温度为准),长 ②高(以实验时温度为准),短 ③升高温度化学反应速率加快 Ⅲ①慢 ②快 ③加入催化剂,化学反应速率加快。
2. Ⅰ ①橙色加深 ②黄色加深 ③增大生成物浓度使化学平衡逆向移动,减小生成物浓度使化学平衡正向移动 Ⅱ ①红棕色变浅 ②红棕色变深。③升高温度化学平衡向吸热方向移动,降低温度化学平衡向放热方向移动。
[实验习题]
1. 反应物本身性质,浓度、温度、压强、催化剂。
2. B 3.A 4. B
5.其他条件不变时,增大反应物或减小生成物浓度,平衡向正反应方向移动,减小反应物或增大生成物浓度平衡向逆反应方向移动;升高温度平衡向吸热方向移动,降低温度平衡向放热方向移动。
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量2化学反应速率的…
-
高中化学选修4知识点总结:第二章化学反应速率和化学平衡【人教版新课标】
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…