大学实验化学 化学反应速率

难题解析 [TOP]
例7-1 HNO2分解反应机理如下,求总反应的速率方程表示式。

分析 复合反应的每一步都是元反应,反应的速率方程由速率控制步骤决定。
解 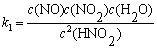 ,
, 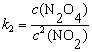
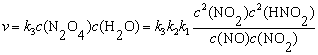
=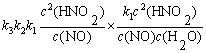
v =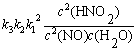
例 7-2 证明一级反应完成99.9%所需要的时间近似为半衰期的10倍。
解 t1/2 = 0.693/ k
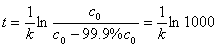
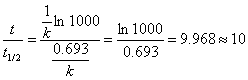
例 7-3 根据如下的气相反应相关数据
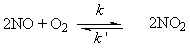
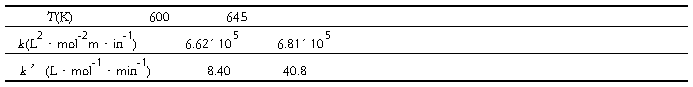
求:(1)两个温度下的平衡常数。
(2)正向反应和逆向反应的活化能。
解 (1)600K时,
640K时,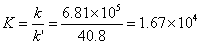
(2)正反应的活化 
=  =2.02 kJ·mol-1
=2.02 kJ·mol-1
逆反应的活化能 
=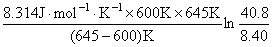 =113.0 kJ·mol-1
=113.0 kJ·mol-1
学生自测题 [TOP] 判断题 选择题 填空题 问答题 计算题
一、判断题(对的打√,错的打×)
1.化学反应速率常数kA与反应物的浓度有关。 ( )
2.对于元反应,反应速率常数总是随着温度的升高而增大。 ( )
3.凡速率方程式中各物质浓度的指数等于反应方程式中其化学式前的系数时,此反应为元反应。( )
4.质量作用定律仅适用于元反应。 ( )
5.反应N2(g)+3H2(g)→2NH3(g),因N2、H2、NH3都处于同一相中,所以此反应中催化剂的催化作用为均相催化。( )
二、选择题(将每题一个正确答案的标号选出) [TOP]
1.实验测得2ICl(g)+H2(g)→I2(g)+2HCl(g)的反应速率正比于ICl浓度的一次方和H2浓度的一次方。由此可知此反应是 ( )
A.三分子反应,三级反应 B.双分子反应,二级反应 C.一级反应
D.二级反应 E.三分子反应、二级反应
2.某化学反应:A﹢2B →Y,若其速率方程为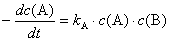 或
或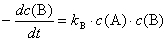 ,则kA与kB的关系是 ( )
,则kA与kB的关系是 ( )
A.kA= kB B.kA=2 kB C.2kA= kB D.kA=3 kB E.3kA= kB
3.某化学反应,反应物反应掉其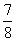 所需时间恰是它反应掉
所需时间恰是它反应掉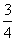 所需时间的1.5倍,则该化学反应的级数是 ( )
所需时间的1.5倍,则该化学反应的级数是 ( )
A.三级反应 B.无法确定 C.二级反应 D.一级反应 E.零级反应
4.某一级反应的半衰期t1/2 是30 min,则其反应速率常数k 为 ( )
A.20.8 min-1 B.0.23 min-1 C.0.023 min-1 D.43.3 min-1 E.30 min-1
5.在某温度下,反应
 NH3
NH3 的平衡常数K = a。上述反应如果改写为2NH3(g)
的平衡常数K = a。上述反应如果改写为2NH3(g) N2(g)+3H2(g),则在相同温度下反应的平衡常数为 ( )
N2(g)+3H2(g),则在相同温度下反应的平衡常数为 ( )
A.a B.1/a C.a2 D.1/a2 E.a/2
三、填空题 [TOP]
1.若反应A+2B → C是基元反应,则其反应的速率方程可以写成 (1),则其反应分子数是(2)。
(1),则其反应分子数是(2)。
2.某反应,反应物反应掉了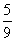 所需的时间是它反应掉
所需的时间是它反应掉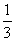 所需时间的2倍,这个反应是(3)级反应。
所需时间的2倍,这个反应是(3)级反应。
3.反应A+B → C的动力学方程式为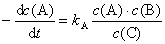 ,则该反应的总级数是(4)级,若浓度以mol·L—1为单位,时间以s为单位,则速率常数的单位是(5)。
,则该反应的总级数是(4)级,若浓度以mol·L—1为单位,时间以s为单位,则速率常数的单位是(5)。
四、问答题 [TOP]
1.为什么反应物间所有的碰撞并不是全部都是有效的?
2.A(g) + B(g) → 产物,总反应一定是二级反应么?
3.零级反应是否是基元反应?具有简单级数的反应是否一定是基元反应?
五、计算题 [TOP]
1.某药物溶液的初始含量为5.0 g·L-1,室温下放置20个月后含量降为4.2 g·L-1。如药物含量降低10%即失效,且其含量降低的反应为一级反应,问:(1)药物的有效期为几个月?(2)半衰期是多少?
2.已知在660K时,测得反应2NO + O2 2NO2 实验数据如下:
2NO2 实验数据如下:

试求:(1)反应速率方程式和反应级数;(2)此温度下的反应速率常数;(3)当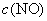 = 0.015 mol·L–1;
= 0.015 mol·L–1; = 0.025 mol·L–1时的反应速率。
= 0.025 mol·L–1时的反应速率。
学生自测答案 [TOP]
一、判断题
1.× 2.√ 3.× 4.√ 5.×
二、选择题
1.D 2.C 3.D 4.C 5.C
三、填空题
1.(1)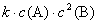 (2)3
(2)3
2.(3)一级
3.(4)一级 (5)s—1
四、问答题 (略)
五、计算题
1.解:因为该药物的降解为一级反应 
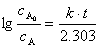
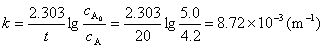
设该药物的有效期为x个月,则:


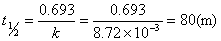
2.解:(1) 设速率方程式为
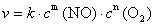
 ①
①
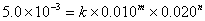 ②
②
 ③
③
由①和②式得: n =1 由②和③式得: m=2
∴ 速率方程式为 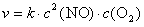 反应级数为三级
反应级数为三级
(2)将表中数据代入速率方程式中得:  L2·mol–2·s–1
L2·mol–2·s–1
(3) 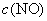 = 0.015 mol·L–1,
= 0.015 mol·L–1, = 0.025 mol·L–1 时,代入速率方程:
= 0.025 mol·L–1 时,代入速率方程:
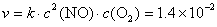 mol·L–1·s–1
mol·L–1·s–1
章后习题答案 [TOP]
习题
1.解释并理解下例名词
(1)反应速率 (2)瞬时速率 (3)元反应 (4)质量作用定律 (5)速率常数 (6) 反应级数(7)半衰期(9)有效碰撞 (9)活化能
解(1)反应体系中各物质的数量随时间的变化率
(2)反应在每一时刻的真实速率
(3)反应物分子直接碰撞一步就能转化为生成物的化学反应
(4)当温度一定时,元反应的反应速率与各反应物浓度以化学反应计量方程式中相应的系数为指数的幂之积成正比
(5)反应速率方程式中的系数k,在数值上等于各反应物浓度均为1mol·L-1时的反应速率;与反应的本性及反应温度有关
(6)反应速率方程式中各反应物浓度方次之和
(7)反应物反应掉一半所需要的时间
(8)能发生反应的碰撞
(9)活化分子具有的最低能量E’ 与反应物分子的平均能量E平之差
2.反应的速率常数k的物理意义是什么?当时间单位为h,浓度单位为mol·L-1,对一
级、二级和零级反应,速率常数的单位各是什么?
解 在数值上等于各反应物浓度均为1mol·L-1时的反应速率,故k又称为反应的比速率。一级反应:h-1; 二级反应:L·mol-1·h-1; 零级反应:mol·L-1·h-1.
3.碰撞理论与过渡态理论各如何阐述反应速率的?
解 碰撞理论认为活化分子在恰当的取向上碰撞才能发生化学反应,活化能越小,反应越快。过渡状态理论认为反应物分子需克服一定的活化能,形成不稳定的高能态活化络合物,这一中间物质能转化为产物也可分解成反应物。反应速率取决于转化为生成物的快慢。过度状态理论借用碰撞理论中活化能的概念,进一步从反应的微观过程以及反应过程中的能量这两个方面与反应速率联系起来考虑,更直观地揭示反应的过程。
4.温度升高或降低,可逆反应的正、逆向化学反应速率都加快或减慢,为什么化学平衡会移动?
解 温度对不同反应速率的影响相差很大,可逆反应的Ea和Ea′值不同但均大于零,温度升高时(其他条件不变),速率常数增大,因此正、逆反应速率都增加。但温度的改变对Ea值大的反应影响显著,所以温度升高正、逆反应速率增加程度不同,化学平衡将移动。
5. 化学反应的等压反应热DrHmq与反应的活化能之间有什么关系?
解 DrHmq = Ea-Ea′
6.在相同温度下有如下两个反应:
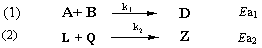
当Ea2 > Ea1时,温度的改变对那一个反应的影响大?请根据Arrhenius方程说明原因。
解 Arrhenius方程为: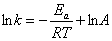 ,对Ea越大的反应,其直线斜率越小(因Ea>0),即k的变化就越大,速率的变化也越大,即表明相同的温度变化对Ea值大的反应影响显著,因此,对反应(2)影响大。
,对Ea越大的反应,其直线斜率越小(因Ea>0),即k的变化就越大,速率的变化也越大,即表明相同的温度变化对Ea值大的反应影响显著,因此,对反应(2)影响大。
7.在SO2氧化成SO3 反应的某一时刻,SO2的反应速率为13.60 mol·L-1·h-1,试求O2
和SO3的反应速率各是多少?
解 反应为
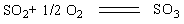
v (SO2) = 1/2 v (O2) = v (SO3)
则有 v (O2) = 2 ´ 13.60 mol·L-1·h-1= 27.2mol·L-1·h-1
v (SO3) = 13.60 mol·L-1·h-1
8.多数农药的水解反应是一级反应,它们的水解速率是杀虫效果的重要参考指标。
溴氰菊酯在20°C时的半衰期是23天。试求在20°C时的水解常数。
解 据题意,溴氰菊酯的水解为一级反应,故
t1/2 = 0.693/ k = 23 d
k = 3.01´ 10-2 d-1
9.25°C时,N2O5的分解反应的半衰期是340min,并且与N2O5的最初压力无关。
求:(1)反应的速率常数是多少?(2)分解完成80%需多少时间?
解 (1) 据题意,此为一级反应,即
t1/2 = 0.693/ k = 340 min
k = 2.04´ 10-3 min-1
(2) ln (p0/p) = 2.04´ 10-3 min-1 ´ t
t = 789 min
10.低浓度蔗糖溶液在酸性条件下水解是准一级反应:
C12H22Oll + H2O ¾® C6H12O6(葡萄糖)+ C6H12O6(果糖)
在45°C时速率常数为1.88´10-2min-1,若蔗糖浓度为0.100 mol·L-1,试计算:
(1)反应开始时的瞬时速率。
(2)反应进行到30min时的瞬时速率。
(3)反应进行到30min时蔗糖的水解率是多少?
解 (1) v= kc0 = 1.88´ 10-2´ 0.100 = 1.88´ 10-3 mol·L-1· min-1
(2) 由 lnc0/c = kt
在30min时 lnc= ln0.100 -1.88 ´ 10-2 min-1´ 30min = -2.303-0.546 = -2.867
c = 0.057 mol·L-1
(3) 30min 时,水解率为  ´ 100% =
´ 100% = 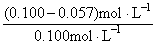 ´ 100% = 43%
´ 100% = 43%
11.气体A的分解反应为A(g) ¾® 产物,当A的浓度为0.50mol ? L –1时,反应速率为0.014 mol·L-1·s-1。如果该反应分别属于 (1)零级反应 (2)一级反应 (3)二级反应,则当A的浓度等于1.0 mol ? L –1时,反应速率常数各是多少?
解 (1)若为零级反应 v = k k = 0.014 mol·L-1·s-1
(2) 若为一级反应 v = kc k = v / c = 0.014 mol·L-1·s-1/ 0.50 mol·L-1 = 0.028 s-1
(3) 若为二级反应 v = kc2 k = v / c2 = 0.014 mol·L-1·s-1/ (0.50 mol·L-1)2
= 0.056 L·mol-1·s-1
12.乙醛的热分解反应是二级反应,733K和833K时,反应的速率常数分别为0.038和2.10 L·mol-1·s-1,求(1)反应的活化能及773K时的速率常数。(2)773K时当乙醛的浓度为0.050 mol·L-1,反应到200s时的速率。
解 (1)由 
则 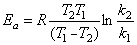
=  = 203.4 kJ·mol-1
= 203.4 kJ·mol-1
同理, 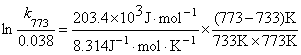 = 1.73
= 1.73
ln k773 = 1.73 -3.27 = - 1.54 k773 = 0.21 L·mol-1·s-1
(2) 对二级反应 
即  0.21 L·mol-1·s-1 ´200s c = 0.016 mol·L-1
0.21 L·mol-1·s-1 ´200s c = 0.016 mol·L-1
v= kc2 = 0.21 L·mol-1·s-1 ´ (0.016 mol·L-1 )2 = 5.38´10-5 mol·L-1·s-1
13.某药物分解35%既失效,在45°C和55°C测出每小时它分解掉0.068%和0.18%,药物的分解率不受药物浓度的影响。问:
(1)此药物在20°C的室温下可保存多长时间?
(2)在4°C冰箱中可保存多长时间?
解 由题意此药物分解反应为一级反应
318K时, 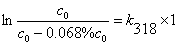
k318 = 0.070 h-1
同理 328K时, k328 = 0.20 h-1
由两个温度下的k值代入公式 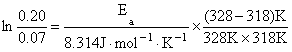
得 Ea = 91.04 kJ·mol-1
(1) 由上述公式可求得 k293 = 3.71 ´10-3 h-1
 即 t = 116h
即 t = 116h
(2) 同理可求得 k277 = 4.28 ´10-4 h-1
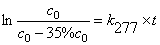 即 t = 1007 h
即 t = 1007 h
14.经呼吸O2进入体内,在血液中发生反应:Hb(血红蛋白) +O2→HbO2(氧合血红蛋白),此反应对Hb和O2均为一级反应。在肺部两者的正常浓度应不低于8.0´10-6和1.6´10-6 mol·L-1,正常体温37°C下,该反应的速率常数k=1.98´106 L·mol-1·s-1 ,计算:
(1)正常人肺部血液中O2的消耗速率和HbO2的生成速率各是多少?
(2)若某位患者的HbO2生成速率达到1.3´10-4 mol·L-1·s-1,通过输氧使Hb浓度维持正常值,肺部O2浓度应为多少?
解 由题可知此反应为二级反应,且根据反应方程式,O2的消耗速率与HbO2的生成速率相同,即
v (O2) = v (HBO2) = k c(O2) c(HB)
(1)v (O2) = v(HBO2)
= 1.98 ´106L·mol-1·s-1´8.0´10-6 mol·L-1´1.6´10-6mol·L-1 = 2.53´10-6 mol·L-1·s-1
(2) c(O2) = 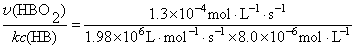
= 6.42´10-6 mol·L-1
15.青霉素G的分解为一级反应,实验测得有关数据如下:

求反应的活化能和指数前因子A。
解 由公式 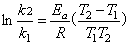
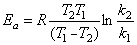
= 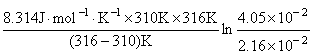 = 85.3 kJ·mol-1
= 85.3 kJ·mol-1
与之相同方法,用不同温度下的k求出三个Ea后,求得均值:Ea =84.7 kJ·mol-1
又 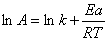
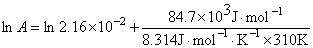
A = 4.04´1012
同理,将不同温度下的k值代入上述关系式,求出三个A值后,得均值:A=4.05´1012
16.在28°C,鲜牛奶大约4h开始变酸,但在5°C的冰箱中可保持48h。假定变酸反应的速率与变酸时间成反比,求牛奶变酸反应的活化能。
解 v∝ k, 由题v∝1/ t , 即 k∝1/ t
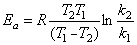

=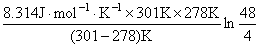 = 75.2 kJ·mol-1
= 75.2 kJ·mol-1
17.反应2HI(g) ¾® H2(g) + I2(g)在无催化剂、金及铂催化时活化能分别为184、105及42kJ ? mol–1,试估算25°C时金、铂催化时反应速率分别是无催化剂时的多少倍?
解 设无催化剂时的速率常数为k1,金、铂为催化剂时的速率常数分别为k2、 k3
由 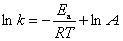
得  = 31.87
= 31.87
 = 7.0´1013 金催化是无催化的7.0´10 13倍
= 7.0´1013 金催化是无催化的7.0´10 13倍
同理 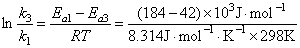 = 57.31
= 57.31
 = 7.8´1024 铂催化是无催化的7.8´10 24倍
= 7.8´1024 铂催化是无催化的7.8´10 24倍
18.某酶催化反应的活化能是50.0 kJ ? mol–1,试估算此反应在发烧至40°C的病人体内比正常人(37°C)加快的倍数(不考虑温度对酶活力的影响)。
解 由 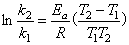 =
=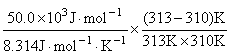 = 0.19
= 0.19
 =1.2 40°C病人体内此酶的催化反应比正常人(37°C)快1.2倍
=1.2 40°C病人体内此酶的催化反应比正常人(37°C)快1.2倍
19.活着的动植物体内14C和12C两种同位素的比值和大气中CO2所含这两种碳同位素的比值是相等的,但动植物死亡后,由于14C不断蜕变(此过程为一级反应)
14C ¾® 14N+e t1/2=5 720a
14C/12C便不断下降,考古工作者根据14C/12C值的变化推算生物化石的年龄,如周口店山顶洞遗址出土的斑鹿骨化石的14C / 12C值是当今活着的动植物的0.109倍,试估算该化石的年龄。
解 由题 14C蜕变反应的速率常数 k = 0.693/ t1/2 = 0.693/5720a = 1.21´10 -4 a-1
化石年龄 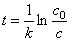 =
= 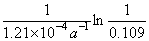 = 1.83´10 4 a
= 1.83´10 4 a
Exercises
1. The major reason why the rate of most chemical reaction increase very rapidly as temperature rises is (a) The fraction of the molecules with kinetic energy greater than the activation energy increases very rapidly as temperature increases. (b) The average kinetic energy increases as temperature rises. (c) The activation energy decreases as temperature increases. (d) The more collisions take place with particles placed so that reaction can occur.
Solution The answer is (a)
2.Psychologists estimate that people forget half of what they’ve learned in six months if they don’t use it or review it. If you take a course in your freshman year and don’t think about the material again until graduation three years later, how much will you remember? (Assume that forgetting takes place by a first-order process).
SolutionAccording to question, t1/2 =0.5 a , t = 3 a .This reaction is first-order reaction, so
k = 0.693 / t1/2 =0.693/ 0.5a =1.386 a
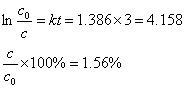
You will remember 1.56% three years later.
3. Use data from the following table to determine the half-life of the first-order decomposition of N2O5 into N2O4 and O2 in CCl4 at 75 °C.

Solution At 25 °C (298K), k298 = 0.693 / t1/2 = 0.693/20029s = 3.46´10 -5s-1, at 50 °C (323K), k323= 0.693 / t1/2 = 0.693/730s = 9.49´10 -4s-1.
For first-order reaction 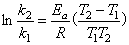
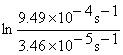 =
=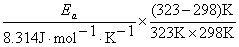
Ea = 106 kJ·mol-1
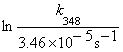 =
=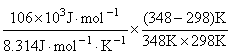 = 6.15
= 6.15
At 75°C (348K) k348 = 1.62´10 -2s-1
t1/2 = 0.693 / k348 = 0.693 /1.62´10 -2s-1 = 43s
4. Researchers have created artificial red blood cells. These artificial red blood cells are cleared from circulation by a first-order reaction with a half-life of about 6 h. If it takes 1 h to get an accident victim, whose red blood cells have been replaced by the artificial red blood cells, to a hospital, what percentage of the artificial red blood cells will be left when the person reaches the hospital?
SolutionAccording to question, t1/2 = 6 h , t = 1 h, for first-order reaction,
k = 0.693 / t1/2 = 0.693/ 6 h = 0.116 h-1
ln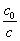 = k t = 0.116 h-1´1 h = 0.116
= k t = 0.116 h-1´1 h = 0.116
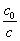 =1.12 , the artificial red blood cells will be left
=1.12 , the artificial red blood cells will be left 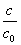 ´100% = 89 %
´100% = 89 %
5. The following data are obtained at a given temperature for the initial rates from a reaction, A + 2B + E → 2C + G.

(a) What are the order of reaction with respect to A, B and E?
(b) What is the value of R5 in terms of R1?
SolutionWe suppose that tentative rate law for this reaction is v = k cα (A) cβ (B) cγ (E)
(a) In comparing experiment 1 with 2, If
v 1= kcα(A) c β(B) cγ(E)=R1
So that v 2= kcα (A) cβ (B) cγ (E) =1/2R1
We can form the ratio v 2 / v 1 = (1/2) α =1/2, α = 1.
Similarly, in comparing experiment 2 with 3 and 1 with 4, we have the values β=2 and γ=-1.In summary, the reaction is first-order in A(α = 1), second-order in B(β=2) and the order of -1 for C(γ=-1).The overall order of reaction is 2.
(b) v 5 = 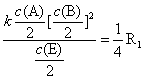
6. If a possible mechanism for the following gas phase reaction is
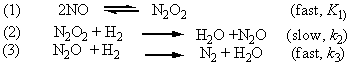
(a)Write the equation for the reaction.
(b) Write the rate law.
Solution(a) the reaction equation is
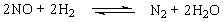
(b) In this complex reaction, the step (1) is fast,
K1=
The step (2) is rate-determining step. So the rate law is
v = k2 c(N2O2)c(H2) = k1 k2 c2(NO) c(H2)
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
高中课本实验《化学反应与能量》 实验报告
第二章化学反应与能量实验报告实验21实验名称铝条与盐酸的化学反应实验目的探究化学反应中的能量变化实验23实验名称盐酸与氢氧化钠溶液…
-
乙酸乙酯皂化反应速率常数的测定实验报告
学号20xx14120xx2基础物理化学实验报告实验名称乙酸乙酯皂化反应速率常数的测定应用化学二班班级03组号实验人姓名xx同组人…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…